FASTJEKT Junior
150 Mikrogramm, Injektionslösung im Fertigpen
Ein Autoinjektor (Fertigpen) mit 2 ml Injektionslösung enthält:
1 mg Epinephrin (Adrenalin) (entsprechend 1,2 mg Epinephrinhydrochlorid).
FASTJEKT Junior gibt als Autoinjektor bei intramuskulärer Injektion eine Einmaldosis von 0,3 ml Injektionslösung mit 150 Mikrogramm (0,15 mg) Epinephrin (Adrenalin) (entsprechend 0,18 mg Epinephrinhydrochlorid) automatisch ab.
Sonstige Bestandteile mit bekannter Wirkung: Natriummetabisulfit (Ph.Eur.) 0,5 mg/Dosis, Natriumchlorid 1,8 mg/Dosis.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Autoinjektor mit klarer, farbloser, steriler Injektionslösung.
FASTJEKT Junior ist ein einfach zu handhabender Fertigpen (Autoinjektor) zum einmaligen Gebrauch.
FASTJEKT Junior ist ein Medikament zur Notfallbehandlung einer schweren allergischen Reaktion (Anaphylaxie) auf z. B. Insektenstiche oder -bisse, Nahrungsmittel, Medikamente oder andere Allergene und bei idiopathischer oder durch Anstrengung ausgelöster Anaphylaxie.
FASTJEKT Junior Autoinjektoren sind zur unmittelbaren Anwendung bei Patienten, die ein erhöhtes Anaphylaxie-Risiko aufweisen, vorgesehen, einschließlich Patienten, bei denen bereits früher eine anaphylaktische Reaktion aufgetreten ist.
FASTJEKT stellt eine Notfallmaßnahme dar und ist nicht als Ersatz für eine anschließende ärztliche Versorgung gedacht.
FASTJEKT Junior wird angewendet bei Kindern von 7,5 kg bis 25 kg Körpergewicht.
Dosierung
Die übliche pädiatrische Dosierung bei Kindern mit 7,5 – 25 kg Körpergewicht für die allergische Notfallbehandlung entspricht 150 Mikrogramm Epinephrin (Adrenalin) intramuskulär mit dem Autoinjektor injiziert.
Als behandelnder Arzt sollten Sie in Abhängigkeit vom Körpergewicht des Kindes in Erwägung ziehen, auch andere Formen injektabilen Adrenalins zu verwenden. Bei Kindern mit mehr als 25 kg Körpergewicht sollte eine höhere Dosierung verabreicht werden (hierfür steht der FASTJEKT mit 300 Mikrogramm Epinephrin (Adrenalin) pro Einmaldosis zur Verfügung). Bei Kindern mit weniger als 7,5 kg Körpergewicht ist der Gebrauch von FASTJEKT Junior nicht zu empfehlen (außer in einer lebensbedrohlichen Situation und unter ärztlicher Aufsicht), da eine Dosis von weniger als 150 Mikrogramm mit dem FASTJEKT Junior nicht verabreicht werden kann.
Bei einer fehlenden klinischen Verbesserung oder falls eine Verschlechterung eintritt, kann eine zweite Injektion mit einem zusätzlichen FASTJEKT Junior Autoinjektor 5 bis 15 Minuten nach der ersten Injektion angewendet werden. Es wird empfohlen, dass den Patienten zwei FASTJEKT Junior Autoinjektoren verschrieben werden, die sie zu jeder Zeit bei sich tragen sollten.
Der Patient muss nach der notfallmäßigen Selbstinjektion auf jeden Fall einen Arzt aufsuchen bzw. zu einem Arzt gebracht werden, damit die weitere Therapie eingeleitet werden kann.
Art der Anwendung durch den Patienten, die Eltern (Begleitperson) oder den Arzt
FASTJEKT Junior schon beim Auftreten von ersten, sicheren Anzeichen einer schweren allergischen Reaktion (eines anaphylaktischen Schocks) anwenden, dabei sofort und entschlossen handeln! Ein anaphylaktischer Schock kann wenige Sekunden bis Minuten nach einem Insektenstich oder anderer Allergenzufuhr auftreten, häufig noch vor Ausbildung einer Lokalreaktion (Hautrötung). Als typische Alarmzeichen gelten Kribbeln oder ähnliche Missempfindungen und Hitzegefühl auf und unter der Zunge und im Rachen sowie besonders in den Handtellern und Fußsohlen. Außerdem können auftreten:
• generalisierter Juckreiz, Hautrötung, Nesselsucht,
• Schwellung der Lippen, Augenlider und der Mund- und Rachenschleimhaut,
• Engegefühl in der Brust, Atembeklemmung,
• Bauchschmerzen, Übelkeit, Erbrechen,
• Hitzewallungen, Schweißausbrüche,
• Schwächegefühl, Schwindelgefühl, Benommenheit,
• unfreiwilliger Abgang von Harn und Stuhl,
• Todesangst,
• Bewusstlosigkeit.
Das gefährdete Kind soll in die Lage versetzt werden, sich Epinephrin (Adrenalin) selbst injizieren zu können oder sich von einer Begleitperson (Eltern) injizieren zu lassen, wenn keine sofortige ärztliche Hilfe erreichbar ist. Dadurch können lebensbedrohliche Situationen beim anaphylaktischen Schock vermieden werden.
Der Arzt, der den FASTJEKT Junior zum Patienteneigengebrauch verschreibt, muss sicherstellen, dass sein Patient (Begleitperson) dessen Einsatzmöglichkeiten beim anaphylaktischen Schock und die Anwendungsweise des Autoinjektors verstanden hat. Er sollte daher die Gebrauchsinformation, den Gebrauch im Einzelnen und die Symptome des anaphylaktischen Schocks detailliert mit dem Patienten besprechen.
Zu Demonstrations- und Übungszwecken ist hierfür ein sogenannter „FASTJEKT Trainer“ (ohne Injektionslösung und ohne Injektionsnadel) erhältlich.
Für den Einsatz im Notfall die blaue Sicherheitskappe des Autoinjektors gerade abziehen! Sie dient dazu, ein ungewolltes Auslösen des Injektors zu verhindern. Nach der Entfernung der Sicherheitskappe ist der Autoinjektor entsichert, und die Injektionsnadel, die sich vorn innerhalb der orangefarbenen Plastikspitze befindet, kann nun durch Druck selbsttätig heraustreten. Die durch die Mechanik des Autoinjektors vorgegebene Dosis Injektionslösung wird intramuskulär automatisch durch ein schnelles und kräftiges Aufdrücken des orangefarbenen Endes des Autoinjektors auf die Außenseite des Oberschenkels sofort injiziert (Einzelheiten vgl. Punkt: Handhabung im Notfall). Die Wahl des Oberschenkels als Injektionsort vermindert die Gefahr, dass die Injektion versehentlich intravaskulär erfolgt. Eine intravaskuläre Injektion muss unbedingt vermieden werden. Es darf nicht ins Gesäß oder andere Körperregionen wie z.B. Hände oder Füße injiziert werden. Es wurde über eine periphere Ischämie nach einer versehentlichen Injektion in die Hände oder Füße berichtet (siehe Abschnitt 4.4).
Der Epinephrin (Adrenalin)-Vorrat wird bei der Anwendung nicht vollständig abgegeben. Aus Sicherheitsgründen ist der FASTJEKT Junior überfüllt (ca. 1,7 ml Lösung verbleiben im Autoinjektor).
Hinweis für Bienengiftallergiker:
Der Stachel der Honigbiene (samt Giftapparat) bleibt nach dem Stich in der Haut stecken, während Wespe, Hornisse und Hummel ihren Stachel nach dem Stich aus der Wunde zurückziehen.
Der Bienenstachel (samt Giftapparat) wird umgehend mit Pinzette oder Fingernagel vorsichtig seitwärts aus der Stichstelle herausgekratzt, damit so wenig Bienengift wie möglich in die Stichwunde gelangt. Hierbei ist ein Drücken oder Quetschen unbedingt zu vermeiden, da sonst noch mehr Gift in den Körper gelangt!
Handhabung im Notfall:
Der FASTJEKT Junior ist gebrauchsfertig und kann sofort benutzt werden. Im Notfall kann durch die Hose hindurch injiziert werden.

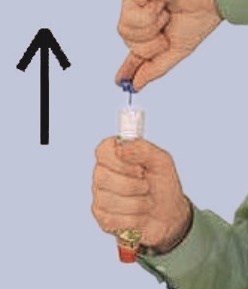
Blaue Sicherheitskappe Sichtfenster Orangefarbene Spitze
(nur im Notfall abziehen) (Nadelaustritt!)
Wichtig:
Die Verpackung des FASTJEKT Junior entfernen.
Blaue Sicherheitskappe gerade abziehen. Die orangefarbene Spitze nicht mit den Fingern oder der Hand berühren oder darauf drücken.
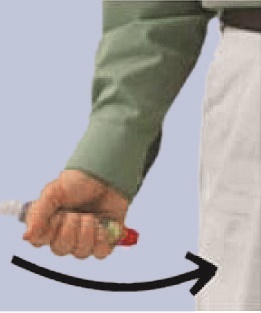
Den FASTJEKT Junior ca. 10 cm von der Außenseite des Oberschenkels entfernt halten. Die orangefarbene Spitze sollte in Richtung der Außenseite des Oberschenkels zeigen.

Den Schaft des FASTJEKT Junior mit der dominanten Hand fest umfassen und die orangefarbene Plastikspitze im rechten Winkel mit einer schnellen Bewegung kräftig gegen die Außenseite des Oberschenkels aufsetzen und drücken, bis die Injektionsnadel deutlich hörbar auslöst.
FASTJEKT Junior mindestens 3 Sekunden in dieser Stellung festhalten. Die Injektion ist danach vollständig erfolgt und das Sichtfenster des Autoinjektors verdunkelt.
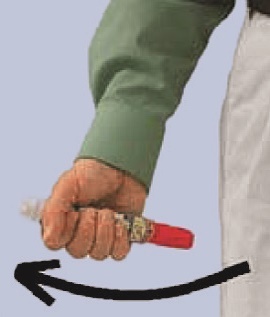
Danach den Autoinjektor entfernen. Der orangefarbene Nadelschutz ragt jetzt weiter heraus und verdeckt die Nadel.
Der Patient/die Begleitperson sollte darüber informiert werden, nach der Anwendung von FASTJEKT Junior das Folgende zu tun:
Notrufnummer 112 wählen, nach einem Notarzt/Rettungswagen fragen und das Stichwort „Anaphylaxie“ nennen (auch wenn anscheinend eine Verbesserung eingetreten ist, siehe Abschnitt 4.4)
Patienten bei Bewusstsein sollten flach liegen, mit hochgelagerten Füßen, es sei denn, sie zeigen Atemschwierigkeiten; in diesem Fall sollten sich die Patienten hinsetzen. Bewusstlose Patienten sollten in der stabilen Seitenlage gelagert werden.
Falls möglich, sollte der Patient bis zum Eintreffen des Arztes nicht allein bleiben.
Der Patient soll sich nach der Anwendung sofort in ärztliche Behandlung begeben und den gebrauchten FASTJEKT Junior mitnehmen.
Den benutzten FASTJEKT Junior nicht demontieren. Die Treibfeder wird bei der Anwendung nur teilentspannt.
Es ist möglich, dass sich im FASTJEKT Junior eine kleine Blase bildet, die jedoch keinen Einfluss auf das Produkt bzw. dessen Wirksamkeit hat.
Dauer der Anwendung
Der FASTJEKT Junior ist zum einmaligen Gebrauch bestimmt. Nach dem Gebrauch ist der Injektor durch einen neuen zu ersetzen. Bei Erreichen des Verfalldatums oder bei Verfärbung der Injektionslösung muss ebenfalls ein neuer FASTJEKT Junior verordnet werden.
Es sind keine absoluten Gegenanzeigen bekannt bei Verwendung des FASTJEKT Junior während der allergischen Notfallbehandlung.
Alle Patienten, die einen FASTJEKT Junior verschrieben bekommen, sollten eine detaillierte Anweisung für den Gebrauch erhalten, damit sie die Einsatzmöglichkeiten und die korrekte Anwendung verstehen (siehe Abschnitt 4.2). Es wird auch dringend geraten, den Patienten nahestehende Personen (z. B. Eltern, Pflegepersonal, Lehrer) über den korrekten Gebrauch von FASTJEKT Junior aufzuklären, falls in einer Notfallsituation eine Unterstützung durch diese Personen notwendig wird.
Der Patient sollte angewiesen werden, die Notrufnummer 112 zu wählen, nach einem Notarzt/Rettungswagen zu fragen und das Stichwort „Anaphylaxie“ zu nennen, um eine unmittelbare ärztliche Behandlung nach der Anwendung der ersten Dosis und damit ein genaues Überwachen des anaphylaktischen Ereignisses und eine weitere adäquate Behandlung zu gewährleisten.
Bei Patienten mit Herz- und Kreislauf-Erkrankungen wie Angina pectoris, obstruktiver Kardiomyopathie, Herzrhythmusstörungen, Cor pulmonale und Atherosklerose wird Epinephrin (Adrenalin) im Normalfall nur unter größter Vorsicht verabreicht. Nur wenn der Nutzen das Risiko überschreitet, sollte Epinephrin (Adrenalin) diesen Patienten verschrieben werden. Gleiches gilt für Patienten mit Hypertonie, Diabetes mellitus, Hyperthyreose, Hyperkalzämie, Hypokaliämie, Phäochromozytom, Engwinkelglaukom oder schwerer Nierenfunktionsstörung.
Bei Patienten mit einer ausgeprägten subkutanen Fettgewebsschicht besteht das Risiko, dass Epinephrin (Adrenalin) nicht in das Muskelgewebe gelangen kann und somit eine nur suboptimale Wirkung erreicht wird (siehe Abschnitt 5.2). Das kann die Notwendigkeit einer zweiten Injektion mit einem weiteren FASTJEKT Junior erhöhen (siehe Abschnitt 4.2).
Der Patient bzw. die Eltern/Begleitperson sollten über die Möglichkeit einer biphasischen Anaphylaxie informiert werden, bei der es nach einer ersten Verbesserung im Laufe von einigen Stunden zu einem Wiederauftreten der Symptome kommen kann.
Patienten mit Asthma können ein erhöhtes Risiko für das Auftreten von schweren anaphylaktischen Reaktionen aufweisen.
Patienten sollten vor der Möglichkeit von Kreuzallergien gewarnt werden, und die auslösenden Allergene sollten nach Möglichkeit untersucht und bestimmt werden.
Der Autoinjektor sollte in die Außenseite des Oberschenkels injiziert werden. Die Patienten sollten angewiesen werden, das Arzneimittel nicht in das Gesäß zu injizieren.
Im Falle der Injektion durch eine Begleitperson sollte das Bein des Patienten während der Injektion ruhiggestellt werden, um das Risiko einer Verletzung an der Injektionsstelle zu minimieren.
Der bereits benutzte Autoinjektor darf auf keinen Fall erneut verwendet werden.
Unbeabsichtigte Injektionen in Hände und Füße rufen eine periphere Ischämie hervor. Eine Behandlung durch den Arzt könnte notwendig sein.
Die blaue Sicherheitskappe des Autoinjektors nur für den Einsatz im Notfall gerade abziehen! Die blaue Sicherheitskappe dient dazu, ein ungewolltes Auslösen des Injektors zu verhindern. Das Abziehen der Sicherheitskappe entsichert den Injektor für die Abgabe der Epinephrin (Adrenalin)-Lösung. Versehentlich entsicherte Injektoren sind ebenso wie beschädigte Injektoren durch neue zu ersetzen.
Die Anwendung von FASTJEKT Junior kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Aufgrund des Gehaltes an Natriummetabisulfit kann es selten zu schweren Überempfindlichkeitsreaktionen und Bronchospasmen kommen, die sich als Erbrechen, Durchfall, keuchende Atmung, akuter Asthmaanfall, Bewusstseinsstörung oder Schock äußern können. Patienten, die diese Voraussetzungen aufweisen, müssen genau über die Umstände, unter denen FASTJEKT Junior angewendet werden sollte, aufgeklärt werden.
FASTJEKT Junior enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Einmaldosis.
Vorsicht ist bei Patienten angezeigt, welche Medikamente einnehmen, die das Herz für Arrhythmien sensibilisieren können wie Digitalisglykoside, Chinidine, Halothan oder Cyclopropan. Betablocker können die kardialen und bronchodilatatorischen Wirkungen von Epinephrin aufheben. Die blutdrucksteigernde Wirkung des Epinephrins kann bei gleichzeitiger Gabe von Betablockern sehr stark erhöht werden. Die Wirkung des Epinephrins (Adrenalins) kann durch die Einnahme von tri- und tetrazyklischen Antidepressiva, Monoaminoxidasehemmern, Catechol-o-Methyltransferase (COMT)-Hemmern, Schilddrüsenhormonen, Theophyllin, Oxytocin, Parasympatholytika, bestimmten Antihistaminika (Diphenhydramin, Chlorpheniramin), Levodopa und Alkohol verstärkt werden.
Epinephrin (Adrenalin) hemmt die Insulinsekretion und bewirkt so einen Anstieg des Blutglukosespiegels. Deshalb könnte es bei Diabetikern erforderlich sein nach Epinephrin (Adrenalin)-Injektion die Insulindosis oder die Dosis der oralen hypoglykämischen Medikation zu erhöhen [cave: kurze Halbwertszeit von Epinephrin (Adrenalin)].
Natriummetabisulfit ist eine sehr reaktionsfähige Verbindung. Es muss deshalb damit gerechnet werden, dass mit FASTJEKT Junior zusammen verabreichtes Thiamin (Vitamin B1) abgebaut wird.
Nicht zutreffend.
Nach der Applikation von FASTJEKT Junior wird den Patienten empfohlen nicht aktiv am Straßenverkehr (z. B. Radfahren) teilzunehmen, da sie unter Umständen noch unter den Symptomen des anaphylaktischen Schocks leiden.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100, <1/10)
Gelegentlich (>1/1 000, <1/100)
Selten (>1/10 000, <1/1 000)
Sehr selten (<1/10 000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Eine obengenannte Häufigkeitsangabe der Nebenwirkungen gemäß der MedDRA Häufigkeitsdefinitionen ist für den Fastjekt Junior nicht möglich, da die Anzahl der wirklich verabreichten Fertigarzneimittel in der Notfalltherapie nicht exakt ermittelbar und somit auch die Nebenwirkungsrate nicht korrelierbar ist. Viele Packungen des Notfalltherapeutikums werden nicht verwendet und verfallen.
Nebenwirkungen, die mit der Alpha- und Beta-Rezeptoraktivität des Epinephrins (Adrenalins) assoziiert sind, können sowohl den Blutkreislauf betreffen als auch das ZNS und die Blutzuckerregulation.
MedDRA Systemorganklasse | Häufigkeit | Nebenwirkungen |
Infektionen und parasitäre Erkrankungen | Nicht bekannt | Infektion an der Injektionsstelle* |
Stoffwechsel und Ernährungsstörungen | Nicht bekannt | Hyperglykämie, Hypokaliämie, |
Psychiatrische Erkrankungen | Nicht bekannt | Angst, Anspannung, Unruhe |
Erkrankungen des Nervensystems | Nicht bekannt | Schwindel, Benommenheit, |
Herzerkrankungen | Selten | Stress-Kardiomyopathie |
Nicht bekannt | Tachykardie, Herzrhythmusstörungen, | |
Gefäßerkrankungen | Nicht bekannt | erhöhter Blutdruck, peripheres Kältegefühl, Hautblässe, |
Erkrankungen der Atemwege, des Brustraums und des Mediastinums | Nicht bekannt | Bronchospasmus, Dyspnoe, Lungenödem, Atembeschwerden |
Erkrankungen des Gastrointestinaltrakts | Nicht bekannt | Übelkeit, Erbrechen |
Erkrankungen der Haut und des Unterhautgewebes | Nicht bekannt | Schwitzen |
Erkrankungen der Nieren und Harnwege | Nicht bekannt | Niereninsuffizienz |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Nicht bekannt | Asthenie |
* Aus der Erfahrung nach der Zulassung sind seltene Fälle von schweren Infektionen der Haut und Weichteile bekannt, einschließlich durch Clostridien (Gasgangrän) hervorgerufene nekrotisierende Fasziitis und Myonekrose
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: https://www.bfarm.de, anzuzeigen.
Bei Überdosierung oder unbeabsichtigter intravaskulärer Injektion von Epinephrin (Adrenalin) können zerebrale Blutungen und ventrikuläre Arrhythmien entstehen, hervorgerufen durch den starken Blutdruckanstieg. Myokardiale Ischämien und Nekrosen, Lungenödem und Niereninsuffizienz können die Folge sein. Diesen Epinephrin (Adrenalin)-Nebenwirkungen kann durch die Applikation eines Alpha-Sympatholytikums oder die Gabe eines peripheren Vasodilatators entgegengewirkt werden. Stehen die tachyarrhythmischen Nebenwirkungen im Vordergrund, ist zusätzlich die Anwendung eines Betablockers angezeigt.
Pharmakotherapeutische Gruppe: Kardiostimulanzien, exkl. Herzglykoside, adrenerge und dopaminerge Mittel
ATC-Code: C01CA24
Beim anaphylaktischen Schock, wie er besonders nach Insektenstichen vorkommt, stellt Epinephrin (Adrenalin) das Mittel der ersten Wahl dar, da der Pathogenese des Schocks in Form einer Erweiterung der kleinen Blutgefäße durch Gefäßkontraktion entgegengewirkt wird.
Epinephrin (Adrenalin) als Katecholamin stimuliert das sympathische Nervensystem (Alpha- und Beta- Rezeptoren), wodurch Herzschlagfrequenz, Herzschlagvolumen und die koronare Blutzirkulation ansteigen. Durch seine Wirkung auf die Beta-Rezeptoren der glatten Bronchialmuskulatur verursacht Epinephrin (Adrenalin) ein Erschlaffen dieser Muskulatur, und Stenoseatmung und Atemnot können gelindert werden.
Epinephrin (Adrenalin) ist eine natürlich vorkommende Substanz, die bei Anstrengung oder Stress vom Nebennierenmark produziert und sezerniert wird. Ihre Wirkungsdauer ist kurz. Die Plasmahalbwertszeit liegt bei ca. 2,5 Minuten. Sie wird rasch inaktiviert, nahezu vollständig in der Leber metabolisiert (Catechol-O-Methyltransferase (COMT), Monoaminooxidase (MAO)) und ihre Metabolite renal eliminiert. Jedoch wird die Absorption bei subkutaner und intravenöser Verabreichung aufgrund der lokalen Vasokonstriktion verzögert, sodass die adrenerge Wirkung länger anhalten kann als die Plasmahalbwertszeit angibt. Bei korrekter Anwendung jedoch sollte eine intramuskuläre Injektion erfolgen.
In einer Studie zur Pharmakokinetik mit 35 gesunden Probanden, die entsprechend der Dicke der subkutanen Fettgewebsschicht im Oberschenkel in Gruppen eingeteilt und nach Geschlecht stratifiziert wurden, wurde eine Einmalinjektion mit dem FASTJEKT Autoinjektor von 0,3 mg/0,3 ml in die Außenseite des Oberschenkels (auf mittlerer Höhe) im Crossover-Design mit einer manuell über eine Spritze verabreichten Dosis, deren Nadeln zur Verabreichung in Muskelschichten angepasst waren, verglichen. Die Ergebnisse zeigen, dass weibliche Probanden Epinephrin (Adrenalin) bei einer ausgeprägten subkutanen Fettgewebsschicht (> 20 mm Abstand zwischen Haut und Muskel unter maximaler Kompression) langsamer resorbiert haben, welches sich im Trend zur Verringerung der Plasmaexposition bei den Probanden in den ersten 10 Minuten nach der Injektion widergespiegelt hat (siehe Abschnitt 4.4). Die gesamte gemessene Adrenalin-Exposition von 0 bis 30 Minuten (AUC0-30min) war jedoch bei allen mit dem FASTJEKT behandelten Gruppen höher als bei den mit der Spritze behandelten Gruppen. Darüber hinaus ist ein Trend zur höheren Plasma-Adrenalin-Konzentration nach der Anwendung von FASTJEKT im Vergleich zu manuellen intramuskulären Injektionen in gesunden Probanden mit gut durchbluteten subkutanem Gewebe zu erkennen, welcher nicht zwingend auf Patienten mit bestehendem anaphylaktischen Schock mit Diversion des Blutes von der Haut zu den Beinmuskeln extrapoliert werden kann. Die Möglichkeit einer existierenden kutanen Vasokonstriktion zum Zeitpunkt der Injektion muss daher berücksichtigt werden. Sowohl die inter- als auch die intraindividuelle Variabilität waren in dieser Studie hoch, so dass abschließende Schlussfolgerungen nicht möglich sind.
Präklinische Effekte wurden nur nach Expositionen beobachtet, die ausreichend über der maximalen humantherapeutischen Exposition lagen. Die Relevanz für den Menschen wird als gering bewertet.
Epinephrin (Adrenalin) wird schon seit vielen Jahren zur Behandlung akuter allergischer Notfälle angewendet.
Natriumchlorid
Natriummetabisulfit (Ph.Eur.)
Salzsäure (zur Einstellung des pH-Werts)
Wasser für Injektionszwecke
Epinephrin (Adrenalin) wird in Lösung rasch durch Oxidationsmittel abgebaut. Die Oxidation kann durch Zugabe von Anti-Oxidantien verhindert werden. Die Lösung dunkelt durch Licht- und Luftexposition nach.
19 Monate
Nicht über 25 ºC lagern.
Autoinjektor in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Nicht im Kühlschrank lagern oder einfrieren.
Auf dem Fertigarzneimittel angegebenes Verfalldatum beachten. Nach Ablauf des Verfalldatums Autoinjektor nicht mehr verwenden. Gleiches gilt, wenn sich die Lösung verfärbt. Die Lösung sollte daher regelmäßig durch das Sichtfenster auf dem Autoinjektor geprüft werden, um sicherzustellen, dass sie klar und farblos ist.
Arzneimittel unzugänglich für Kinder aufbewahren. Dies gilt nicht für das von Anaphylaxie bedrohte Kind, dem FASTJEKT Junior verschrieben wurde.
Das Primärbehältnis besteht aus einer Glashülse, welche an einem Ende durch einen Gummikolben (Spritzenkolben) und am Ort des Kanülenansatzes durch eine Gummimembran (Diaphragma) verschlossen ist. Das Primärbehältnis enthält die Epinephrin (Adrenalin)-Lösung.
Autoinjektor Material Primärbehältnis:
Glashülse, Glas Typ I, Borsilikat
Diaphragma / Spritzenkolben:
PH 701/50/schwarz (Butylgummi)
Nadel – Nabe – Scheide:
Nadel: Typ 304 Edelstahl silikonisiert (ausgelöste und geschützte Nadellänge nach Injektion: ca. 13 mm)
Nabe: 3003 anodisierte Aluminiumlegierung
Scheide: synthetisches Polyisopren
Packungsgröße:
1 Autoinjektor zur einmaligen Dosierung von 0,3 ml Injektionslösung.
Doppelpackung mit 2 x 1 Autoinjektor. Jeder Autoinjektor zur jeweils einmaligen Dosierung von 0,3 ml Injektionslösung.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Nicht benutzte Autoinjektoren (nach Ablauf der Haltbarkeit oder bei Verfärbung der Injektionslösung) dürfen für die Entsorgung nicht ausgelöst werden.
Siehe Abschnitte 4.2 und 4.4 für weitere Anweisungen an den Patienten bzw. die Eltern/Begleitperson hinsichtlich der zu treffenden Maßnahmen nach der Anwendung von FASTJEKT Junior.
Viatris Healthcare GmbH
Lütticher Straße 5
53842 Troisdorf
65312.00.00
Datum der Erteilung der Zulassung: 30. März 2007
Datum der letzten Verlängerung der Zulassung: 31. Juli 2012
August 2024
Verschreibungspflichtig
Zusätzliche Informationen, die zur sicheren Anwendung des Arzneimittels beitragen (behördlich genehmigtes Schulungsmaterial), finden Sie, indem Sie mit einem Smartphone den QR-Code in der Fachinformation scannen. Dieselbe Information finden Sie auch unter folgenden Links: https://www.viatris.de/de-de/produkte/behoerdlich-beauflagte-schulungsmaterialien/fastjekt oder unter https://www.mein-fastjekt.de.