Lonsurf 15 mg/6,14 mg Filmtabletten
Lonsurf 20 mg/8,19 mg Filmtabletten
Lonsurf 15 mg/6,14 mg Filmtabletten
Jede Filmtablette enthält 15 mg Trifluridin und 6,14 mg Tipiracil (als Hydrochlorid).
Sonstiger Bestandteil mit bekannter Wirkung
Jede Filmtablette enthält 90,735 mg Lactose‑Monohydrat.
Lonsurf 20 mg/8,19 mg Filmtabletten
Jede Filmtablette enthält 20 mg Trifluridin und 8,19 mg Tipiracil (als Hydrochlorid).
Sonstiger Bestandteil mit bekannter Wirkung
Jede Filmtablette enthält 120,980 mg Lactose‑Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette (Tablette).
Lonsurf 15 mg/6,14 mg Filmtabletten
Die Tablette ist eine weiße, bikonvexe, runde Filmtablette mit einem Durchmesser von 7,1 mm und einer Dicke von 2,7 mm, mit ‘15’ auf einer Seite und ‘102’ und ’15 mg’ auf der anderen Seite mit grauer Tinte aufgedruckt.
Lonsurf 20 mg/8,19 mg Filmtabletten
Die Tablette ist eine blassrote, bikonvexe, runde Filmtablette mit einem Durchmesser von 7,6 mm und einer Dicke von 3,2 mm, mit ‘20’ auf der einen Seite und ‘102’ und ’20 mg’ auf der anderen Seite mit grauer Tinte aufgedruckt.
Kolorektales Karzinom
Lonsurf wird angewendet in Kombination mit Bevacizumab zur Behandlung von erwachsenen Patienten mit metastasiertem kolorektalem Karzinom (KRK), die zuvor bereits zwei Krebstherapien erhalten haben. Diese Therapien beinhalten Fluoropyrimidin-, Oxaliplatin- und Irinotecan-basierte Chemotherapien, Anti-VEGF- und/oder Anti-EGFR-Substanzen.
Lonsurf wird angewendet als Monotherapie zur Behandlung von erwachsenen Patienten mit metastasiertem kolorektalem Karzinom, die bereits mit verfügbaren Therapien behandelt wurden oder die für diese nicht geeignet sind. Diese Therapien beinhalten Fluoropyrimidin‑, Oxaliplatin‑ und Irinotecan‑basierte Chemotherapien, Anti-VEGF- und Anti-EGFR-Substanzen.
Magenkarzinom
Lonsurf wird angewendet als Monotherapie zur Behandlung von erwachsenen Patienten mit metastasiertem Magenkarzinom einschließlich Adenokarzinom des gastroösophagealen Übergangs, die bereits mit mindestens zwei systemischen Therapieregimen für die fortgeschrittene Erkrankung behandelt worden sind (siehe Abschnitt 5.1).
Lonsurf sollte nur von Ärzten verschrieben werden, die Erfahrung in der Anwendung von Krebstherapien haben.
Dosierung
Die empfohlene Anfangsdosis Lonsurf bei Erwachsenen, als Monotherapie oder in Kombination mit Bevacizumab, beträgt 35 mg/m2/Dosis zweimal täglich oral an Tag 1-5 und Tag 8-12 von jedem 28-Tagezyklus gegeben, solange ein Nutzen beobachtet wird, es zu einem Krankheitsprogress kommt oder bis zum Auftreten einer inakzeptablen Toxizität (siehe Abschnitt 4.4).
Bei Verwendung von Lonsurf in Kombination mit Bevacizumab zur Behandlung von metastasiertem KRK beträgt die Dosis von Bevacizumab 5mg/kg Körpergewicht einmal alle zwei Wochen. Bitte beachten Sie die Fachinformation von Bevacizumab.
Die Dosis wird anhand der Körperoberfläche (KOF) berechnet (siehe Tabelle 1). Die Dosis darf 80 mg/Dosis nicht überschreiten.
Wenn eine Dosis versäumt oder ausgelassen wurde, darf der Patient die versäumte Dosis nicht nachholen.
Tabelle 1: Berechnung der Anfangsdosis nach KOF
Anfangsdosis | KOF (m2) | Dosis in mg | Tabletten pro Dosis | Tägliche Gesamtdosis (mg) | |
15 mg/6,14 mg | 20 mg/8,19 mg | ||||
35 mg/m2 | < 1,07 | 35 | 1 | 1 | 70 |
1,07 – 1,22 | 40 | 0 | 2 | 80 | |
1,23 – 1,37 | 45 | 3 | 0 | 90 | |
1,38 – 1,52 | 50 | 2 | 1 | 100 | |
1,53 – 1,68 | 55 | 1 | 2 | 110 | |
1,69 – 1,83 | 60 | 0 | 3 | 120 | |
1,84 – 1,98 | 65 | 3 | 1 | 130 | |
1,99 – 2,14 | 70 | 2 | 2 | 140 | |
2,15 – 2,29 | 75 | 1 | 3 | 150 | |
≥ 2,30 | 80 | 0 | 4 | 160 | |
Empfohlene Dosisanpassung
Abhängig von der individuellen Sicherheit und Verträglichkeit kann eine Dosisanpassung erforderlich sein.
Maximal drei Dosisreduktionen bis zum Erreichen einer Minimaldosis von 20 mg/m2 zweimal täglich sind erlaubt. Nach einer Dosisreduktion von Lonsurf darf diese nicht wieder erhöht werden.
Bei Auftreten einer hämatologischen und/oder nicht-hämatologischen Toxizität sollten Patienten entsprechend dem Schema zur Dosisunterbrechung, -wiederaufnahme und -reduktion der Tabelle 2, Tabelle 3 und Tabelle 4 behandelt werden.
Tabelle 2: Dosisunterbrechungs- und Dosiswiederaufnahmekriterien bei | |||
Parameter | Unterbrechungskriterien | Wiederaufnahmekriteriena | |
Neutrophile Granulozyten | < 0,5 × 109/l | ≥ 1,5 × 109/l | |
Thrombozyten | < 50 × 109/l | ≥ 75 × 109/l | |
a | Wiederaufnahmekriterien zur Anwendung beim nächsten Zyklusbeginn bei allen Patienten unabhängig davon, ob die Unterbrechungskriterien erfüllt wurden. | ||
Tabelle 3: Empfohlene Dosisänderung für Lonsurf bei hämatologischen und nicht‑hämatologischen Nebenwirkungen | |
Nebenwirkung | Empfohlene Dosisänderung |
|
|
*Common Terminology Criteria for Adverse Events | |
Tabelle 4: Dosisreduktion nach KOF
Reduzierte Dosis | KOF (m2) | Dosis in mg | Tabletten pro Dosis | Tägliche Gesamtdosis (mg) | ||
15 mg/6,14 mg | 20 mg/8,19 mg | |||||
Stufe 1 Dosisreduktion: Von 35 mg/m2 auf 30 mg/m2 | ||||||
30 mg/m2 | < 1,09 | 30 | 2 | 0 | 60 | |
1,09 – 1,24 | 35 | 1 | 1 | 70 | ||
1,25 – 1,39 | 40 | 0 | 2 | 80 | ||
1,40 – 1,54 | 45 | 3 | 0 | 90 | ||
1,55 – 1,69 | 50 | 2 | 1 | 100 | ||
1,70 – 1,94 | 55 | 1 | 2 | 110 | ||
1,95 – 2,09 | 60 | 0 | 3 | 120 | ||
2,10 – 2,28 | 65 | 3 | 1 | 130 | ||
≥ 2,29 | 70 | 2 | 2 | 140 | ||
Stufe 2 Dosisreduktion: Von 30 mg/m2 auf 25 mg/m2 | ||||||
25 mg/m2 | < 1,10 | 25a | 2a | 1a | 50a | |
1,10 – 1,29 | 30 | 2 | 0 | 60 | ||
1,30 – 1,49 | 35 | 1 | 1 | 70 | ||
1,50 – 1,69 | 40 | 0 | 2 | 80 | ||
1,70 – 1,89 | 45 | 3 | 0 | 90 | ||
1,90 – 2,09 | 50 | 2 | 1 | 100 | ||
2,10 – 2,29 | 55 | 1 | 2 | 110 | ||
≥ 2,30 | 60 | 0 | 3 | 120 | ||
Stufe 3 Dosisreduktion: Von 25 mg/m2 auf 20 mg/m2 | ||||||
20 mg/m2 | < 1,14 | 20 | 0 | 1 | 40 | |
1,14 – 1,34 | 25a | 2a | 1a | 50a | ||
1,35 – 1,59 | 30 | 2 | 0 | 60 | ||
1,60 – 1,94 | 35 | 1 | 1 | 70 | ||
1,95 – 2,09 | 40 | 0 | 2 | 80 | ||
2,10 – 2,34 | 45 | 3 | 0 | 90 | ||
≥ 2,35 | 50 | 2 | 1 | 100 | ||
a | Bei einer täglichen Gesamtdosis von 50 mg sollten Patienten eine 20 mg/8,19 mg-Tablette am Morgen und zwei 15 mg/6,14 mg-Tabletten am Abend einnehmen. | |||||
Besondere Patientengruppen
Nierenfunktionsstörung
Leichte (ClKr 60 bis 89 ml/min) oder mäßige Nierenfunktionsstörung (ClKr 30 bis 59 ml/min)
Eine Anpassung der Anfangsdosis wird bei Patienten mit leichter bis moderater Nierenfunktionsstörung nicht empfohlen (siehe Abschnitte 4.4 und 5.2).
Schwere Nierenfunktionsstörung (ClKr 15 bis 29 ml/min)
Für Patienten mit schwerer Nierenfunktionsstörung wird eine Anfangsdosis von 20 mg/m² zweimal täglich empfohlen (siehe Abschnitte 4.4 und 5.2). Eine Dosisreduktion auf eine Minimaldosis von 15 mg/m² ist, basierend auf der individuellen Sicherheit und Verträglichkeit, erlaubt (siehe Tabelle 5). Eine Dosiseskalation nach einer erfolgten Dosisreduktion ist nicht erlaubt.
Bei Auftreten von hämatologischen und/oder nicht-hämatologischen Toxizitäten sollten Patienten den Kriterien zu Dosisunterbrechung, Dosiswiederaufnahme und Dosisreduktion aus Tabelle 2, Tabelle 3 und Tabelle 5 folgen.
Tabelle 5 – Anfangsdosis und Dosisreduktion für Patienten mit schwerer Nierenfunktionsstörung nach KOF
Reduzierte Dosis | KOF (m2) | Dosis in mg | Tabletten pro Dosis | Tägliche Gesamtdosis (mg) | ||
15 mg/6,14 mg | 20 mg/8,19 mg | |||||
Anfangsdosis | ||||||
20 mg/m2 | < 1,14 | 20 | 0 | 1 | 40 | |
1,14 – 1,34 | 25a | 2a | 1a | 50a | ||
1,35 – 1,59 | 30 | 2 | 0 | 60 | ||
1,60 – 1,94 | 35 | 1 | 1 | 70 | ||
1,95 – 2,09 | 40 | 0 | 2 | 80 | ||
2,10 – 2,34 | 45 | 3 | 0 | 90 | ||
≥ 2,35 | 50 | 2 | 1 | 100 | ||
Dosisreduktion: Von 20 mg/m2 auf 15 mg/m2 | ||||||
15 mg/m2 | < 1,15 | 15 | 1 | 0 | 30 | |
1,15 – 1,49 | 20 | 0 | 1 | 40 | ||
1,50 – 1,84 | 25a | 2a | 1a | 50a | ||
1,85 – 2,09 | 30 | 2 | 0 | 60 | ||
2,10 – 2,34 | 35 | 1 | 1 | 70 | ||
≥ 2,35 | 40 | 0 | 2 | 80 | ||
a | Bei einer Gesamttagesdosis von 50 mg sollten Patienten 1 Tablette 20 mg/8,19 mg am Morgen und 2 Tabletten 15 mg/6,14 mg am Abend einnehmen. | |||||
Terminale Niereninsuffizienz (ClKr unter 15 ml/min oder Dialyse erforderlich)
Die Anwendung bei Patienten mit terminaler Niereninsuffizienz wird nicht empfohlen, da keine Daten für diese Patienten vorliegen (siehe Abschnitt 4.4).
Leberfunktionsstörung
Leichte Leberfunktionsstörung
Eine Anpassung der Anfangsdosis wird bei Patienten mit leichter Leberfunktionsstörung nicht empfohlen (siehe Abschnitt 5.2).
Mäßige oder schwere Leberfunktionsstörung
Die Anwendung bei Patienten mit mäßiger oder schwerer Leberfunktionsstörung zu Behandlungsbeginn (National Cancer Institute [NCI] Kriterien-Gruppe C und D definiert als Gesamtbilirubin > 1,5 x ULN) wird nicht empfohlen, da bei Patienten mit mäßiger Leberfunktionsstörung zu Behandlungsbeginn eine erhöhte Inzidenz von Hyperbilirubinämie Grad 3 und 4 beobachtet wurde, allerdings auf Basis sehr limitierter Daten (siehe Abschnitte 4.4 und 5.2).
Ältere Patienten
Bei Patienten ≥ 65 Jahre ist keine Anpassung der Anfangsdosis erforderlich (siehe Abschnitt 4.8, 5.1 und 5.2). Zur Wirksamkeit und Sicherheit bei Patienten über 75 Jahren liegen nur begrenzt Daten vor.
Kinder und Jugendliche
Es gibt in den Anwendungsgebieten metastasiertes KRK und metastasiertes Magenkarzinom keinen relevanten Nutzen von Lonsurf bei Kindern und Jugendlichen.
Ethnische Unterschiede
Eine Anpassung der Anfangsdosis aufgrund der ethnischen Herkunft des Patienten ist nicht erforderlich (siehe Abschnitte 5.1 und 5.2).
Über die Anwendung von Lonsurf bei Patienten mit schwarzer Hautfarbe/afroamerikanischen Patienten liegen nur begrenzt Daten vor. Jedoch gibt es keine biologische Grundlage, die auf einen Unterschied zwischen dieser Patientengruppe und der Gesamtbevölkerung schließen ließe.
Art der Anwendung
Lonsurf ist zum Einnehmen. Die Tabletten sind mit einem Glas Wasser innerhalb einer Stunde nach den Mahlzeiten am Morgen und am Abend einzunehmen.
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Knochenmarksuppression
Lonsurf verursachte einen Anstieg in der Häufigkeit von Myelosuppression, einschließlich Anämie, Neutropenie, Leukopenie und Thrombozytopenie.
Um die Toxizität zu überwachen, muss ein Gesamtblutbild vor dem Beginn der Therapie und nach Bedarf erstellt werden, zumindest jedoch vor jedem Behandlungszyklus.
Die Behandlung darf nicht begonnen werden, wenn die absolute Anzahl der neutrophilen Granulozyten < 1,5 x 109/l ist, wenn die Thrombozytenzahl < 75 x 109/l ist oder wenn der Patient eine noch bestehende Grad 3 oder 4 nicht-hämatologische, klinisch relevante Toxizität von vorausgegangenen Therapien aufweist.
Nach Behandlung mit Lonsurf wurden schwerwiegende Infektionen berichtet (siehe Abschnitt 4.8). Da die meisten Fälle im Zusammenhang mit einer Knochenmarksuppression berichtet wurden, muss der Allgemeinzustand des Patienten engmaschig überwacht und, wenn klinisch angezeigt, geeignete Maßnahmen wie antimikrobielle Substanzen und ein Granulozyten-Kolonie-stimulierender Faktor (G-CSF) angewendet werden. In der RECOURSE-Studie, der TAGS-Studie und der SUNLIGHT-Studie erhielten 9,4 %, 17,3 % bzw. 19,5 % der Patienten in der Lonsurf-Gruppe G-CSF, meist aus therapeutischen Gründen. In der SUNLIGHT-Studie erhielten 29,3 % der Patienten in der Lonsurf-Bevacizumab Gruppe G-CSF, davon 16,3 % aus therapeutischen Gründen.
Gastrointestinale Toxizität
Lonsurf verursachte einen Anstieg der Häufigkeit gastrointestinaler Toxizität, einschließlich Übelkeit, Erbrechen und Diarrhoe.
Patienten mit Übelkeit, Erbrechen, Diarrhoe und anderen gastrointestinalen Toxizitäten sollten sorgfältig überwacht werden und anti-emetische, anti-diarrhoische und andere Maßnahmen wie eine Flüssigkeits-/Elektrolyt-Ersatztherapie sollten, wenn klinisch angezeigt, angewendet werden. Änderungen der Dosis (Verzögerung und/oder Reduktion) sollten je nach Notwendigkeit durchgeführt werden (siehe Abschnitt 4.2).
Nierenfunktionsstörung
Die Anwendung von Lonsurf bei Patienten mit terminaler Niereninsuffizienz (Kreatinin-Clearance [ClKr] < 15 ml/min oder bei erforderlicher Dialyse) wird nicht empfohlen, da Lonsurf bei diesen Patienten nicht untersucht wurde (siehe Abschnitt 5.2).
Die weltweite Inzidenz von unerwünschten Ereignissen (UE) ist ähnlich bei normaler Nierenfunktion (ClKr ≥ 90 ml/min) und in den Subgruppen mit leichter Nierenfunktionsstörung (ClKr = 60 bis 89 ml/min) oder mäßiger Nierenfunktionsstörung (ClKr = 30 bis 59 ml/min). Allerdings steigt die Inzidenz schwerer und zugleich schwerwiegender UEs sowie von UEs, die zu einer Dosisanpassung führen, mit fortschreitender Nierenfunktionsstörung tendenziell an. Darüber hinaus wurde bei Patienten mit mäßiger Nierenfunktionsstörung eine höhere Exposition von Trifluridin und Tipiracil-Hydrochlorid beobachtet, im Vergleich zu Patienten mit normaler Nierenfunktion oder leichter Nierenfunktionsstörung (siehe Abschnitt 5.2).
Patienten mit schwerer Nierenfunktionsstörung (ClKr 15 bis 29 ml/min) und angepasster Anfangsdosis von 20 mg/m² zweimal täglich zeigten ein Sicherheitsprofil, das konsistent war mit jenem von Lonsurf bei Patienten mit normaler Nierenfunktion oder leichter Nierenfunktionsstörung. Ihre Exposition gegenüber Trifluridin war ähnlich der von Patienten mit normaler Nierenfunktion und ihre Exposition gegenüber Tipiracil-Hydrochlorid war erhöht verglichen mit Patienten mit normaler Nierenfunktion, leichter und mäßiger Nierenfunktionsstörung (siehe Abschnitte 4.2 und 5.2).
Patienten mit Nierenfunktionsstörung sollten unter einer Therapie mit Lonsurf engmaschig überwacht werden, Patienten mit mäßiger oder schwerer Nierenfunktionsstörung sollten häufiger hinsichtlich hämatologischer Toxizität kontrolliert werden.
Leberfunktionsstörung
Die Anwendung von Lonsurf bei Patienten mit mäßiger oder schwerer Leberfunktionsstörung zu Behandlungsbeginn (National Cancer Institute [NCI] Kriterien-Gruppe C und D definiert als Gesamtbilirubin > 1,5 x ULN) wird nicht empfohlen, da bei Patienten mit mäßiger Leberfunktionsstörung zu Behandlungsbeginn eine erhöhte Inzidenz von Hyperbilirubinämie Grad 3 und 4 beobachtet wurde, allerdings auf Basis sehr limitierter Daten (siehe Abschnitt 5.2).
Proteinurie
Es wird empfohlen, vor und während der Behandlung den Urin mittels Teststreifen bezüglich einer Proteinurie zu kontrollieren (siehe Abschnitt 4.8).
Lactose-Intoleranz
Lonsurf enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
In vitro-Studien zeigten, dass Trifluridin, Tipiracil-Hydrochlorid und 5-[Trifluoromethyl]uracil (FTY) die Aktivität von humanen Cytochrom P450 (CYP)-Isoenzymen nicht inhibieren. Eine Auswertung von in vitro-Daten zeigte, dass Trifluridin, Tipiracil-Hydrochlorid und FTY keinen induzierenden Effekt auf CYP-Isoenzyme haben (siehe Abschnitt 5.2).
In vitro-Studien zeigten, dass Trifluridin ein Substrat der Nukleosid-Transporter CNT1, ENT1 und ENT2 ist. Daher ist bei Anwendung von Arzneimitteln, die mit diesen Transportproteinen interagieren, Vorsicht geboten. Tipiracil-Hydrochlorid ist ein Substrat von OCT2 und MATE1. Daher könnte die Konzentration bei gleichzeitiger Gabe von Lonsurf und OCT2- oder MATE1-Inhibitoren erhöht sein.
Bei der Anwendung von Arzneimitteln, die den humanen Thymidin-Kinase-Substraten angehören, z.B. Zidovudin, ist Vorsicht geboten. Bei gleichzeitiger Anwendung mit Lonsurf können diese Arzneimittel mit dem Effektor Trifluridin um die Aktivierung durch die Thymidin-Kinase konkurrieren. Achten Sie daher bei der Anwendung auf eine möglicherweise verminderte Wirksamkeit von antiviralen Arzneimitteln, die zu den humanen Thymidin-Kinase-Substraten gehören, und ziehen Sie alternative antivirale Arzneimittel in Betracht, die keine Thymidin-Kinase-Substrate sind, wie z.B. Lamivudin, Didanosin und Abacavir (siehe Abschnitt 5.1).
Es ist nicht bekannt, ob Lonsurf die Wirksamkeit von hormonellen Kontrazeptiva herabsetzt. Frauen, die hormonelle Kontrazeptiva anwenden, müssen daher ebenfalls eine Barrieremethode zur Empfängnisverhütung anwenden.
Frauen im gebärfähigen Alter / Empfängnisverhütung bei Männern und Frauen
Ergebnisse aus Tierexperimenten ergaben, dass Trifluridin eine Schädigung des Fötus verursachen kann, wenn es bei schwangeren Frauen angewendet wird. Frauen sollen während der Einnahme von Lonsurf und bis zu 6 Monate nach Behandlungsende eine Schwangerschaft vermeiden. Daher müssen Frauen im gebärfähigen Alter sehr zuverlässige Verhütungsmethoden anwenden, während sie Lonsurf einnehmen und bis zu 6 Monate nach Behandlungsende. Derzeit ist nicht bekannt, ob Lonsurf die Wirksamkeit von hormonellen Kontrazeptiva herabsetzt. Frauen, die hormonelle Kontrazeptiva anwenden, sollen daher zusätzlich eine Barrieremethode zur Empfängnisverhütung verwenden.
Männer mit einer Partnerin im gebärfähigen Alter müssen während der Behandlung mit Lonsurf und bis zu 6 Monate nach Behandlungsende zuverlässige Verhütungsmethoden anwenden.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Lonsurf bei Schwangeren vor. Aufgrund des Wirkmechanismus besteht der Verdacht, dass eine Anwendung von Trifluridin während der Schwangerschaft angeborene Fehlbildungen auslösen kann. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Lonsurf darf während der Schwangerschaft nicht angewendet werden, es sei denn, dass eine Behandlung mit Lonsurf aufgrund des klinischen Zustandes der Frau erforderlich ist.
Stillzeit
Es ist nicht bekannt, ob Lonsurf oder seine Metabolite in die Muttermilch übergehen. Tierexperimentelle Studien zeigten, dass Trifluridin, Tipiracil-Hydrochlorid und/oder ihre Metabolite in die Milch übergehen (siehe Abschnitt 5.3). Ein Risiko für den Säugling kann nicht ausgeschlossen werden. Das Stillen soll während der Behandlung mit Lonsurf unterbochen werden.
Fertilität
Es sind keine Daten über die Auswirkung von Lonsurf auf die menschliche Fertilität verfügbar. Ergebnisse aus tierexperimentellen Studien ergaben keinen Hinweis auf einen Einfluss von Lonsurf auf die männliche oder weibliche Fertilität (siehe Abschnitt 5.3). Vor Beginn der Behandlung mit Lonsurf sollten Patienten, die einen Kinderwunsch haben, bzgl. einer Kryokonservierung von Gameten (Eizellen oder Spermien) beraten werden bzw. auf eine entsprechende Beratung zum Thema Fortpflanzung hingewiesen werden.
Lonsurf hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Ermüdung, Schwindel oder Unwohlsein können während der Behandlung auftreten (siehe Abschnitt 4.8).
Zusammenfassung des Sicherheitsprofils
Die schwerwiegendsten Nebenwirkungen bei mit Lonsurf behandelten Patienten sind Knochenmarksuppression und gastrointestinale Toxizität (siehe Abschnitt 4.4).
Lonsurf als Monotherapie
Das Sicherheitsprofil von Lonsurf als Monotherapie basiert auf gepoolten Daten aus kontrollierten klinischen Phase-III-Studien von 1114 Patienten mit metastasiertem kolorektalem Karzinom oder Magenkarzinom.
Die häufigsten Nebenwirkungen (≥ 30 %) sind Neutropenie (53 % [34 % ≥ Grad 3]), Übelkeit (31 % [1 % ≥ Grad 3]), Ermüdung (31 % [4 % ≥ Grad 3]) und Anämie (30 % [11 % ≥ Grad 3]).
Die häufigsten Nebenwirkungen (≥ 2 %), welche einen Behandlungsabbruch, eine Dosisreduktion, Dosisverzögerung oder ein Aussetzen der Dosis zur Folge hatten, waren Neutropenie, Anämie, Ermüdung, Leukopenie, Thrombozytopenie, Diarrhoe und Übelkeit.
Lonsurf in Kombination mit Bevacizumab
Das Sicherheitsprofil von Lonsurf in Kombination mit Bevacizumab basiert auf Daten von 246 Patienten mit metastasiertem kolorektalem Karzinom aus der kontrollierten klinischen Phase-III-Studie (SUNLIGHT).
Die häufigsten Nebenwirkungen (≥ 30 %) sind Neutropenie (69 % [48 % ≥ Grad 3]), Ermüdung (35 % [3 % ≥ Grad 3]) und Übelkeit (33 % [1 % ≥ Grad 3]).
Die häufigsten Nebenwirkungen (≥ 2 %), welche einen Behandlungsabbruch, eine Dosisreduktion, Dosisverzögerung oder ein Aussetzen der Dosis von Lonsurf zur Folge hatten, wenn in Kombination mit Bevacizumab verwendet, waren Neutropenie, Ermüdung, Thrombozytopenie, Übelkeit und Anämie.
Bei Verwendung von Lonsurf in Kombination mit Bevacizumab war die Häufigkeit der folgenden Nebenwirkungen erhöht im Vergleich zu einer Lonsurf-Monotherapie: Neutropenie (69 % versus 53 %), schwere Neutropenie (48 % versus 34 %), Thrombozytopenie (24 % versus 16 %), Stomatitis (11 % versus 6 %).
Tabellarische Auflistung der Nebenwirkungen
Die beobachteten Nebenwirkungen der 533 behandelten Patienten mit metastasiertem KRK aus der placebokontrollierten Phase-III-Studie (RECOURSE), der 335 behandelten Patienten mit metastasiertem Magenkarzinom aus der placebokontrollierten Phase-III-Studie (TAGS), der 246 behandelten Patienten mit metastasiertem KRK unter einer Lonsurf-Monotherapie und der 246 behandelten Patienten mit metastasiertem KRK unter Lonsurf-Bevacizumab-Kombinationstherapie aus der kontrollierten Phase-III-Studie (SUNLIGHT), sind in Tabelle 6 gelistet.
Sie sind entsprechend der Systemorganklassen klassifiziert und der geeignete MedDRA-Begriff wird verwendet, um eine bestimmte Reaktion, ihre Synonyme und die damit verbundenen Symptome zu beschreiben.
Nebenwirkungen, die bekanntermaßen unter einer Lonsurf-Monotherapie oder unter Bevacizumab-Therapie auftreten, können auch bei der Kombinations-Behandlung dieser beiden Arzneimittel vorkommen, auch wenn diese nicht in den klinischen Studien mit Kombinationstherapie beobachtet wurden.
Nebenwirkungen werden entsprechend ihrer Häufigkeit zusammengefasst. Zur Klassifizierung der Häufigkeitsgruppen werden die folgenden Kategorien verwendet: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100) und selten (≥ 1/10 000, < 1/1 000).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet.
Tabelle 6: Nebenwirkungen, die in den klinischen Phase-III-Studien bei mit Lonsurf behandelten Patienten berichtet wurden
Systemorganklasse | Nebenwirkungen | Häufigkeit | ||
Monotherapie | Kombination mit Bevacizumab | |||
Infektionen und parasitäre Erkrankungen | Infektion der unteren Atemwege | Häufig | - | |
Neutropenische Sepsis | Gelegentlich | - | ||
Gallengangsentzündung | Gelegentlich | - | ||
Infektion | Gelegentlich | Häufig | ||
Harnwegsinfektion | Gelegentlich | Gelegentlich | ||
Bakterielle Infektion | Gelegentlich | - | ||
Candida-Infektion | Gelegentlich | - | ||
Konjunktivitis | Gelegentlich | - | ||
Herpes Zoster | Gelegentlich | - | ||
Grippe | Gelegentlich | - | ||
Infektion der oberen Atemwege | Gelegentlich | - | ||
Infektiöse Enteritis | Selten | - | ||
Septischer Schockb | Selten | - | ||
Gingivitis | Selten | Gelegentlich | ||
Tinea pedis | Selten | - | ||
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen) | Krebsschmerzen | Gelegentlich | - | |
Erkrankungen des Blutes und des Lymphsystems | Anämie | Sehr häufig | Sehr häufig | |
Neutropenie | Sehr häufig | Sehr häufig | ||
Leukopenie | Sehr häufig | Häufig | ||
Thrombozytopenie | Sehr häufig | Sehr häufig | ||
Febrile Neutropenie | Häufig | Gelegentlich | ||
Lymphopenie | Häufig | Häufig | ||
Panzytopenie | Gelegentlich | Gelegentlich | ||
Erythropenie | Gelegentlich | - | ||
Leukozytose | Gelegentlich | - | ||
Monozytopenie | Gelegentlich | - | ||
Monozytose | Gelegentlich | - | ||
Granulozytopenie | Selten | - | ||
Stoffwechsel- und Ernährungsstörungen | Appetit vermindert | Sehr häufig | Sehr häufig | |
Hypoalbuminämie | Häufig | Gelegentlich | ||
Dehydratation | Gelegentlich | - | ||
Hyperglykämie | Gelegentlich | Gelegentlich | ||
Hyperkaliämie | Gelegentlich | - | ||
Hypokalzämie | Gelegentlich | - | ||
Hypokaliämie | Gelegentlich | - | ||
Hyponatriämie | Gelegentlich | - | ||
Hypophosphatämie | Gelegentlich | - | ||
Gicht | Selten | - | ||
Hypernatriämie | Selten | - | ||
Psychiatrische Erkrankungen | Angst | Gelegentlich | - | |
Schlaflosigkeit | Gelegentlich | - | ||
Erkrankungen des Nervensystems | Geschmacksstörung | Häufig | Häufig | |
Schwindelgefühl | Gelegentlich | Häufig | ||
Kopfschmerzen | Gelegentlich | Häufig | ||
Periphere Neuropathie | Gelegentlich | Gelegentlich | ||
Parästhesie | Gelegentlich | Gelegentlich | ||
Lethargie | Gelegentlich | - | ||
Neurotoxizität | Gelegentlich | - | ||
Brennen | Selten | - | ||
Dysästhesie | Selten | - | ||
Hyperästhesie | Selten | - | ||
Hypästhesie | Selten | - | ||
Synkope | Selten | - | ||
Augenerkrankungen | Katarakt | Selten | - | |
Diplopie | Selten | - | ||
Trockenes Auge | Selten | - | ||
Verschwommenes Sehen | Selten | - | ||
Sehschärfe vermindert | Selten | - | ||
Erkrankungen des Ohrs und des Labyrinths | Vertigo | Gelegentlich | - | |
Ohrenbeschwerden | Selten | - | ||
Herzerkrankungen | Angina pectoris | Gelegentlich | - | |
Arrhythmie | Gelegentlich | - | ||
Palpitationen | Gelegentlich | - | ||
Gefäßerkrankungen | Hypertonie | Gelegentlich | Häufig | |
Flush | Gelegentlich | - | ||
Hypotonie | Gelegentlich | - | ||
Embolie | Selten | - | ||
Erkrankungen der Atemwege, des Brustraums und Mediastinums | Dyspnoe | Häufig | Häufig | |
Lungenembolieb | Gelegentlich | - | ||
Dysphonie | Gelegentlich | Gelegentlich | ||
Husten | Gelegentlich | - | ||
Epistaxis | Gelegentlich | - | ||
Rhinorrhoe | Selten | Gelegentlich | ||
Schmerzen im Oropharynx | Selten | - | ||
Pleuraerguss | Selten | - | ||
Erkrankungen des Gastrointestinaltrakts | Diarrhoe | Sehr häufig | Sehr häufig | |
Erbrechen | Sehr häufig | Sehr häufig | ||
Übelkeit | Sehr häufig | Sehr häufig | ||
Abdominalschmerz | Häufig | Häufig | ||
Stomatitis | Häufi | Sehr häufig | ||
Obstipation | Häufig | Häufig | ||
Ileus | Gelegentlich | - | ||
Gastrointestinalblutung | Gelegentlich | - | ||
Kolitis | Gelegentlich | Gelegentlich | ||
Mundulzeration | Gelegentlich | Häufig | ||
Erkrankung des Mundraumes | Gelegentlich | Häufig | ||
Bauch aufgetrieben | Gelegentlich | Gelegentlich | ||
Analentzündung | Gelegentlich | Gelegentlich | ||
Dyspepsie | Gelegentlich | Gelegentlich | ||
Flatulenz | Gelegentlich | Gelegentlich | ||
Gastritis | Gelegentlich | - | ||
Gastroösophageale Refluxkrankheit | Gelegentlich | - | ||
Glossitis | Gelegentlich | - | ||
Magenentleerung gestört | Gelegentlich | - | ||
Brechreiz | Gelegentlich | - | ||
Zahnerkrankung | Gelegentlich | - | ||
Aszites | Selten | - | ||
Akute Pankreatitis | Selten | - | ||
Subileus | Selten | - | ||
Mundgeruch | Selten | - | ||
Polyp an der Wangenschleimhaut | Selten | - | ||
Hämorrhagische Enterokolitis | Selten | - | ||
Zahnfleischbluten | Selten | - | ||
Oesophagitis | Selten | - | ||
Parodontose | Selten | - | ||
Proktalgie | Selten | - | ||
Refluxgastritis | Selten | - | ||
Leber- und Gallenerkrankungen | Hyperbilirubinämie | Häufig | Häufig | |
Hepatotoxizität | Gelegentlich | - | ||
Gallenblasendilatation | Selten | - | ||
Erkrankungen der Haut und des Unterhautgewebes | Alopezie | Häufig | Häufig | |
Trockene Haut | Häufig | Häufig | ||
Pruritus | Häufig | Gelegentlich | ||
Hautausschlag | Häufig | Gelegentlich | ||
Nagelerkrankung | Gelegentlich | Gelegentlich | ||
Palmar-plantares Erythrodysästhesie-syndromc | Gelegentlich | Gelegentlich | ||
Akne | Gelegentlich | - | ||
Hyperhidrosis | Gelegentlich | - | ||
Urtikaria | Gelegentlich | - | ||
Blasenbildung | Selten | - | ||
Erythem | Selten | - | ||
Lichtempfindlichkeitsreaktion | Selten | - | ||
Exfoliation der Haut | Selten | - | ||
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Arthralgie | Gelegentlich | Häufig | |
Myalgie | Gelegentlich | Häufig | ||
Muskelschwäche | Gelegentlich | Gelegentlich | ||
Schmerz in den Extremitäten | Gelegentlich | Gelegentlich | ||
Knochenschmerzen | Gelegentlich | - | ||
Gliederbeschwerden | Gelegentlich | - | ||
Muskelspasmen | Gelegentlich | - | ||
Gelenkschwellung | Selten | - | ||
Erkrankungen der Nieren und Harnwege | Proteinurie | Häufig | Gelegentlich | |
Nierenversagen | Gelegentlich | - | ||
Hämaturie | Gelegentlich | - | ||
Störungen bei der Entleerung der Harnblase | Gelegentlich | - | ||
Nichtinfektiöse Zystitis | Selten | - | ||
Leukozyturie | Selten | - | ||
Erkrankungen der Geschlechtsorgane und der Brustdrüse | Menstruationsstörung | Selten | Gelegentlich | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Ermüdung | Sehr häufig | Sehr häufig | |
Fieber | Häufig | Gelegentlich | ||
Schleimhautentzündung | Häufig | Gelegentlich | ||
Unwohlsein | Häufig | - | ||
Ödem | Häufig | - | ||
Generelle Verschlechterung des physischen Gesundheitszustandes | Gelegentlich | - | ||
Schmerzen | Gelegentlich | Gelegentlich | ||
Gefühl der Körpertemperaturänderung | Gelegentlich | - | ||
Xerose | Selten | - | ||
Untersuchungen | Gewichtsabnahme | Häufig | Häufig | |
Leberenzyme erhöht | Häufig | Häufig | ||
Alkalische Phosphatase im Blut erhöht | Häufig | Gelegentlich | ||
Lactatdehydrogenase im Blut erhöht | Gelegentlich | - | ||
C-reaktives Protein erhöht | Gelegentlich | - | ||
Kreatinin im Blut erhöht | Gelegentlich | - | ||
Blutharnstoff erhöht | Gelegentlich | - | ||
Hämatokrit erniedrigt | Gelegentlich | - | ||
International Normalized Ratio (INR) erhöht | Gelegentlich | - | ||
Aktivierte partielle Thromboplastinzeit verlängert | Selten | - | ||
Verlängerung des QT im EKG | Selten | - | ||
Gesamtprotein erniedrigt | Selten | - | ||
a | Unterschiedliche MedDRA-bevorzugte Bezeichnungen, die als klinisch ähnlich erachtet wurden, wurden zu einer Bezeichnung zusammengefasst. | |||
b | Fälle mit tödlichem Ausgang wurden berichtet | |||
c | Hand-Fuß-Hautreaktion | |||
Ältere Patienten
Bei Patienten im Alter von 65 Jahren oder älter, die Lonsurf als Monotherapie erhielten, wurde im Vergleich zu Patienten jünger als 65 Jahre ein häufigeres Auftreten (> 5 %) der folgenden, mit der Therapie in Zusammenhang stehenden, unerwünschten Ereignisse beobachtet:
Neutropenie (58,9 % versus 48,2 %), schwere Neutropenie (41,3 % versus 27,9 %), Anämie (36,5 % versus 25,2 %), schwere Anämie (14,1 % versus 8,9 %), verminderter Appetit (22,6 % versus 17,4 %) und Thrombozytopenie (21,4 % versus 12,1 %).
Bei Kombinationstherapie von Lonsurf und Bevacizumab wurde bei Patienten im Alter von 65 Jahren oder älter im Vergleich zu Patienten jünger als 65 Jahre ein häufigeres Auftreten (> 5 %) der folgenden, mit der Therapie in Zusammenhang stehenden, unerwünschten Ereignisse beobachtet:
Neutropenie (75,0 % versus 65,1 %), schwere Neutropenie (57,0 % versus 48,1 %), Ermüdung (39,0 % versus 32,2 %), Thrombozytopenie (28,0 % versus 20,5 %) und Stomatitis (14,0 % versus 8,9 %).
Infektionen
In Zusammenhang mit der Behandlung auftretende Infektionen wurden in den Placebo-kontrollierten klinischen Phase-III-Studien bei mit Lonsurf behandelten Patienten häufiger beobachtet (5,8 %) als bei Patienten mit Placebo (1,8 %).
In der klinischen Studie der Kombination mit Bevacizumab traten behandlungsbedingte Infektionen bei Patienten, die Lonsurf und Bevacizumab erhielten (2,8 %) ähnlich häufig auf wie bei Patienten, die nur Lonsurf erhielten (2,4 %).
Proteinurie
In den Placebo-kontrollierten klinischen Phase-III-Studien wurde eine im Zusammenhang mit der Therapie auftretende Proteinurie bei mit Lonsurf behandelten Patienten häufiger beobachtet (1,8 %) als in der Placebogruppe (0,9 %). In allen Fällen hatte die Proteinurie einen Schweregrad von 1 oder 2 (siehe Abschnitt 4.4).
In der klinischen Studie der Kombination mit Bevacizumab trat bei einem Patienten, der Lonsurf in Kombination mit Bevacizumab (0,4 %) erhielt, eine mit der Behandlung in Zusammenhang stehende Proteinurie (Grad 2) auf. In der Gruppe der Patienten unter Lonsurf-Monotherapie trat keine Proteinurie auf (siehe Abschnitt 4.4).
Radiotherapie
In RECOURSE traten hämatologische und myelosupressive Nebenwirkungen bei Patienten mit vorangegangener Radiotherapie geringfügig häufiger auf als bei Patienten ohne vorangegangener Radiotherapie (54,6 % vs. 49,2 %); ebenso war das Auftreten einer febrilen Neutropenie bei mit Lonsurf behandelten Patienten mit vorangegangener Radiotherapie häufiger.
In der klinischen Studie der Kombination mit Bevacizumab wurde in beiden SUNLIGHT-Studienarmen kein Anstieg der hämatologischen und myelosuppressiven Gesamt-Nebenwirkungen bei Patienten beobachtet, die zuvor eine Radiotherapie erhalten hatten, im Vergleich zu jenen Patienten, die zuvor keine Radiotherapie erhalten hatten: Lonsurf mit Bevacizumab (73,7 % versus 77,4 %) und Lonsurf-Monotherapie (64,7 % versus 67,7 %).
Erfahrungen nach der Marktzulassung bei Patienten mit inoperablem fortgeschrittenem oder rezidivierendem KRK
Es gibt Berichte von interstitieller Lungenerkrankung bei Patienten, die Lonsurf nach Marktzulassung erhielten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Die höchste in klinischen Studien angewendete Dosis von Lonsurf war 180 mg/m2 pro Tag.
Berichtete Nebenwirkungen in Zusammenhang mit Überdosierung von Lonsurf waren in Übereinstimmung mit dem bekannten Sicherheitsprofil.
Knochenmarksuppression ist die primär zu erwartende Komplikation bei einer Überdosierung.
Es gibt kein Antidot für den Fall einer Lonsurf Überdosierung.
Die medizinische Behandlung einer Überdosierung sollte die üblichen therapeutischen und unterstützenden Maßnahmen beinhalten, die darauf zielen, die vorhandenen klinischen Manifestationen zu korrigieren und deren mögliche Komplikationen zu verhindern.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Antimetaboliten; ATC-Code: L01BC59
Wirkmechanismus
Lonsurf enthält das antineoplastische Thymidin-basierte Nukleosid-Analogon Trifluridin und den Thymidin-Phosphorylase (TPase)-Inhibitor Tipiracil-Hydrochlorid, die in einem molaren Verhältnis von 1:0,5 kombiniert sind (Masseverhältnis 1:0,471).
Nach Aufnahme in Tumorzellen wird Trifluridin durch die Thymidin-Kinase phosphoryliert und nach weiterer Metabolisierung als ein Desoxyribonucleinsäure (DNA)-Substrat direkt in die DNA eingebaut. Hierdurch greift der Wirkstoff in DNA-Funktionen ein und verhindert die Zellproliferation.
Trifluridin wird jedoch rasch durch TPase abgebaut und unterliegt nach oraler Einnahme einem hohen First-Pass-Effekt. Daher wird Trifluridin mit dem TPase-Inhibitor Tipiracil-Hydrochlorid kombiniert.
In präklinischen Studien wurde für Trifluridin/Tipiracil-Hydrochlorid sowohl gegen 5-Fluorouracil (5-FU)-sensitive als auch gegen resistente kolorektale Tumorzelllinien eine Tumoraktivität gezeigt.
Die zytotoxische Aktivität von Trifluridin/Tipiracil-Hydrochlorid korrelierte in unterschiedlichen humanen Tumor-Xenotransplantaten stark mit der in die DNA eingebauten Menge von Trifluridin, was den DNA-Einbau als primären Wirkmechanismus nahelegt.
Pharmakodynamische Wirkungen
In einer unverblindeten Studie bei Patienten mit fortgeschrittenen soliden Tumoren hatte Lonsurf keinen klinisch relevanten Effekt auf eine QT/QTc-Verlängerung im Vergleich zu Placebo.
Klinische Wirksamkeit und Sicherheit
Metastasiertes kolorektales Karzinom
Randomisierte Phase-III-Studie von Lonsurf als Monotherapie versus Placebo
Die klinische Wirksamkeit und Sicherheit von Lonsurf wurde in einer internationalen, randomisierten, doppelblinden, placebokontrollierten Phase III-Studie (RECOURSE) bei Patienten mit vorbehandeltem metastasiertem KRK untersucht. Der primäre Endpunkt für die Wirksamkeit war Gesamtüberleben (overall survival, OS), weitere Endpunkte waren progessionsfreies Überleben (progression-free survival, PFS), die Tumoransprechrate (overall response rate, ORR) und die Krankheitskontrollrate (disease control rate, DCR).
Insgesamt wurden 800 Patienten in einem Verhältnis von 2:1 randomisiert und erhielten entweder Lonsurf (n = 534) plus bestmögliche unterstützende Therapie (BSC) oder ein entsprechendes Placebo (n = 266) plus BSC. Lonsurf wurde basierend auf der KOF dosiert, wobei die Anfangsdosis 35 mg/m2/Dosis betrug. Die Studienmedikation wurde über 2 Wochen hinweg 2x täglich, jeweils morgens und abends nach den Mahlzeiten, an 5 Tagen pro Woche oral gegeben, mit 2 Tagen Pause. Daraufhin folgten 2 Wochen Therapiepause. Dieser Zyklus wurde alle 4 Wochen wiederholt. Die Behandlung wurde bis zur Krankheitsprogression oder dem Auftreten einer inakzeptablen Toxizität (siehe Abschnitt 4.2) fortgesetzt.
Das mittlere Alter der 800 randomisierten Patienten betrug 63 Jahre, 61 % waren männlich, 58 % Kaukasier/weißer Hautfarbe, 35 % asiatisch/orientalisch und 1 % der Patienten waren afrikanisch-amerikanisch/schwarzer Hautfarbe. Alle Patienten hatten zu Beginn einen ECOG (Eastern Cooperative Oncology Group) Performance Status (PS) von 0 oder 1. Die Erkrankung trat primär im Kolon (62 %) oder im Rektum (38 %) auf. Zu Studienbeginn lag bei 51 % aller Patienten eine KRAS-Mutation vor, während bei 49 % der Patienten KRAS in der Wildtyp-Form vorlag. Die Patienten hatten im Mittel 3 vorangegangene Therapielinien für metastasiertes KRK erhalten. Alle Patienten waren mit Fluoropyrimidin-, Oxaliplatin- und Irinotecan-basierten Chemotherapien vorbehandelt. Alle, außer einem Patienten, hatten Bevacizumab und alle, bis auf 2 Patienten mit KRAS-Wildtyp-Tumoren, hatten Panitumumab oder Cetuximab erhalten. Beide Studienarme waren im Hinblick auf die demographischen und krankheitsspezifischen Charakteristika zu Studienbeginn vergleichbar.
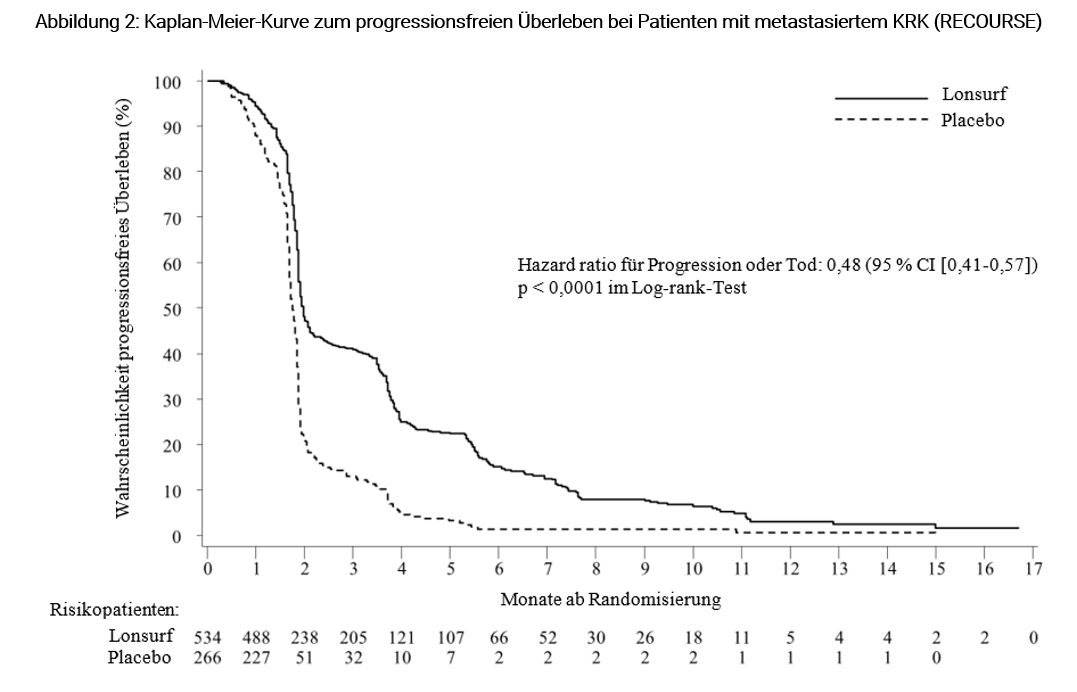
Eine Analyse des OS, wie geplant nach 72 % Ereignissen (n = 574) durchgeführt, zeigte einen klinisch relevanten und statistisch signifikanten Überlebensvorteil von Lonsurf plus BSC im Vergleich zu Placebo plus BSC (HR: 0,68, 95 % CI [0,58-0,81]; p < 0,0001) und ein mittleres OS von 7,1 Monaten vs. 5,3 Monaten. Die 1-Jahres-Überlebensraten betrugen 26,6 % mit Lonsurf vs. 17,6 % mit Placebo. Das PFS war bei Patienten, die Lonsurf plus BSC erhielten, signifikant besser (HR: 0,48, 95 % CI [0,41-0,57]; p < 0,0001) (siehe Tabelle 7, Abbildungen 1 und 2).
Tabelle 7: Ergebnisse zur Wirksamkeit aus der Phase III (RECOURSE)-Studie bei Patienten mit metastasiertem KRK
Lonsurf plus BSC | Placebo plus BSC | ||
Gesamtüberleben (OS) | |||
Anzahl Todesfälle | 364 (68,2 %) | 210 (78,9 %) | |
Median OSa [95 % CI]b | 7,1 Monate [6,5-7,8] | 5,3 Monate [4,6- 6,0] | |
Hazard ratio [95 % CI] | 0,68 [0,58-0,81] | ||
p-Wertc | < 0,0001 (einseitig und zweiseitig) | ||
Progressionsfreies Überleben (PFS) | |||
Anzahl Ereignisse | 472 (88,4 %) | 251 (94,4 %) | |
Median PFS a [95 % CI]b | 2,0 Monate [1,9-2,1] | 1,7 Monate [1,7-1,8] | |
Hazard ratio [95 % CI] | 0,48 [0,41-0,57] | ||
p-Wertc | < 0,0001 (einseitig und zweiseitig) | ||
a | Kaplan-Meier-Schätzungen | ||
b | nach der Methode von Brookmeyer/Crowley | ||
c | Stratifizierter Log-rank-Test (Strata: KRAS-Status, Zeit seit Diagnose der metastasierten Erkrankung, Region) | ||
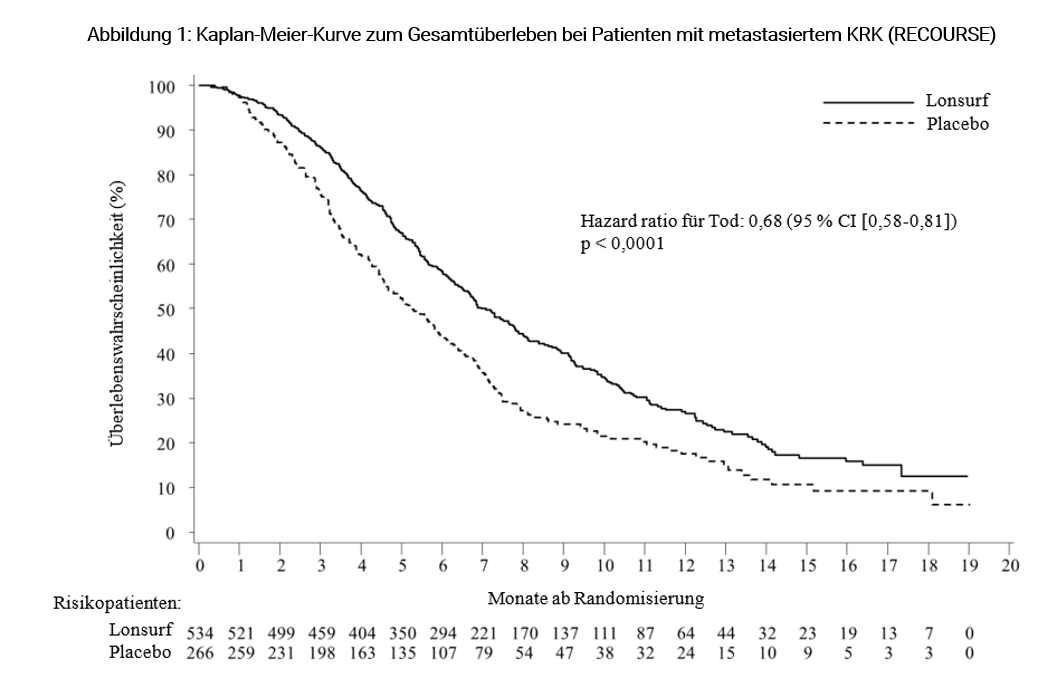
Eine aktualisierte Analyse des OS, durchgeführt nach 89 % Ereignissen (n = 712), bestätigte den klinisch relevanten und statistisch signifikanten Überlebensvorteil von Lonsurf plus BSC im Vergleich zu Placebo plus BSC (HR: 0,69, 95 % CI [0,59-0,81]; p < 0,0001) und ein mittleres OS von 7,2 Monaten vs. 5,2 Monaten. Die 1-Jahres-Überlebensraten betrugen 27,1 % mit Lonsurf vs. 16,6 % mit Placebo.
Der Behandlungsvorteil in Bezug auf OS und PFS wurde durchgehend über alle relevanten, prä-spezifizierten Subgruppen hinweg beobachtet, einschließlich Ethnie, geographischer Region, Alter (< 65 Jahre; ≥ 65 Jahre), Geschlecht, ECOG-PS, KRAS-Status, Zeit seit Diagnose der metastasierten Erkrankung, Anzahl Metastasen und Primärlokalisation des Tumors. Der Überlebensvorteil zugunsten von Lonsurf war nach Anpassung an alle signifikanten prognostischen Faktoren, nämlich Zeit seit Diagnose der metastasierten Erkrankung, ECOG-PS und Anzahl Metastasen, unverändert (HR: 0,69, 95 % CI [0,58-0,81]).
Einundsechzig Prozent (61 %, n = 485) aller randomisierten Patienten erhielten ein Fluoropyrimidin als Bestandteil ihres letzten Therapieschemas vor Randomisierung. 94 % dieser Patienten (n = 455) waren zu diesem Zeitpunkt therapierefraktär in Bezug auf das Fluoropyrimidin. Der Effekt auf das Gesamtüberleben zugunsten von Lonsurf wurde auch bei diesen Patienten beibehalten (HR: 0,75, 95 % CI [0,59-0,94]).
Achtzehn Prozent (18 %, n = 144) aller randomisierten Patienten erhielten vor Randomisierung Regorafenib. Bei diesen Patienten war der Vorteil in Bezug auf OS erhalten (HR: 0,69, 95 % CI [0,45-1,05]). Der Effekt wurde ebenso in Patienten, die kein Regorafenib erhalten hatten, festgestellt (HR: 0,69, 95 % CI [0,57-0,83]).
Die Krankheitskontrollrate (komplettes bzw. partielles Ansprechen oder stabile Erkrankung) war bei mit Lonsurf behandelten Patienten signifikant höher (44 % vs. 16 %, p < 0,0001).
Eine Behandlung mit Lonsurf plus BSC führte zu einer statistisch signifikanten Verlängerung eines ECOG-PS < 2 im Vergleich zu Placebo plus BSC. Die mittlere Zeit bis zum Erreichen eines ECOG-PS ≥ 2 betrug in der Lonsurf-Gruppe 5,7 Monate und in der Placebo-Gruppe 4,0 Monate (HR: 0,66, 95 % CI [0,56-0,78]; p < 0,0001).
Randomisierte Phase-III-Studie von Lonsurf in Kombination mit Bevacizumab versus Lonsurf Monotherapie
Die klinische Wirksamkeit und Sicherheit von Lonsurf in Kombination mit Bevacizumab versus Lonsurf-Monotherapie wurde in einer internationalen, randomisierten, open-label Phase-III-Studie (SUNLIGHT) bei Patienten mit metastasiertem KRK untersucht, die zuvor mit maximal zwei systemischen Behandlungsregimen gegen die fortgeschrittene Erkrankung behandelt wurden, einschließlich Fluoropyrimidin, Irinotecan, Oxaliplatin, einem monoklonalen Anti-VEGF-Antikörper und/oder einem monokolonalen Anti-EGFR-Antikörper bei Patienten mit einem RAS-Wildtyp-Tumor. Der primäre Endpunkt für die Wirksamkeit war das Gesamtüberleben (overall survival, OS), der wichtigste sekundäre Wirksamkeitsendpunkt war das progessionsfreie Überleben (progression-free survival, PFS).
Insgesamt wurden 492 Patienten randomisiert (1:1) und erhielten entweder Lonsurf in Kombination mit Bevacizumab (N = 246) oder Lonsurf in Monotherapie (N = 246).
Die Patienten erhielten Lonsurf (Startdosis 35 mg/m²) oral zweimal täglich an Tag 1 bis 5 und an Tag 8 bis 12 jedes 28-Tage-Zyklus alleine oder in Kombination mit Bevacizumab (5mg/kg), das alle zwei Wochen (an Tag 1 und 15) jedes 4-Wochen-Zyklus intravenös verabreicht wurde. Die Behandlung wurde bis zur Krankheitsprogression oder dem Auftreten einer inakzeptablen Toxizität (siehe Abschnitt 4.2) fortgesetzt. Bevacizumab als Monotherapie war nicht erlaubt.
Die Ausgangs-Parameter waren allgemein zwischen beiden Gruppen ausgeglichen. Das mediane Alter betrug 63 Jahre (Spanne zwischen 20 – 90 Jahren), wobei 44 % der Patienten ≥ 65 Jahre und 12 % ≥ 75 Jahre alt waren. 52 % der Patienten waren männlich und 95 % waren weißer Hautfarbe, 46 % hatten einen ECOG-Status von 0 und 54 % von 1. Die primäre Lokalisation des Tumors war im Kolon (73 %) oder Rektum (27 %). Insgesamt hatten 71 % der Patienten einen RAS-mutierten Tumor. Die mediane Behandlungsdauer war 5 Monate in der Lonsurf-Bevacizumab-Gruppe und 2 Monate in der Lonsurf-Monotherapie-Gruppe. Insgesamt 92 % der Patienten hatten zuvor zwei Krebstherapien gegen fortgeschrittenes KRK erhalten, 5 % hatten eine erhalten und 3 % mehr als zwei. Alle Patienten hatten zuvor Fluoropyrimidin, Irinotecan und Oxaliplatin erhalten, 72 % hatten zuvor einen monoklonalen Anti-VEGFR-Antikörper erhalten und 94 % der Patienten mit einem RAS-Wildtyp-Tumor hatten zuvor einen monoklonalen Anti-EGFR-Antikörper erhalten.
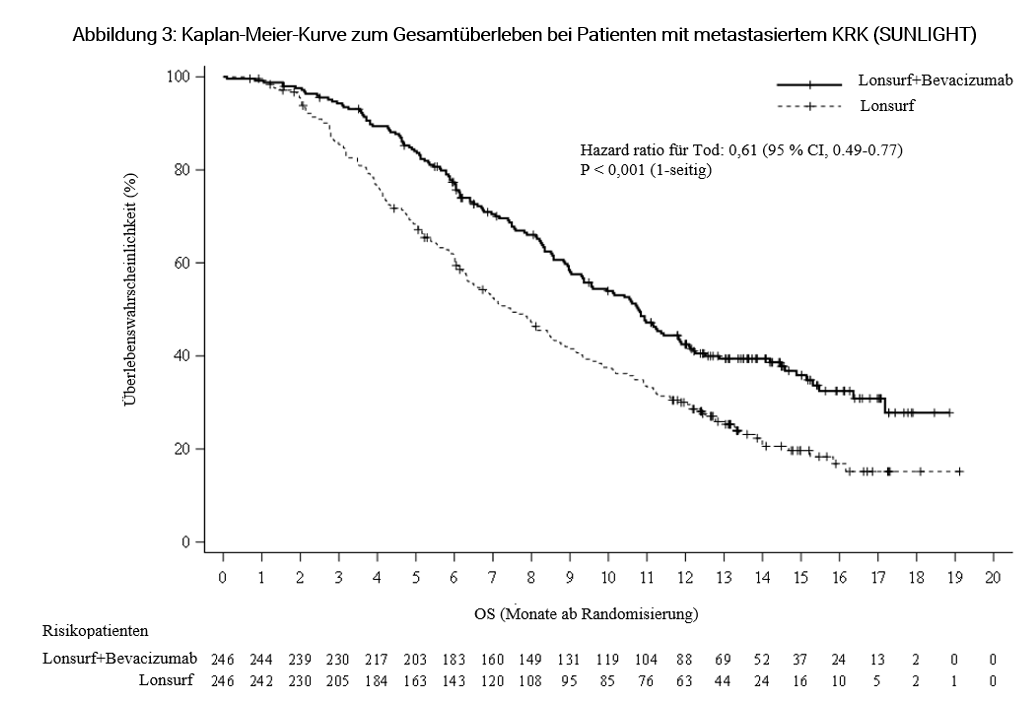
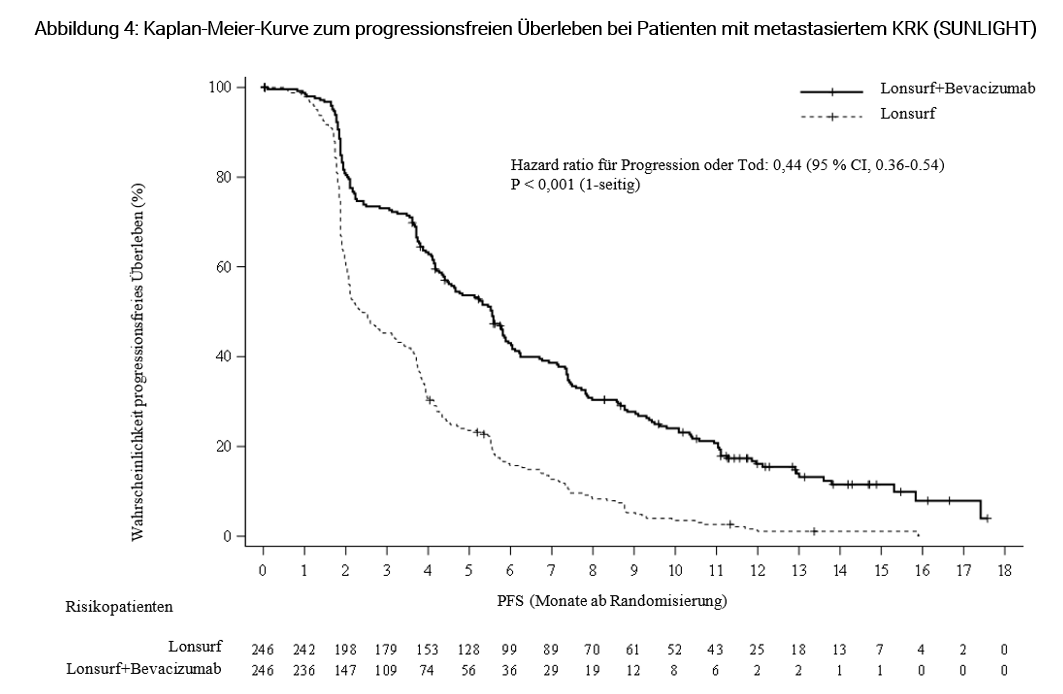
Die Kombination von Lonsurf mit Bevacizumab resultierte in einer statistisch signifikanten Verbesserung des OS und PFS im Vergleich zur Lonsurf-Monotherapie (siehe Tabelle 8 und Abbildungen 3 und 4).
Tabelle 8: Ergebnisse zur Wirksamkeit aus der Phase-III (SUNLIGHT)-Studie bei Patienten mit metastasiertem KRK
Lonsurf plus Bevacizumab | Lonsurf Monotherapie | ||
Gesamtüberleben (OS) | |||
Anzahl Todesfälle N (%) | 148 (60,2 %) | 183 (74,4 %) | |
Median OSa [95 % CI]b | 10,8 Monate [9,4, 11,8] | 7,5 Monate [6,3, 8,6] | |
Hazard ratio [95 % CI] | 0,61 [0,49, 0,77] | ||
p-Wertc | < 0,001 (einseitig) | ||
Progressionsfreies Überleben (PFS) (vom Prüfer berichtet) | |||
Anzahl Ereignisse | 206 (83,7 %) | 236 (95,9 %) | |
Median PFS a [95 % CI]b | 5,6 Monate [4,5, 5,9] | 2,4 Monate [2,1, 3,2] | |
Hazard ratio [95 % CI] | 0,44 [0,36, 0,54] | ||
p-Wertc | < 0,001 (einseitig) | ||
a | Kaplan-Meier-Schätzungen | ||
b | nach der Methode von Brookmeyer/Crowley | ||
c | Stratifizierter Log-rank-Test (Strata: Region, Zeit seit Diagnose der metastasierten Erkrankung, RAS-Status) | ||
Die Verbesserung bei OS und PFS wurde konstant beobachtet, in allen randomisierten Strata und vor-definierten Subgruppen, einschließlich Geschlecht, Alter (< 65, ≥ 65 Jahre), Lokalisation des Primärtumors (rechts, links), ECOG Performance-Status (0, ≥ 1), zuvor durchgeführter Resektion, Anzahl der Metastasen (1-2, ≥ 3), Neutrophilen-Lymphozyten-Verhältnis (NLR < 3, NLR ≥ 3), Anzahl der zuvor erhaltenen Behandlungsregime für die metastatische Erkrankung (1, ≥ 2), BRAF-Status, MSI-Status, vorheriger Behandlung mit Bevacizumab und nachfolgender Behandlung mit Regorafenib.
Metastasiertes Magenkarzinom
Die klinische Wirksamkeit und Sicherheit von Lonsurf wurde in einer internationalen, randomisierten, doppelblinden, placebokontrollierten Phase III-Studie (TAGS) bei Patienten mit vorbehandeltem metastasiertem Magenkarzinom (einschließlich Adenokarzinom des gastroösophagealen Übergangs) untersucht. Die Patienten waren bereits mit mindestens zwei systemischen Therapieregimen für die fortgeschrittene Erkrankung behandelt worden; diese Therapien beinhalteten Chemotherapien mit Fluoropyrimidin, Platin und entweder Taxan oder Irinotecan sowie zusätzlich, falls geeignet, eine gegen HER2 (Humanen Epidermalen Wachstumsfaktor-Rezeptor 2) gerichtete Therapie. Der primäre Endpunkt bezüglich Wirksamkeit war das Gesamtüberleben (overall survival, OS), unterstützende Endpunkte waren progressionsfreies Überleben (progression free survival, PFS), Gesamt-Ansprechrate (overall response rate, ORR), Krankheits-Kontrollrate (disease control rate, DCR), Zeit bis zur Verschlechterung des ECOG-Status ≥ 2 sowie Lebensqualität (quality of life, QoL). Die Beurteilung des Tumors wurde gemäß den Bewertungskriterien für das Ansprechen der Behandlung bei soliden Tumoren (RECIST), Version 1.1, alle acht Wochen vom Prüfarzt / lokalen Radiologen durchgeführt.
Insgesamt wurden 507 Patienten im Verhältnis 2:1 randomisiert, die Lonsurf (n = 337) plus BSC (best supportive care) oder Placebo (n = 170) plus BSC erhielten. Lonsurf wurde basierend auf der KOF dosiert, wobei die Anfangsdosis 35 mg/m2/Dosis betrug. Die Studienmedikation wurde über 2 Wochen hinweg 2x täglich, jeweils morgens und abends nach den Mahlzeiten, an 5 Tagen pro Woche oral gegeben, mit 2 Tagen Pause. Daraufhin folgten 14 Tage Therapiepause. Dieser Zyklus wurde alle 4 Wochen wiederholt. Die Behandlung wurde bis zur Krankheitsprogression oder dem Auftreten einer inakzeptablen Toxizität (siehe Abschnitt 4.2) fortgesetzt.
Das mediane Alter der 507 randomisierten Patienten betrug 63 Jahre, 73 % von ihnen waren männlich, 70 % waren Kaukasier/weißer Hautfarbe, 16 % Asiaten und < 1% der Patienten waren afro-amerikanisch/schwarzer Hautfarbe. Alle Patienten hatten zu Beginn einen ECOG (Eastern Cooperative Oncology Group) Performance Status (PS) von 0 oder 1. Der Primärtumor befand sich im Magen (71,0 %) oder im gastroösophagealen Übergang (28,6 %) oder in beiden Regionen (0,4 %). Die Anzahl der vorhergehenden Therapieregime zur Behandlung der metastasierten Erkrankung betrug im Mittel 3. Nahezu alle Patienten (99,8 %) hatten zuvor Fluorpyrimidine erhalten, 100 % eine Platintherapie und 90,5 % eine Therapie mit Taxanen. Circa die Hälfte (55,4 %) der Patienten hatten zuvor Irinotecan bekommen, 33,3 % Ramucirumab und 16,6 % eine HER2-gerichtete Therapie. Die beiden Behandlungsgruppen waren hinsichtlich ihrer demographischen und krankheitsspezifischen Charakteristika zu Studienbeginn vergleichbar.
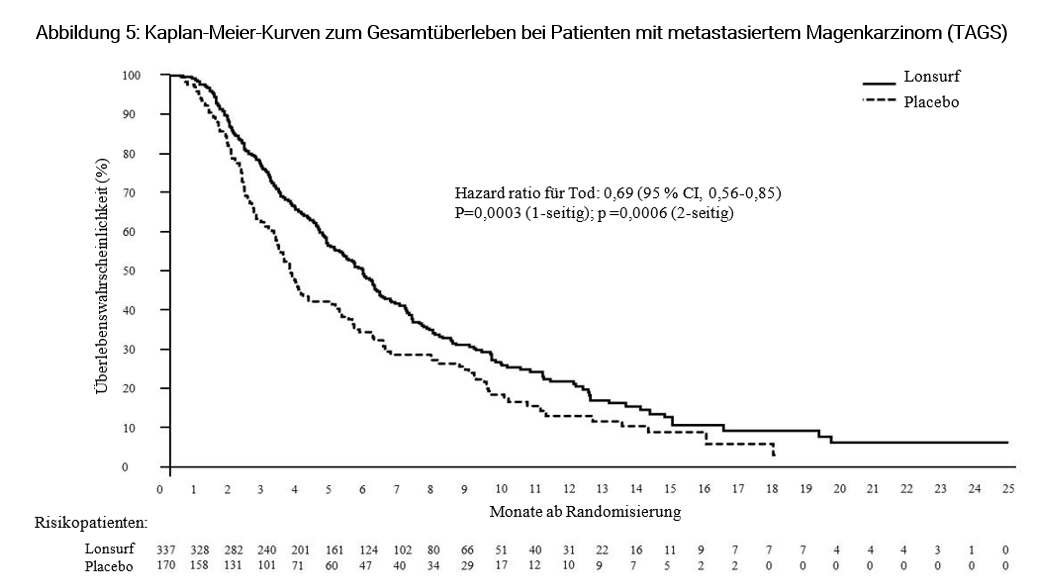
Eine Analyse des OS, wie geplant nach 76 % der Ereignisse (n = 384) durchgeführt, zeigte einen statistisch signifikanten Überlebensvorteil bei Lonsurf plus BSC im Vergleich zu Placebo plus BSC mit einer hazard ratio (HR) von 0,69 (95 % CI [0,56 -0,85]; 1- und 2-seitige p-Werte betrugen 0,0003 bzw. 0,0006). Dies entspricht einer 31%igen Verringerung des Sterberisikos in der Lonsurf-Gruppe. Das mediane OS betrug 5,7 Monate (95 % CI [4,8-6,2]) in der Lonsurf-Gruppe vs. 3,6 Monate (95 % CI [3,1-4,1]) in der Placebo-Gruppe mit 1-Jahres-Überlebensraten von 21,2 % bzw. 13,0 %.
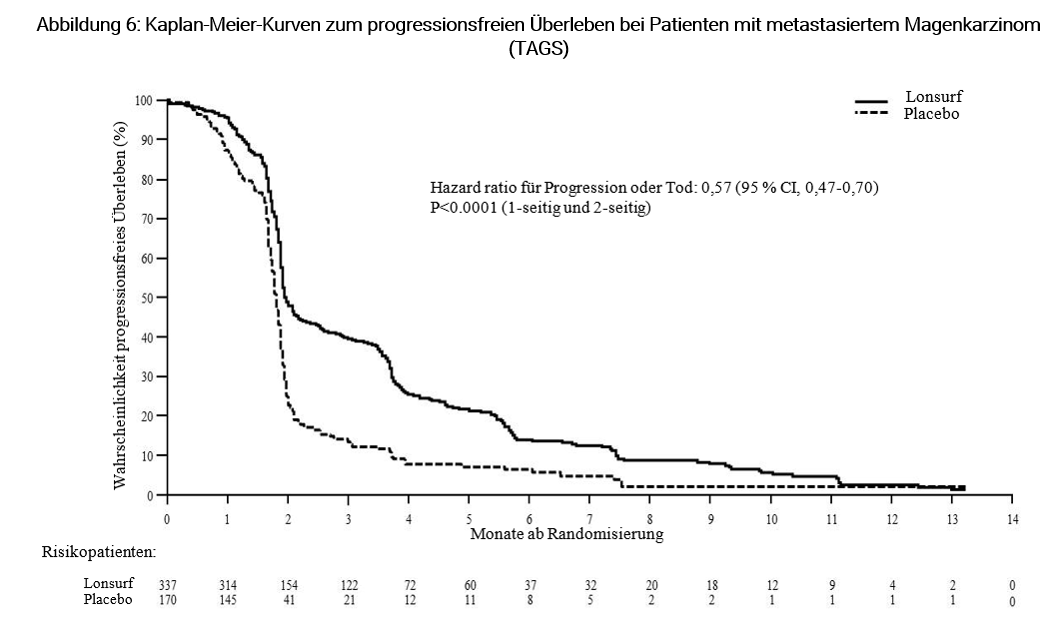
PFS war bei Patienten, die Lonsurf plus BSC erhielten, signifikant verbessert im Vergleich zu Placebo plus BSC (HR von 0,57; 95 % CI [0,47-0,70]; p < 0,0001 (siehe Tabelle 9, Abbildung 5 und Abbildung 6).
Tabelle 9: Ergebnisse zur Wirksamkeit aus der Phase III (TAGS)-Studie bei Patienten mit metastasiertem Magenkarzinom
Lonsurf plus BSC | Placebo plus BSC | ||
Gesamtüberleben (OS) | |||
Anzahl Todesfälle n (%) | 244 (72,4) | 140 (82,4) | |
Median OS (Monate) a [95 % CI]b | 5,7 [4,8-6,2] | 3,6 [3,1-4,1] | |
Hazard ratio [95 % CI] | 0.69 [0,56-0,85] | ||
p-Wertc | 0,0003 (1-seitig), 0,0006 (2-seitig) | ||
Progressionsfreies Überleben (PFS) | |||
Anzahl Ereignisse | 287 (85,2) | 156 (91,8) | |
Median PFS (Monate)a [95 % CI]b | 2,0 [1,9-2,3] | 1,8 [1,7-1,9] | |
Hazard ratio [95 % CI] | 0,57 [0,47-0,70] | ||
p-Wertc | < 0,0001 (1-seitig and 2-seitig) | ||
a | Kaplan-Meier-Schätzungen | ||
b | nach der Methode von Brookmeyer/Crowley | ||
c | Stratifizierter Log-rank-Test (Strata: Region, ECOG-Status zu Baseline, vorhergehende Ramucirumab-Behandlung) | ||
Der Behandlungsvorteil in Bezug auf OS und PFS wurde durchgehend beobachtet, in allen Randomisierungsschichten und über die meisten relevanten, prä-spezifizierten Subgruppen hinweg, einschließlich Geschlecht, Alter (< 65 Jahre; ≥ 65 Jahre), Ethnie, ECOG-PS, vorhergehende Ramucirumab-Behandlung, vorhergehende Irinotecan-Behandlung, Anzahl der Vortherapien (2; 3; ≥ 4), vorherige Gastrektomie, Lage des Primärtumors (Magen, gastroösophagealer Übergang) und HER2-Status.
Die ORR (Gesamtansprechen + Teilansprechen) war bei den Patienten, die mit Lonsurf behandelt wurden, nicht signifikant höher (4,5 % vs 2,1 %, p-Wert = 0,2833), aber die DCR (Gesamtansprechen oder Teilansprechen oder stabile Erkrankung) war bei diesen Patienten signifikant höher (44,1 % vs 14,5 %, p < 0,0001).
Die mittlere Zeit bis zum Erreichen eines ECOG-PS ≥ 2 betrug in der Lonsurf-Gruppe 4,3 Monate und in der Placebo-Gruppe 2,3 Monate mit einer HR von 0,69 (95 % CI [0,562-0,854]; p < 0,0005).
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Lonsurf eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei refraktärem metastasiertem KRK und bei refraktärem metastasiertem Magenkarzinom gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Ältere Patienten
Für Patienten, die mit Lonsurf behandelt wurden, im Alter zwischen 75 Jahren und älter, stehen nur begrenzt Daten zur Verfügung:
87 Patienten (10 %) aus den gepoolten Daten der RECOURSE- und TAGS-Studien, von denen 2 Patienten 85 Jahre oder älter waren. Die Wirkung von Lonsurf auf das Gesamtüberleben war bei Patienten < 65 Jahren und ≥ 65 Jahren ähnlich.
58 Patienten (12 %) waren 75 Jahre alt oder älter, davon 1 Patient 85 Jahre oder älter in der SUNLIGHT-Studie. Die Wirksamkeit von Lonsurf in Kombination mit Bevacizumab auf das Gesamtüberleben war bei Patienten < 65 Jahren und ≥ 65 Jahren ähnlich.
Resorption
Nach oraler Gabe von Lonsurf, welches [14C]-Trifluridin enthält, wird mindestens 57 % der verabreichten Menge resorbiert und nur 3 % mit den Faeces ausgeschieden. Nach oraler Gabe von Lonsurf, das [14C]-Tipiracil-Hydrochlorid enthält, wird mindestens 27 % der verabreichten Menge resorbiert, während 50 % der Gesamtradioaktivität in den Faeces nachgewiesen werden konnten. Dies deutet auf eine mäßig ausgeprägte, gastrointestinale Resorption von Tipiracil-Hydrochlorid hin.
Nach Gabe einer Einzeldosis Lonsurf (35 mg/m2) betrug die Zeit bis zur maximalen Plasmakonzentration (tmax) von Trifluridin und Tipiracil-Hydrochlorid ca. 2 bzw. 3 Stunden bei Patienten mit fortgeschrittenen soliden Tumoren.
Bei pharmakokinetischen Untersuchungen von wiederholten Gaben von Lonsurf (alle 4 Wochen Wiederholung des folgenden Schemas: über 2 Wochen hinweg zweimal täglich 35 mg/m2/Dosis an 5 Tagen in der Woche mit 2 Tagen Einnahmepause, gefolgt von einer 14-tägigen Einnahmepause) war die AUC von Trifluridin zwischen t0 und der letzten messbaren Konzentration (AUC0-last) in etwa 3‑fach höher als nach Einzelgabe (Tag 1 von Zyklus 1). Die maximale Plasmakonzentration (Cmax), gemessen an Tag 12 von Zyklus 1, war nach wiederholter Gabe in etwa 2‑fach höher.
Es kam jedoch zu keiner Akkumulation von Tipiracil-Hydrochlorid und auch zu keiner weiteren Akkumulation von Trifluridin nach Gabe weiterer Zyklen von Lonsurf (Tag 12 von Zyklus 2 und 3). Nach wiederholter Gabe von Lonsurf (zweimal täglich 35 mg/m2/Dosis) bei Patienten mit fortgeschrittenen soliden Tumoren betrug die Zeit bis zur maximalen Plasmakonzentration (tmax) von Trifluridin und Tipiracil-Hydrochlorid ca. 2 bzw. 3 Stunden.
Funktion von Tipiracil-Hydrochlorid in Lonsurf
Nach Einmalgabe von Lonsurf (35 mg/m2/Dosis) war im Vergleich zur Gabe von Trifluridin (35 mg/m2/Dosis) allein die durchschnittliche AUC0-last von Trifluridin 37‑fach größer und Cmax 22‑fach höher, wobei die Variabilität geringer war.
Auswirkung von Nahrungsmitteln
Nach Gabe einer Einzeldosis Lonsurf von 35 mg/m2 nach einer standardisierten fettreichen, kalorienreichen Mahlzeit bei 14 Patienten mit soliden Tumoren blieb die AUC von Trifluridin unverändert. Die Cmax von Trifluridin sowie die Cmax und AUC von Tipiracil waren jedoch im Vergleich zum nüchternen Zustand um ca. 40 % geringer. In klinischen Studien wurde Lonsurf innerhalb 1 Stunde nach der morgendlichen und abendlichen Mahlzeit gegeben (siehe Abschnitt 4.2).
Verteilung
Die Bindung an Plasmaproteine betrug beim Menschen mehr als 96 %, wobei Trifluridin hauptsächlich an Albumin gebunden war. Bei Tipiracil-Hydrochlorid betrug die Plasmaproteinbindung weniger als 8 %. Das scheinbare Verteilungsvolumen (Vd/F) von Trifluridin betrug nach einer Einzeldosis von Lonsurf (35 mg/m2) bei Patienten mit fortgeschrittenen soliden Tumoren 21 l, von Tipiracil-Hydrochlorid 333 l.
Biotransformation
Die Elimination von Trifluridin erfolgt hauptsächlich durch Umwandlung in seinen inaktiven Metaboliten, FTY, mittels TPase. Die resorbierte Menge Trifluridin wird metabolisiert und als FTY und Trifluridin-Glucuronid-Isomere im Urin ausgeschieden. Andere, weniger häufige Metabolite wie 5-Carboxyuracil und 5-Carboxy-2'-desoxyuridin wurden ebenso in Plasma und Urin nachgewiesen, jedoch nur in geringer Menge oder Spuren.
Tipiracil-Hydrochlorid wurde weder bei Untersuchungen mit humaner S9-Fraktion noch cryokonservierten, humanen Hepatozyten metabolisiert. Der Hauptbestandteil in humanem Plasma, Urin und Faeces war Tipiracil-Hydrochlorid, der Hauptmetabolit 6-Hydroxymethyluracil.
Elimination
Die durchschnittliche Eliminationshalbwertszeit (t1/2) nach wiederholter Gabe von Lonsurf entsprechend empfohlener Dosierung und Schema betrug für Trifluridin am Tag 1 von Zyklus 1 1,4 Stunden und am Tag 12 von Zyklus 1 2,1 Stunden. Für Tipiracil-Hydrochlorid betrug die durchschnittliche t1/2 am Tag 1 von Zyklus 1 2,1 Stunden und am Tag 12 von Zyklus 1 2,4 Stunden.
Nach Einmalgabe von Lonsurf (35 mg/m2) bei Patienten mit fortgeschrittenen soliden Tumoren betrug die orale Clearance für Trifluridin 10,5 l/h und für Tipiracil-Hydrochlorid 109 l/h. Nach oraler Gabe einer Einzeldosis von Lonsurf mit [14C]-Trifluridin betrug die kumulative Gesamtmenge an ausgeschiedener Radioaktivität 60 % der verabreichten Dosis. Der überwiegende Anteil der nachgewiesenen Radioaktivität wurde innerhalb von 24 Stunden im Urin (55 % der Dosis) ausgeschieden, während die Ausscheidung in Faeces und ausgeatmeter Luft zusammen weniger als 3 % ausmachte. Für Tipiracil-Hydrochlorid betrug nach oraler Einmalgabe von Lonsurf mit [14C]-Tipiracil-Hydrochlorid der wiedererlangte Anteil Radioaktivität 77 % der Dosis, welche sich aus 27 % renaler und 50 % fäkaler Elimination zusammensetzen.
Linearität/Nicht-Linearität
In einer Dosisfindungsstudie (zweimal täglich 15 bis 35 mg/m2) stieg die AUC von Trifluridin im Zeitfenster von 0 bis 10 Stunden (AUC0-10) tendenziell stärker als aufgrund der Dosissteigerung erwartet an. Die Clearance (Cl/F) nach oraler Gabe und das scheinbare Verteilungsvolumen (Vd/F) von Trifluridin waren im Allgemeinen im Dosisbereich zwischen 20 und 35 mg/m2 konstant. Beide scheinen, ebenso wie andere Expositionsparameter von Trifluridin und Tipiracil-Hydrochlorid, proportional zur Dosis zu sein.
Pharmakokinetische (PK) Eigenschaften bei speziellen Patientengruppen
Alter, Geschlecht, ethnische Zugehörigkeit
Eine Analyse zur Populationspharmakokinetik ergab keine klinisch relevanten Effekte von Alter, Geschlecht, ethnischer Zugehörigkeit auf die Pharmakokinetik von Trifluridin oder Tipiracil-Hydrochlorid.
Nierenfunktionsstörung
Von den 533 in die RECOURSE-Studie eingeschlossenen Patienten, die Lonsurf erhielten, verfügten 306 Patienten (57 %) über eine normale Nierenfunktion (ClKr ≥ 90 ml/min). Bei 178 Patienten (33 %) war die Nierenfunktion leicht eingeschränkt (ClKr 60 bis 89 ml/min), 47 Patienten (9 %) hatten eine mäßig eingeschränkte Nierenfunktion (ClKr 30 bis 59 ml/min) und bei 2 Patienten lagen keine Daten vor. Patienten mit stark eingeschränkter Nierenfunktion wurden nicht in die Studie eingeschlossen.
Eine Analyse zur Populationspharmakokinetik zeigte, dass die Exposition von Lonsurf in Patienten mit leicht eingeschränkter (ClKr 60 bis 89 ml/min) und normaler Nierenfunktion (ClKr ≥ 90 ml/min) ähnlich ist. Bei mäßig eingeschränkter Nierenfunktion (ClKr 30 bis 59 ml/min) wurde eine höhere Lonsurf-Exposition beobachtet. Die geschätzte ClKr war eine signifikante Kovariate für die Cl/F in beiden finalen Modellen von Trifluridin und Tipiracil-Hydrochlorid. Das durchschnittliche relative Verhältnis der AUC von Patienten mit leicht (n = 38) und mäßig (n = 16) eingeschränkter Nierenfunktion zu Patienten mit normaler Nierenfunktion (n = 84) betrug für Trifluridin 1,31 bzw. 1,43 und für Tipiracil-Hydrochlorid 1,34 bzw. 1,65.
In einer speziellen Studie wurde die Pharmakokinetik von Trifluridin und Tipiracil-Hydrochlorid bei Krebspatienten mit normaler Nierenfunktion (ClKr ≥ 90 ml/min, n = 12), leichter Nierenfunktionsstörung (ClKr 60 bis 89 ml/min, n = 12), mäßiger Nierenfunktionsstörung (ClKr 30 bis 59 ml/min, n = 11) oder schwerer Nierenfunktionsstörung (ClKr 15 bis 29 ml/min, n = 8) evaluiert. Patienten mit schwerer Nierenfunktionsstörung erhielten eine angepasste Anfangsdosis von 20 mg/m² zweimal täglich (reduziert auf 15 mg/m² zweimal täglich basierend auf der individuellen Sicherheit und Verträglichkeit). Der Effekt der Nierenfunktionsstörung nach wiederholter Gabe war eine 1,6‑fache bzw. 1,4‑fache Erhöhung der Trifluridin-Gesamtexposition bei Patienten mit mäßiger bzw. schwerer Nierenfunktionsstörung verglichen mit Patienten mit normaler Nierenfunktion: Cmax blieb ähnlich. Die Tipiracil-Hydrochlorid-Gesamtexposition bei Patienten mit mäßiger und schwerer Nierenfunktionsstörung war nach wiederholter Gabe um das 2,3-Fache bzw. 4,1-Fache erhöht im Vergleich zu Patienten mit normaler Nierenfunktion. Dieser Effekt wird auf die verringerte Clearance bei steigender Nierenfunktionsstörung zurückgeführt.
Bei Patienten mit Niereninsuffizienz im Endstadium (ClKr < 15 ml/min oder erforderlicher Dialyse) wurde die PK von Trifluridin und Tipiracil-Hydrochlorid nicht untersucht (siehe Abschnitte 4.2 und 4.4).
Leberfunktionsstörung
Die Analyse zur Populationspharmakokinetik ergab, dass Leberfunktionsparameter einschließlich alkalischer Phosphatase (AP, 36-2322 U/l), Aspartataminotransferase (AST, 11-197 U/l), Alaninaminotransferase (ALT, 5-182 U/l) und Gesamtbilirubin (0,17-3,20 mg/dl) sowohl für PK-Parameter von Trifluridin als auch Tipiracil-Hydrochlorid keine signifikanten Kovariaten darstellen. Serum Albumin beeinflusst mit negativer Korrelation signifikant die Trifluridin-Clearance. Für niedrige Albumin-Werte zwischen 2,2 und 3,5 g/dl betrugen die entsprechenden Clearance-Werte 4,2 bis 3,1 l/h.
Die PK von Trifluridin und Tipiracil-Hydrochlorid bei Patienten mit leichter oder mäßiger Leberfunktionsstörung (National Cancer Institute [NCI] Gruppe B bzw. C) und bei Patienten mit normaler Leberfunktion wurde in einer speziellen Studie untersucht. Es wurde kein signifikanter Unterschied der PK bei Patienten mit normaler Leberfunktion im Vergleich zu Patienten mit leichter oder mäßiger Leberfunktionsstörung beobachtet auf Grundlage dieser begrenzten Daten bei beträchtlicher Variabilität. Weder für Trifluridin noch für Tipiracil-Hydrochlorid wurde eine Korrelation zwischen PK-Parametern und AST und/oder Gesamtbilirubin beobachtet. Die t1/2 und das Akkumulationsverhältnis von Trifluridin und Tipiracil-Hydrochlorid waren bei Patienten mit normaler, leicht und mäßig eingeschränkter Leberfunktion ähnlich. Bei Patienten mit leichter Leberfunktionsstörung ist keine Anpassung der Anfangsdosis notwendig (siehe Abschnitt 4.2).
Gastrektomie
Es war nicht möglich den Einfluss einer Gastrektomie auf PK-Parameter im Rahmen einer Analyse zur Populationspharmakokinetik zu untersuchen, da nur wenige Patienten einer Gastrektomie unterzogen wurden (insgesamt 1 %).
In vitro-Interaktionsstudien
Trifluridin ist ein Substrat der TPase, wird jedoch nicht über Cytochrom P450 (CYP) metabolisiert. Tipiracil-Hydrochlorid wird weder mittels humaner S9-Fraktion noch cryokonservierter Hepatozyten metabolisiert.
In vitro-Analysen deuten darauf hin, dass weder Trifluridin noch Tipiracil-Hydrochlorid noch FTY (inaktiver Metabolit von Trifluridin) die untersuchten CYP-Isoenzyme hemmen (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 und CYP3A4/5). Eine in vitro-Analyse zeigte, dass Trifluridin, Tipiracil-Hydrochlorid und FTY keinen induzierenden Effekt auf humanes CYP1A2, CYP2B6 oder CYP3A4/5 haben. Es wird daher nicht erwartet, dass Trifluridin und Tipiracil-Hydrochlorid eine CYP-vermittelte Interaktion verursachen oder dieser unterliegen.
Weitere in vitro-Analysen von Trifluridin und Tipiracil-Hydrochlorid wurden unter Verwendung humaner Transportproteine für Influx und Efflux durchgeführt (Trifluridin mit MDR1, OATP1B1, OATP1B3 und BCRP; Tipiracil-Hydrochlorid mit OAT1, OAT3, OCT2, MATE1, MDR1 und BCRP). Weder Trifluridin noch Tipiracil-Hydrochlorid waren bei in vitro-Analysen Inhibitor oder Substrat für diese Influx- und Efflux-Transportproteine, mit Ausnahme von OCT2 und MATE1. Tipiracil-Hydrochlorid war in vitro ein Inhibitor von OCT2 und MATE1, allerdings in Konzentrationen, die weit über dem Cmax in humanem Plasma bei Steady-State liegen. Daher ist es unwahrscheinlich, dass bei empfohlener Dosierung Interaktionen mit anderen Arzneimitteln durch Hemmung von OCT2 und MATE1 verursacht werden. Der Transport von Tipiracil-Hydrochlorid könnte beeinträchtigt sein, wenn Lonsurf zusammen mit Inhibitoren von OCT2 und MATE1 gegeben wird.
Pharmakokinetische/pharmakodynamische Zusammenhänge
Die Wirksamkeit und Sicherheit von Lonsurf beim metastasierten KRK in einer Gruppe mit hoher Exposition (> Median) wurde mit einer Gruppe niedriger Exposition (≤ Median), basierend auf den medianen AUC-Werten von Trifluridin, verglichen. Die OS schien in der Gruppe mit großer AUC günstiger zu sein im Vergleich zur Gruppe mit kleiner AUC (medianes OS 9,3 Monate vs. 8,1 Monate). Während der Follow-up-Phase zeigten die Patienten in allen AUC-Gruppen einen günstigeren Verlauf als unter Placebo. Die Inzidenz für Grad ≥ 3 Neutropenie war in der Gruppe mit hoher Trifluridin-AUC höher (47,8 %) als in der Gruppe mit niedriger AUC (30,4 %).
Toxizität bei wiederholter Verabreichung
Die toxikologische Beurteilung von Trifluridin/Tipiracil-Hydrochlorid erfolgte bei Ratten, Hunden und Affen. Als Zielorgane wurden das lymphatische und hämatopoetische System sowie der Magen-Darm-Trakt identifiziert. Sämtliche Veränderungen, beispielsweise Leukopenie, Anämie, Knochenmarkshypoplasie, atrophische Veränderungen der lymphatischen und hämatopoetischen Gewebe und des Magen-Darm-Trakts waren innerhalb von 9 Wochen nach Absetzen des Arzneimittels reversibel. An den Zähnen von Ratten wurden unter Trifluridin/Tipiracil-Hydrochlorid weißliche Verfärbungen, Brüchigkeit und Okklusionsstörungen beobachtet, welche als Nager-spezifisch und für den Menschen nicht relevant eingestuft wurden.
Kanzerogenität und Mutagenität
Es wurden keine tierexperimentellen Langzeitstudien zur Beurteilung des karzinogenen Potentials von Trifluridin/Tipiracil-Hydrochlorid durchgeführt. Trifluridin war im Rückmutationstest (AMES-Test) an Bakterien, beim Chromosomenaberrations-Test in Säugetierzellen, und im Mikrokerntest bei Mäusen genotoxisch. Daher sollte Lonsurf als potentielles Karzinogen behandelt werden.
Reproduktionstoxizität
Die Ergebnisse von tierexperimentellen Studien zeigten keine Hinweise auf einen Effekt von Trifluridin und Tipiracil-Hydrochlorid auf die männliche und weibliche Fertilität bei Ratten. Der beobachtete Anstieg in der Anzahl der Gelbkörper und von sich einnistenden Embryos bei weiblichen Ratten bei hohen Dosen wurde nicht als schädlich betrachtet (siehe Abschnitt 4.6). Bei trächtigen Ratten wurde für Lonsurf eine embryo-fetale Letalität und embryo-fetale Toxizität gezeigt, wenn es in Dosen unterhalb der klinischen Exposition gegeben wurde. Es wurden keine Studien zur peri/postnatalen Entwicklungstoxizität durchgeführt.
Tablettenkern
Lactose-Monohydrat
vorverkleisterte Stärke (Mais)
Stearinsäure
Filmüberzug
Lonsurf 15 mg/6,14 mg Filmtabletten
Hypromellose
Macrogol (8000)
Titandioxid (E171)
Magnesiumstearat
Lonsurf 20 mg/8,19 mg Filmtabletten
Hypromellose
Macrogol (8000)
Titandioxid (E171)
Eisen(III)-oxid (E172)
Magnesiumstearat
Drucktinte
Schellack
Eisen(III)-oxid (E172)
Eisen(III)-hydroxid-oxid x H2O (E172)
Titandioxid (E171)
Indigocarmin-Aluminiumsalz (E132)
Carnaubawachs
Talkum
Nicht zutreffend.
3 Jahre
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Aluminium/Aluminium-Blisterpackung mit laminiertem Trocknungsmittel (Calciumoxid) mit 10 Tabletten.
Jede Packung enthält 20, 40 oder 60 Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Nach Umgang mit den Tabletten sollten die Hände gewaschen werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes Cedex
Frankreich
EU/1/16/1096/001-006
Datum der Erteilung der Zulassung: 25. April 2016
Datum der letzten Verlängerung der Zulassung: 14. Dezember 2020
Juli 2023
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
20 Filmtabletten
60 Filmtabletten
Servier Deutschland GmbH
Elsenheimerstr. 53
D-80687 München
Tel: +49 (0)89 57095-01
Fax: +49 (0)89 57095-126
E-mail: info-de@servier.com