KEYTRUDA® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung
Eine Durchstechflasche mit 4 ml Konzentrat enthält 100 mg Pembrolizumab.
Jeder ml des Konzentrats enthält 25 mg Pembrolizumab.
Pembrolizumab ist ein humanisierter monoklonaler „anti-programmed cell death-1“ (PD-1)-Antikörper (IgG4/Kappa-Isotyp mit einer stabilisierenden Sequenzänderung in der Fc-Region), welcher mittels rekombinanter DNA-Technologie in Chinesischen-Hamster-Ovarialzellen („CHO-Zellen“) hergestellt wird.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Konzentrat zur Herstellung einer Infusionslösung.
Klare bis leicht opaleszente, farblose bis leicht gelbliche Lösung, pH 5,2 – 5,8.
Melanom
KEYTRUDA ist als Monotherapie zur Behandlung des fortgeschrittenen (nicht resezierbaren oder metastasierenden) Melanoms bei Kindern und Jugendlichen ab 12 Jahren und Erwachsenen angezeigt.
KEYTRUDA ist als Monotherapie zur adjuvanten Behandlung des Melanoms in den Tumorstadien IIB, IIC oder III nach vollständiger Resektion bei Kindern und Jugendlichen ab 12 Jahren und Erwachsenen angezeigt (siehe Abschnitt 5.1).
Nicht-kleinzelliges Lungenkarzinom (non-small cell lung carcinoma, NSCLC)
KEYTRUDA ist in Kombination mit Platin-basierter Chemotherapie zur neoadjuvanten und anschließend als Monotherapie zur adjuvanten Behandlung des resezierbaren nicht-kleinzelligen Lungenkarzinoms mit hohem Rezidivrisiko bei Erwachsenen angezeigt (hinsichtlich Selektionskriterien siehe Abschnitt 5.1).
KEYTRUDA ist als Monotherapie zur adjuvanten Behandlung des nicht-kleinzelligen Lungenkarzinoms mit hohem Rezidivrisiko nach vollständiger Resektion und Platin-basierter Chemotherapie bei Erwachsenen angezeigt (hinsichtlich Selektionskriterien siehe Abschnitt 5.1).
KEYTRUDA ist als Monotherapie zur Erstlinienbehandlung des metastasierenden nicht-kleinzelligen Lungenkarzinoms mit PD‑L1-exprimierenden Tumoren (Tumor Proportion Score [TPS] ≥ 50 %) ohne EGFR- oder ALK-positive Tumormutationen bei Erwachsenen angezeigt.
KEYTRUDA ist in Kombination mit Pemetrexed und Platin-Chemotherapie zur Erstlinienbehandlung des metastasierenden nicht-plattenepithelialen nicht-kleinzelligen Lungenkarzinoms ohne EGFR- oder ALK-positive Tumormutationen bei Erwachsenen angezeigt.
KEYTRUDA ist in Kombination mit Carboplatin und entweder Paclitaxel oder nab-Paclitaxel zur Erstlinienbehandlung des metastasierenden plattenepithelialen nicht-kleinzelligen Lungenkarzinoms bei Erwachsenen angezeigt.
KEYTRUDA ist als Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierenden nicht-kleinzelligen Lungenkarzinoms mit PD‑L1-exprimierenden Tumoren (TPS ≥ 1 %) nach vorheriger Chemotherapie bei Erwachsenen angezeigt. Patienten mit EGFR- oder ALK-positiven Tumormutationen sollten vor der Therapie mit KEYTRUDA ebenfalls eine auf diese Mutationen zielgerichtete Therapie erhalten haben.
Malignes Pleuramesotheliom (Malignant pleural mesothelioma, MPM)
KEYTRUDA ist in Kombination mit Pemetrexed und Platin-Chemotherapie zur Erstlinienbehandlung des nicht resezierbaren nicht-epitheloiden malignen Pleuramesothelioms bei Erwachsenen angezeigt.
Klassisches Hodgkin-Lymphom (HL)
KEYTRUDA ist als Monotherapie zur Behandlung des rezidivierenden oder refraktären klassischen Hodgkin-Lymphoms bei Kindern und Jugendlichen ab 3 Jahren und Erwachsenen nach Versagen einer autologen Stammzelltransplantation (auto-SZT) oder nach mindestens zwei vorangegangenen Therapien, wenn eine auto-SZT nicht in Frage kommt, angezeigt.
Urothelkarzinom
KEYTRUDA ist in Kombination mit Enfortumab vedotin zur Erstlinienbehandlung des nicht resezierbaren oder metastasierenden Urothelkarzinoms bei Erwachsenen angezeigt.
KEYTRUDA ist als Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierenden Urothelkarzinoms nach vorheriger Platin-basierter Therapie bei Erwachsenen angezeigt (siehe Abschnitt 5.1).
KEYTRUDA ist als Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierenden Urothelkarzinoms bei Erwachsenen, die nicht für eine Cisplatin-basierte Therapie geeignet sind und deren Tumoren PD‑L1 mit einem kombinierten positiven Score (CPS) ≥ 10 exprimieren, angezeigt (siehe Abschnitt 5.1).
Plattenepithelkarzinom der Kopf-Hals-Region (head and neck squamous cell carcinoma, HNSCC)
KEYTRUDA ist als Monotherapie oder in Kombination mit Platin- und 5‑Fluorouracil (5‑FU)‑Chemotherapie zur Erstlinienbehandlung des metastasierenden oder nicht resezierbaren rezidivierenden Plattenepithelkarzinoms der Kopf-Hals-Region bei Erwachsenen mit PD‑L1-exprimierenden Tumoren (Combined Positive Score [CPS] ≥ 1) angezeigt (siehe Abschnitt 5.1).
KEYTRUDA ist als Monotherapie zur Behandlung des rezidivierenden oder metastasierenden Plattenepithelkarzinoms der Kopf-Hals-Region mit PD‑L1-exprimierenden Tumoren (TPS ≥ 50 %) und einem Fortschreiten der Krebserkrankung während oder nach vorheriger Platin-basierter Therapie bei Erwachsenen angezeigt (siehe Abschnitt 5.1).
Nierenzellkarzinom (renal cell carcinoma, RCC)
KEYTRUDA ist in Kombination mit Axitinib zur Erstlinienbehandlung des fortgeschrittenen Nierenzellkarzinoms bei Erwachsenen angezeigt (siehe Abschnitt 5.1).
KEYTRUDA ist in Kombination mit Lenvatinib zur Erstlinienbehandlung des fortgeschrittenen Nierenzellkarzinoms bei Erwachsenen angezeigt (siehe Abschnitt 5.1).
KEYTRUDA ist als Monotherapie zur adjuvanten Behandlung des Nierenzellkarzinoms mit erhöhtem Rezidivrisiko nach Nephrektomie oder nach Nephrektomie und Resektion metastasierter Läsionen bei Erwachsenen angezeigt (hinsichtlich Selektionskriterien siehe Abschnitt 5.1).
Tumoren mit hochfrequenter Mikrosatelliten-Instabilität (MSI‑H) oder mit einer Mismatch-Reparatur-Defizienz (dMMR)
Kolorektalkarzinom (colorectal cancer, CRC)
KEYTRUDA ist als Monotherapie des Kolorektalkarzinoms mit MSI‑H oder mit einer dMMR wie folgt bei Erwachsenen angezeigt:
zur Erstlinienbehandlung des metastasierenden Kolorektalkarzinoms.
zur Behandlung des nicht resezierbaren oder metastasierenden Kolorektalkarzinoms nach vorheriger Fluoropyrimidin-basierter Kombinationstherapie.
Nicht-kolorektale Karzinome
KEYTRUDA ist als Monotherapie zur Behandlung der folgenden Tumoren mit MSI‑H oder mit einer dMMR bei Erwachsenen angezeigt:
fortgeschrittenes oder rezidivierendes Endometriumkarzinom mit einem Fortschreiten der Erkrankung während oder nach vorheriger Platin-basierter Therapie in jedem Krankheitsstadium, wenn eine kurative chirurgische Behandlung oder Bestrahlung nicht in Frage kommt.
nicht resezierbares oder metastasierendes Magen-, Dünndarm- oder biliäres Karzinom mit einem Fortschreiten der Erkrankung während oder nach mindestens einer vorherigen Therapie.
Ösophaguskarzinom
KEYTRUDA ist in Kombination mit einer Platin- und Fluoropyrimidin-basierten Chemotherapie zur Erstlinienbehandlung des lokal fortgeschrittenen nicht resezierbaren oder metastasierenden Ösophaguskarzinoms bei Erwachsenen mit PD‑L1-exprimierenden Tumoren (CPS ≥ 10) angezeigt (siehe Abschnitt 5.1).
Triple-negatives Mammakarzinom (triple-negative breast cancer, TNBC)
KEYTRUDA ist in Kombination mit Chemotherapie zur neoadjuvanten und anschließend nach Operation als Monotherapie zur adjuvanten Behandlung des lokal fortgeschrittenen oder frühen triple-negativen Mammakarzinoms mit hohem Rezidivrisiko bei Erwachsenen angezeigt (siehe Abschnitt 5.1).
KEYTRUDA ist in Kombination mit Chemotherapie zur Behandlung des lokal rezidivierenden nicht resezierbaren oder metastasierenden triple-negativen Mammakarzinoms mit PD-L1-exprimierenden Tumoren (Combined Positive Score [CPS] ≥ 10) bei Erwachsenen, die keine vorherige Chemotherapie zur Behandlung der metastasierenden Erkrankung erhalten haben, angezeigt (siehe Abschnitt 5.1).
Endometriumkarzinom (endometrial carcinoma, EC)
KEYTRUDA ist in Kombination mit Carboplatin und Paclitaxel zur Erstlinienbehandlung des primär fortgeschrittenen oder rezidivierenden Endometriumkarzinoms bei Erwachsenen, die für eine systemische Therapie geeignet sind, angezeigt.
KEYTRUDA ist in Kombination mit Lenvatinib zur Behandlung des fortgeschrittenen oder rezidivierenden Endometriumkarzinoms bei Erwachsenen mit einem Fortschreiten der Erkrankung während oder nach vorheriger Platin-basierter Therapie in jedem Krankheitsstadium, wenn eine kurative chirurgische Behandlung oder Bestrahlung nicht in Frage kommt, angezeigt.
Zervixkarzinom
KEYTRUDA ist in Kombination mit Radiochemotherapie (perkutane Strahlentherapie, gefolgt von einer Brachytherapie) zur Behandlung des lokal fortgeschrittenen Zervixkarzinoms (Stadium III bis IVA gemäß FIGO 2014) bei Erwachsenen, die keine vorherige definitive Therapie erhalten haben, angezeigt.
KEYTRUDA ist in Kombination mit Chemotherapie mit oder ohne Bevacizumab zur Behandlung des persistierenden, rezidivierenden oder metastasierenden Zervixkarzinoms mit PD‑L1-exprimierenden Tumoren (CPS ≥ 1) bei Erwachsenen angezeigt.
Adenokarzinom des Magens oder des gastroösophagealen Übergangs (gastro-oesophageal junction, GEJ)
KEYTRUDA ist in Kombination mit Trastuzumab sowie einer Fluoropyrimidin- und Platin-basierten Chemotherapie zur Erstlinienbehandlung des lokal fortgeschrittenen nicht resezierbaren oder metastasierenden HER2-positiven Adenokarzinoms des Magens oder des gastroösophagealen Übergangs bei Erwachsenen mit PD‑L1-exprimierenden Tumoren (CPS ≥ 1) angezeigt.
KEYTRUDA ist in Kombination mit einer Fluoropyrimidin- und Platin-basierten Chemotherapie zur Erstlinienbehandlung des lokal fortgeschrittenen nicht resezierbaren oder metastasierenden HER2-negativen Adenokarzinoms des Magens oder des gastroösophagealen Übergangs bei Erwachsenen mit PD‑L1-exprimierenden Tumoren (CPS ≥ 1) angezeigt (siehe Abschnitt 5.1).
Biliäres Karzinom (biliary tract carcinoma, BTC)
KEYTRUDA ist in Kombination mit Gemcitabin und Cisplatin zur Erstlinienbehandlung des lokal fortgeschrittenen nicht resezierbaren oder metastasierenden biliären Karzinoms bei Erwachsenen angezeigt.
Die Therapie muss von einem in der Durchführung von onkologischen Therapien erfahrenen Arzt eingeleitet und überwacht werden.
PD‑L1-Test
Falls im Anwendungsgebiet angegeben, sollten Patienten für eine Behandlung mit KEYTRUDA aufgrund einer, mittels eines validierten Tests bestätigten, PD‑L1-Expression der Tumoren selektiert werden (siehe Abschnitte 4.1, 4.4, 4.8 und 5.1).
MSI-/MMR-Test
Falls im Anwendungsgebiet angegeben, sollten Patienten für eine Behandlung mit KEYTRUDA aufgrund des, mittels eines validierten Tests bestätigten, MSI‑H-/dMMR-Tumorstatus selektiert werden (siehe Abschnitte 4.1 und 5.1).
Dosierung
Die empfohlene Dosis von KEYTRUDA bei Erwachsenen beträgt entweder 200 mg alle 3 Wochen oder 400 mg alle 6 Wochen als intravenöse Gabe über 30 Minuten.
Die empfohlene Dosis von KEYTRUDA als Monotherapie bei Kindern und Jugendlichen ab 3 Jahren mit klassischem HL oder Kindern und Jugendlichen ab 12 Jahren mit Melanom beträgt 2 mg/kg Körpergewicht (KG) (bis zu einem Maximum von 200 mg) alle 3 Wochen als intravenöse Gabe über 30 Minuten.
Bei Anwendung in Kombination sind die Fachinformationen (Summary of Product Characteristics, SmPC) der jeweiligen begleitenden Therapeutika zu berücksichtigen.
Die Patienten sollten mit KEYTRUDA bis zum Fortschreiten der Krebserkrankung oder bis zum Auftreten unzumutbarer Toxizität (bzw. bis zur maximalen Therapiedauer, falls diese für eine Indikation angegeben wurde) behandelt werden. Atypisches Ansprechen (im Sinne eines anfänglichen vorübergehenden Tumorwachstums oder kleiner neuer Läsionen innerhalb der ersten wenigen Monate mit anschließender Tumorregression) wurde beobachtet. Es wird empfohlen, klinisch stabile Patienten mit initialem Befund eines Fortschreitens der Krebserkrankung bis zur Bestätigung des Fortschreitens der Krebserkrankung weiter zu behandeln.
Zur adjuvanten Behandlung des Melanoms, des NSCLC oder des RCC sollte KEYTRUDA bis zum Auftreten eines Rezidivs, unzumutbarer Toxizität oder bis zu einer Dauer von bis zu einem Jahr gegeben werden.
Zur neoadjuvanten und adjuvanten Behandlung des resezierbaren NSCLC: Patienten sollten neoadjuvant mit KEYTRUDA in Kombination mit Chemotherapie mit 4 Dosen von 200 mg alle 3 Wochen oder 2 Dosen von 400 mg alle 6 Wochen oder bis zum Fortschreiten der Krebserkrankung, das eine kurative Operation ausschließt, oder bis zum Auftreten unzumutbarer Toxizität behandelt werden. Daran anschließend sollte eine adjuvante Behandlung mit KEYTRUDA als Monotherapie mit 13 Dosen von 200 mg alle 3 Wochen oder 7 Dosen von 400 mg alle 6 Wochen oder bis zum Auftreten eines Rezidivs oder unzumutbarer Toxizität erfolgen. Patienten, bei denen ein Fortschreiten der Krebserkrankung, das eine kurative Operation ausschließt, oder eine unzumutbare Toxizität unter neoadjuvanter Behandlung mit KEYTRUDA in Kombination mit Chemotherapie auftritt, sollten keine KEYTRUDA Monotherapie als adjuvante Behandlung erhalten.
Zur neoadjuvanten und adjuvanten Behandlung des TNBC: Patienten sollten neoadjuvant mit KEYTRUDA in Kombination mit Chemotherapie mit 8 Dosen von 200 mg alle 3 Wochen oder 4 Dosen von 400 mg alle 6 Wochen oder bis zum Fortschreiten der Krebserkrankung, das eine kurative Operation ausschließt, oder bis zum Auftreten unzumutbarer Toxizität behandelt werden. Daran anschließend sollte eine adjuvante Behandlung mit KEYTRUDA als Monotherapie mit 9 Dosen von 200 mg alle 3 Wochen oder 5 Dosen von 400 mg alle 6 Wochen oder bis zum Auftreten eines Rezidivs oder unzumutbarer Toxizität erfolgen. Patienten, bei denen ein Fortschreiten der Krebserkrankung, das eine kurative Operation ausschließt, oder eine unzumutbare Toxizität unter neoadjuvanter Behandlung mit KEYTRUDA in Kombination mit Chemotherapie auftritt, sollten keine KEYTRUDA Monotherapie als adjuvante Behandlung erhalten.
Zur Behandlung des lokal fortgeschrittenen Zervixkarzinoms: Patienten sollten gleichzeitig mit KEYTRUDA und Radiochemotherapie behandelt werden, gefolgt von KEYTRUDA als Monotherapie. KEYTRUDA kann entweder mit Dosen von 200 mg alle 3 Wochen oder 400 mg alle 6 Wochen bis zum Fortschreiten der Krebserkrankung, unzumutbarer Toxizität oder bis zu einer Dauer von 24 Monaten gegeben werden.
Aufschub der Dosierung oder Absetzen der Therapie (siehe auch Abschnitt 4.4)
Dosisreduktionen von KEYTRUDA werden nicht empfohlen. Zum Nebenwirkungsmanagement ist die Behandlung mit KEYTRUDA zu unterbrechen oder dauerhaft abzusetzen, wie in Tabelle 1 beschrieben.
Tabelle 1: Empfehlungen zur Anpassung der Behandlung mit KEYTRUDA
Immunvermittelte Nebenwirkungen | Schweregrad | Modifikation der Behandlung |
Pneumonitis | Grad 2 | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 − 1 gebessert haben* |
Grad 3 oder Grad 4 oder wiederholt Grad 2 | dauerhaftes Absetzen | |
Kolitis | Grad 2 oder Grad 3 | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 − 1 gebessert haben* |
Grad 4 oder wiederholt Grad 3 | dauerhaftes Absetzen | |
Nephritis | Grad 2 mit einer > 1,5- bis ≤ 3‑fachen Erhöhung von Serumkreatinin über dem oberen Normwert (ULN) | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 – 1 gebessert haben* |
Grad ≥ 3 mit > 3‑facher Erhöhung von Serumkreatinin über dem oberen Normwert (ULN) | dauerhaftes Absetzen | |
Endokrinopathien | Grad‑2‑Nebenniereninsuffizienz und ‑Hypophysitis | Unterbrechung der Behandlung, bis die Nebenwirkungen mit Hormonsubstitution kontrolliert sind |
Grad‑3- oder Grad‑4-Nebenniereninsuffizienz oder ‑symptomatische‑Hypophysitis Diabetes Typ 1 assoziiert mit einer Grad ≥ 3 Hyperglykämie (Glucose > 250 mg/dl oder > 13,9 mmol/l) oder assoziiert mit einer Ketoazidose Hyperthyreose Grad ≥ 3 | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 − 1 gebessert haben* Bei Patienten mit Grad-3- oder Grad‑4‑Endokrinopathien, die sich auf Grad 2 oder weniger bessern und − falls angezeigt − mit Hormonsubstitution kontrolliert sind, kann eine Wiederaufnahme von Pembrolizumab nach Ausschleichen der Kortikosteroidbehandlung (falls benötigt) erwogen werden. Andernfalls sollte die Behandlung abgebrochen werden. | |
Hypothyreose | Hypothyreose kann mit Substitutionstherapie ohne Unterbrechung der Behandlung kontrolliert werden. | |
Hepatitis HINWEIS: | Grad 2 mit > 3- bis 5‑facher Erhöhung von Aspartataminotransferase (AST) oder Alaninaminotransferase (ALT) über dem oberen Normwert (ULN) oder > 1,5- bis 3‑fache Erhöhung von Gesamtbilirubin über dem oberen Normwert (ULN) | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 − 1 gebessert haben* |
Grad ≥ 3 mit > 5‑facher Erhöhung von AST oder ALT über dem oberen Normwert (ULN) oder > 3‑facher Erhöhung von Gesamtbilirubin über dem oberen Normwert (ULN) | dauerhaftes Absetzen | |
Bei Patienten mit Lebermetastasen mit einer Grad‑2‑Erhöhung von AST oder ALT zu Behandlungsbeginn; | dauerhaftes Absetzen | |
Hautreaktionen | Grad‑3‑ oder bei Verdacht auf Stevens-Johnson-Syndrom (SJS) oder toxische epidermale Nekrolyse (TEN) | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 − 1 gebessert haben* |
Grad‑4‑ oder bestätigte(s) SJS oder ‑TEN | dauerhaftes Absetzen | |
Andere immunvermittelte Nebenwirkungen | Je nach Schweregrad und Art der Nebenwirkung (Grad 2 oder Grad 3) | Unterbrechung bis sich die Nebenwirkungen auf Grad 0 − 1 gebessert haben* |
Grad-3- oder Grad-4-Myokarditis | dauerhaftes Absetzen | |
Grad 4 oder wiederholt Grad 3 | dauerhaftes Absetzen | |
Reaktionen im Zusammenhang mit einer Infusion | Grad 3 oder Grad 4 | dauerhaftes Absetzen |
Zur Beachtung: Die Toxizität/Schweregrade stimmen mit den „Allgemeinen Terminologie-Kriterien für Nebenwirkungen des US National Cancer Institute“ Version 4.0 [NCI-CTCAE v.4] überein. | ||
Die Sicherheit einer Wiederaufnahme der Therapie mit Pembrolizumab bei Patienten, die zuvor eine immunvermittelte Myokarditis hatten, ist nicht bekannt.
Die Behandlung mit KEYTRUDA als Monotherapie oder als Kombinationstherapie ist bei Grad‑4‑ oder wiederholt auftretenden Grad‑3‑immunvermittelten‑Nebenwirkungen dauerhaft abzusetzen, sofern in Tabelle 1 nicht anders festgelegt.
Bei Grad‑4‑hämatologischer‑Toxizität ist nur bei Patienten mit klassischem HL die Therapie mit KEYTRUDA bis zur Besserung der Nebenwirkungen auf Grad 0 − 1 zu unterbrechen.
KEYTRUDA in Kombination mit Axitinib bei RCC
Hinsichtlich der Dosierung von Axitinib im Rahmen der Behandlung von Patienten mit RCC mit KEYTRUDA in Kombination mit Axitinib, siehe die entsprechende SmPC von Axitinib. Bei Anwendung in Kombination mit Pembrolizumab kann eine Dosissteigerung von Axitinib über die Initialdosis von 5 mg hinaus in Intervallen von 6 Wochen oder länger in Betracht gezogen werden (siehe Abschnitt 5.1).
Bei Patienten mit RCC und Erhöhungen der Leberenzyme unter KEYTRUDA in Kombination mit Axitinib:
Falls ALT oder AST um ≥ 3-Fache, aber < 10-Fache des oberen Normwertes ohne gleichzeitige Erhöhung des Gesamtbilirubins um ≥ 2-Fache des oberen Normwertes erhöht sind, sollte die Behandlung sowohl mit KEYTRUDA als auch mit Axitinib bis zum Abklingen dieser Nebenwirkungen auf Grad 0 – 1 unterbrochen werden. Eine Kortikosteroidtherapie kann in Betracht gezogen werden. Nach Abklingen kann eine Wiederaufnahme der Therapie mit einem der beiden einzelnen Arzneimittel oder aufeinanderfolgend mit beiden erwogen werden. Bei Wiederaufnahme der Behandlung mit Axitinib kann eine Dosisreduktion entsprechend der Fachinformation von Axitinib in Betracht gezogen werden.
Falls ALT oder AST um ≥ 10-Fache, oder um > 3-Fache des oberen Normwertes mit gleichzeitiger Erhöhung des Gesamtbilirubins um ≥ 2-Fache des oberen Normwertes erhöht sind, sollten sowohl KEYTRUDA als auch Axitinib dauerhaft abgesetzt werden und eine Kortikosteroidtherapie kann in Betracht gezogen werden.
KEYTRUDA in Kombination mit Lenvatinib
Bei Anwendung in Kombination mit Lenvatinib sollte gegebenenfalls die Behandlung mit einem oder beiden Arzneimitteln unterbrochen werden. Lenvatinib sollte unterbrochen, die Dosis reduziert oder abgesetzt werden, entsprechend den Anweisungen zur Anwendung in Kombination mit Pembrolizumab in der SmPC von Lenvatinib. Dosisreduktionen von KEYTRUDA werden nicht empfohlen.
Patienten, die mit KEYTRUDA behandelt werden, müssen die Patientenkarte erhalten und müssen über die Risiken von KEYTRUDA informiert werden (siehe auch Packungsbeilage).
Besondere Patientengruppen
Ältere Patienten
Eine Dosisanpassung ist für Patienten ≥ 65 Jahre nicht erforderlich (siehe Abschnitte 4.4 und 5.1).
Eingeschränkte Nierenfunktion
Eine Dosisanpassung ist bei Patienten mit leichter oder moderater Einschränkung der Nierenfunktion nicht erforderlich. KEYTRUDA wurde bei Patienten mit schwerer Einschränkung der Nierenfunktion nicht untersucht (siehe Abschnitte 4.4 und 5.2).
Eingeschränkte Leberfunktion
Eine Dosisanpassung ist bei Patienten mit leichter oder moderater Einschränkung der Leberfunktion nicht erforderlich. KEYTRUDA wurde bei Patienten mit schwerer Einschränkung der Leberfunktion nicht untersucht (siehe Abschnitte 4.4 und 5.2).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von KEYTRUDA bei Kindern im Alter von unter 18 Jahren ist, außer bei Kindern und Jugendlichen mit Melanom oder klassischem HL, nicht erwiesen. Aktuell verfügbare Daten sind in den Abschnitten 4.8, 5.1 und 5.2 beschrieben.
Art der Anwendung
KEYTRUDA ist zur intravenösen Anwendung bestimmt. Es muss als Infusion über 30 Minuten gegeben werden. KEYTRUDA darf nicht als intravenöse Druck- oder Bolusinjektion gegeben werden.
Bei Gabe von KEYTRUDA als Teil einer Kombinationstherapie mit intravenöser Chemotherapie sollte KEYTRUDA zuerst gegeben werden.
Bei Gabe von KEYTRUDA als Teil einer Kombinationstherapie mit Enfortumab vedotin sollte KEYTRUDA nach Enfortumab vedotin gegeben werden, sofern die Gabe am selben Tag erfolgt.
Hinweise zur Verdünnung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Bestimmung des PD‑L1-Status
Bei der Bestimmung des PD‑L1-Status des Tumors ist es wichtig, eine entsprechend validierte und robuste Methode zu verwenden, um falsch-negative oder falsch-positive Bestimmungen zu minimieren.
Immunvermittelte Nebenwirkungen
Immunvermittelte Nebenwirkungen, einschließlich schwerer Fälle mit teils tödlichem Ausgang, traten bei Patienten unter Pembrolizumab auf. Die meisten immunvermittelten Nebenwirkungen, die während der Behandlung mit Pembrolizumab auftraten, waren reversibel und waren durch Unterbrechung der Therapie mit Pembrolizumab, Gabe von Kortikosteroiden und/oder unterstützende Maßnahmen beherrschbar. Immunvermittelte Nebenwirkungen traten auch nach Gabe der letzten Dosis Pembrolizumab auf. Immunvermittelte Nebenwirkungen können gleichzeitig in mehr als einem Organsystem auftreten.
Bei Verdacht auf immunvermittelte Nebenwirkungen sollte eine angemessene Abklärung zur Bestätigung der Ätiologie oder zum Ausschluss anderer Ursachen sichergestellt werden. Entsprechend des Schweregrades der Nebenwirkung sollte die Gabe von Pembrolizumab unterbrochen werden und Kortikosteroide gegeben werden. Bei Besserung auf Grad 1 oder weniger sollte mit der Reduktion der Kortikosteroid-Dosis begonnen und über mindestens einen Monat ausgeschlichen werden. Basierend auf limitierten Daten aus klinischen Studien mit Patienten, bei denen die immunvermittelten Nebenwirkungen nicht mit Kortikosteroiden kontrolliert werden konnten, kann die Gabe von anderen systemischen Immunsuppressiva erwogen werden.
Die Therapie mit Pembrolizumab kann innerhalb von 12 Wochen nach der letzten Dosis KEYTRUDA wieder aufgenommen werden, wenn sich die Nebenwirkung auf Grad 1 oder weniger bessert und die Kortikosteroid-Dosis auf ≤ 10 mg Prednison oder eines entsprechenden Äquivalents pro Tag reduziert wurde.
Pembrolizumab ist dauerhaft abzusetzen, falls eine weitere Episode jeglicher Grad‑3‑immunvermittelter-Nebenwirkung erneut auftritt oder bei Auftreten jeglicher Grad‑4‑immunvermittelter-Toxizität, außer es handelt sich um Endokrinopathien, die mit Hormonsubstitutionstherapie kontrolliert werden können (siehe Abschnitte 4.2 und 4.8).
Bei Patienten mit vorbestehender Autoimmunerkrankung (autoimmune disease, AID) deuten Daten aus Beobachtungsstudien darauf hin, dass das Risiko für immunvermittelte Nebenwirkungen nach einer Immun-Checkpoint-Inhibitor-Therapie im Vergleich zu Patienten ohne vorbestehende AID erhöht sein kann. Darüber hinaus traten häufig Schübe der zugrunde liegenden AID auf, die jedoch meist leicht und beherrschbar waren.
Immunvermittelte Pneumonitis
Pneumonitis wurde bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Patienten sollten auf Anzeichen und Symptome einer Pneumonitis überwacht werden. Ein bestehender Verdacht auf Pneumonitis sollte durch eine radiologische Untersuchung bestätigt und andere Ursachen sollten ausgeschlossen werden. Kortikosteroide sollten ab Grad ≥ 2 Ereignissen gegeben werden (Anfangsdosierung 1 − 2 mg/kg/Tag Prednison oder eines Äquivalents mit anschließendem Ausschleichen). Die Therapie mit Pembrolizumab sollte bei Grad‑2‑Pneumonitis unterbrochen und bei Grad‑3‑, Grad‑4‑ oder wiederholter Grad‑2‑Pneumonitis dauerhaft abgesetzt werden (siehe Abschnitt 4.2).
Immunvermittelte Kolitis
Kolitis wurde bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Patienten sollten auf Anzeichen und Symptome einer Kolitis überwacht und andere Ursachen ausgeschlossen werden. Kortikosteroide sollten ab Grad ≥ 2 Ereignissen gegeben werden (Anfangsdosierung 1 − 2 mg/kg/Tag Prednison oder eines Äquivalents mit anschließendem Ausschleichen). Die Therapie mit Pembrolizumab sollte bei Grad‑2‑ oder Grad‑3‑Kolitis unterbrochen und bei Grad‑4- oder wiederholt Grad‑3‑Kolitis dauerhaft abgesetzt werden (siehe Abschnitt 4.2). Das potenzielle Risiko einer gastrointestinalen Perforation sollte in Betracht gezogen werden.
Immunvermittelte Hepatitis
Hepatitis wurde bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Patienten sollten auf Abweichungen der Leberfunktion (zu Behandlungsbeginn, in regelmäßigen Abständen während der Behandlung und wenn bei entsprechender klinischer Bewertung angezeigt) und auf Anzeichen einer Hepatitis überwacht werden und andere Ursachen einer Hepatitis sollten ausgeschlossen werden. Kortikosteroide sollten mit einer Anfangsdosierung von 0,5 − 1 mg/kg/Tag Prednison oder eines Äquivalents bei Grad‑2‑Ereignissen und 1 − 2 mg/kg/Tag Prednison oder eines Äquivalents ab Grad ≥ 3 Ereignissen mit anschließendem Ausschleichen gegeben werden. Entsprechend des Schweregrads der Leberenzymerhöhung sollte die Therapie mit Pembrolizumab unterbrochen oder dauerhaft abgesetzt werden (siehe Abschnitt 4.2).
Immunvermittelte Nephritis
Nephritis wurde bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Patienten sollten auf Abweichungen der Nierenfunktion überwacht werden und andere Ursachen einer Nierenfunktionsstörung sollten ausgeschlossen werden. Kortikosteroide sollten ab Grad ≥ 2 Ereignissen gegeben werden (Anfangsdosierung 1 − 2 mg/kg/Tag Prednison oder eines Äquivalents mit anschließendem Ausschleichen). Entsprechend des Schweregrads der Serumkreatininerhöhung sollte die Therapie mit Pembrolizumab bei Grad‑2‑Nephritis unterbrochen und bei Grad‑3‑ oder Grad‑4‑Nephritis dauerhaft abgesetzt werden (siehe Abschnitt 4.2).
Immunvermittelte Endokrinopathien
Schwere Endokrinopathien einschließlich Nebenniereninsuffizienz, Hypophysitis, Diabetes mellitus Typ 1, diabetischer Ketoazidose, Hypothyreose und Hyperthyreose wurden unter Behandlung mit Pembrolizumab beobachtet.
Bei Fällen von immunvermittelten Endokrinopathien kann eine dauerhafte Hormonsubstitutionstherapie notwendig sein.
Nebenniereninsuffizienz (primäre und sekundäre) wurde bei Patienten unter Pembrolizumab berichtet. Hypophysitis wurde bei Patienten unter Pembrolizumab ebenfalls berichtet (siehe Abschnitt 4.8). Patienten sollten auf Anzeichen und Symptome einer Nebenniereninsuffizienz und einer Hypophysitis (einschließlich einer Unterfunktion der Hypophyse) überwacht und andere Ursachen sollten ausgeschlossen werden. Sofern klinisch indiziert, sollten Kortikosteroide zur Behandlung der Nebenniereninsuffizienz und andere Hormone zur Substitution gegeben werden. Die Therapie mit Pembrolizumab sollte bei Grad‑2‑Nebenniereninsuffizienz oder ‑Hypophysitis unterbrochen werden, bis diese mit Hormonsubstitutionstherapie unter Kontrolle ist. Bei Grad‑3‑ oder Grad‑4‑Nebenniereninsuffizienz oder symptomatischer Hypophysitis sollte Pembrolizumab unterbrochen oder dauerhaft abgesetzt werden. Eine Wiederaufnahme der Therapie mit Pembrolizumab kann nach Ausschleichen der Kortikosteroidtherapie, falls notwendig, erwogen werden (siehe Abschnitt 4.2). Die Hypophysenfunktion sowie die Hormonspiegel sollten überwacht werden, um eine angemessene Hormonsubstitution sicherzustellen.
Diabetes mellitus Typ 1, einschließlich diabetischer Ketoazidose, wurde bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Patienten sollten auf Hyperglykämie sowie auf andere Anzeichen und Symptome von Diabetes überwacht werden. Bei Diabetes Typ 1 sollte Insulin gegeben werden. Bei Fällen von Diabetes Typ 1 in Verbindung mit Grad ≥ 3 Hyperglykämie oder Ketoazidose sollte die Therapie mit Pembrolizumab unterbrochen werden, bis der Stoffwechsel unter Kontrolle ist (siehe Abschnitt 4.2).
Störungen der Schilddrüsenfunktion, einschließlich Hypothyreose, Hyperthyreose sowie Thyreoiditis, wurden bei Patienten unter Pembrolizumab berichtet und können zu jeder Zeit während der Behandlung auftreten. Hypothyreose wird bei Patienten mit HNSCC und vorheriger Strahlentherapie häufiger berichtet. Die Patienten sollten auf Änderungen der Schilddrüsenfunktion (zu Behandlungsbeginn, in regelmäßigen Abständen während der Behandlung und wenn bei entsprechender klinischer Bewertung angezeigt) und auf klinische Anzeichen und Symptome einer Erkrankung der Schilddrüse überwacht werden. Eine Hypothyreose kann mit einer Hormonsubstitutionstherapie behandelt werden und erfordert keine Therapieunterbrechung oder Kortikosteroidgabe. Eine Hyperthyreose kann symptomatisch behandelt werden. Pembrolizumab sollte bei Grad ≥ 3 Hyperthyreose bis zur Besserung auf Grad ≤ 1 unterbrochen werden. Die Schilddrüsenfunktion sowie die Hormonspiegel sollten überwacht werden, um eine angemessene Hormonsubstitution sicherzustellen.
Bei Patienten mit Grad‑3‑ oder Grad‑4‑Endokrinopathien, die sich auf Grad 2 oder weniger gebessert haben und die, falls angezeigt, mit Hormonsubstitutionstherapie unter Kontrolle sind, kann eine Wiederaufnahme der Therapie mit Pembrolizumab nach Ausschleichen der Kortikosteroidtherapie, falls notwendig, erwogen werden. Ansonsten sollte die Behandlung abgesetzt werden (siehe Abschnitte 4.2 und 4.8).
Immunvermittelte Nebenwirkungen an der Haut
Immunvermittelte schwere Hautreaktionen wurden bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Patienten sollten hinsichtlich verdächtiger schwerer Hautreaktionen überwacht werden und andere Ursachen schwerer Hautreaktionen sollten ausgeschlossen werden. Entsprechend des Schweregrads der Nebenwirkung sollte die Gabe von Pembrolizumab bei Grad‑3‑Hautreaktionen bis zur Besserung auf Grad ≤ 1 unterbrochen oder bei Grad‑4‑Hautreaktionen dauerhaft abgesetzt werden und Kortikosteroide sollten gegeben werden (siehe Abschnitt 4.2).
Fälle von Stevens-Johnson-Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN) wurden bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Bei Verdacht auf SJS oder TEN sollte die Gabe von Pembrolizumab unterbrochen und der Patient zur Beurteilung und Behandlung an eine entsprechende medizinische Fachabteilung überwiesen werden. Bei Bestätigung des Verdachts auf SJS oder TEN sollte Pembrolizumab dauerhaft abgesetzt werden (siehe Abschnitt 4.2).
Vorsicht ist geboten, wenn die Anwendung von Pembrolizumab bei einem Patienten in Betracht gezogen wird, bei dem bereits unter einer vorhergehenden Behandlung mit anderen immunstimulierenden Arzneimitteln zur Krebsbehandlung eine schwere oder lebensbedrohliche Nebenwirkung an der Haut auftrat.
Andere immunvermittelte Nebenwirkungen
Folgende weitere klinisch relevante immunvermittelte Nebenwirkungen wurden in klinischen Studien oder nach Markteinführung berichtet: Uveitis, Arthritis, Myositis, Myokarditis, Pankreatitis, Guillain-Barré-Syndrom, Myastheniesyndrom, hämolytische Anämie, Sarkoidose, Enzephalitis, Myelitis, Vaskulitis, sklerosierende Cholangitis, Gastritis, nicht-infektiöse Zystitis, Hypoparathyreoidismus und Perikarditis (siehe Abschnitte 4.2 und 4.8).
Entsprechend des Schweregrads und der Art der Nebenwirkung sollte die Therapie mit Pembrolizumab bei Grad‑2‑ oder Grad‑3‑Ereignissen unterbrochen und es sollten Kortikosteroide gegeben werden.
Die Therapie mit Pembrolizumab kann innerhalb von 12 Wochen nach der letzten Dosis KEYTRUDA wieder aufgenommen werden, wenn sich die Nebenwirkung auf Grad 1 oder weniger bessert und die Kortikosteroid-Dosis auf ≤ 10 mg Prednison oder eines entsprechenden Äquivalents pro Tag reduziert wurde.
Die Behandlung mit Pembrolizumab ist dauerhaft abzusetzen, wenn jegliche Grad‑3‑immunvermittelte-Nebenwirkung erneut auftritt und bei jeglicher Grad‑4‑immunvermittelter-Nebenwirkung.
Bei Grad‑3‑ oder Grad‑4‑Myokarditis, ‑Enzephalitis oder ‑Guillain‑Barré-Syndrom ist Pembrolizumab dauerhaft abzusetzen (siehe Abschnitte 4.2 und 4.8).
Nebenwirkungen in Verbindung mit einer Organtransplantation
Abstoßung von soliden Organtransplantaten
Bei mit PD-1-Inhibitoren behandelten Patienten wurde im Postmarketing-Umfeld eine Abstoßung von soliden Organtransplantaten beobachtet. Die Behandlung mit Pembrolizumab kann das Abstoßungsrisiko bei Empfängern solider Organtransplantate erhöhen. Bei diesen Patienten sollte der Nutzen der Behandlung mit Pembrolizumab gegen das Risiko einer möglichen Organabstoßung abgewogen werden.
Komplikationen bei allogenen hämatopoetischen Stammzelltransplantationen (allo-HSZT)
Allo-HSZT nach Behandlung mit Pembrolizumab
Bei Patienten mit klassischem HL, die sich nach einer vorangegangenen Therapie mit Pembrolizumab einer allogenen hämatopoetischen Stammzelltransplantation unterzogen, wurden Fälle von „Graft-versus-Host-Krankheit“ (GVHD) und Lebervenenverschlusskrankheit (veno‑occlusive disease, VOD) beobachtet. Bis weitere Daten zur Verfügung stehen, sollten der potenzielle Nutzen einer allo-HSZT und das potenziell erhöhte Risiko transplantationsbedingter Komplikationen von Fall zu Fall sorgfältig gegeneinander abgewogen werden (siehe Abschnitt 4.8).
Allo-HSZT vor Behandlung mit Pembrolizumab
Bei Patienten mit einer allo-HSZT in der Krankengeschichte wurde nach einer Behandlung mit Pembrolizumab akute GVHD, einschließlich GVHD mit tödlichem Ausgang, berichtet. Patienten mit einer GVHD nach ihrer Transplantation könnten ein erhöhtes Risiko für eine GVHD nach einer Behandlung mit Pembrolizumab haben. Der Nutzen einer Behandlung mit Pembrolizumab sollte gegen das Risiko einer möglichen GVHD bei Patienten mit einer allo-HSZT in der Krankengeschichte abgewogen werden.
Reaktionen im Zusammenhang mit einer Infusion
Schwere Reaktionen im Zusammenhang mit einer Infusion, einschließlich Überempfindlichkeitsreaktionen und Anaphylaxie, wurden bei Patienten unter Pembrolizumab berichtet (siehe Abschnitt 4.8). Die Infusion sollte bei Grad‑3‑ oder Grad‑4‑Infusionsreaktionen gestoppt und Pembrolizumab dauerhaft abgesetzt werden (siehe Abschnitt 4.2). Patienten mit Grad‑1‑ oder Grad‑2‑Reaktion auf die Infusion können Pembrolizumab unter engmaschiger Überwachung weiter erhalten; eine Prämedikation mit Antipyretika und Antihistaminika kann erwogen werden.
Anwendung von Pembrolizumab in Kombination mit Chemotherapie
Bei Patienten ≥ 75 Jahre sollte Pembrolizumab in Kombination mit Chemotherapie mit Vorsicht nach sorgfältiger Abwägung des potenziellen Nutzen-Risiko-Verhältnisses im individuellen Einzelfall angewendet werden (siehe Abschnitt 5.1).
Erkrankungsspezifische Vorsichtsmaßnahmen
Anwendung von Pembrolizumab bei Patienten mit Urothelkarzinom nach vorheriger Platin-basierter Therapie
Ärzte sollten vor Beginn der Behandlung von Patienten mit schlechterer Prognose und/oder mit aggressivem Krankheitsverlauf das verzögerte Einsetzen der Wirkung von Pembrolizumab beachten. Bei Urothelkarzinom wurde unter Pembrolizumab im Vergleich zu Chemotherapie eine höhere Anzahl von Todesfällen innerhalb von 2 Monaten beobachtet (siehe Abschnitt 5.1). Die mit frühzeitigem Versterben assoziierten Faktoren waren ein schnelles Fortschreiten der Krebserkrankung unter vorheriger Platin-basierter Chemotherapie sowie Lebermetastasen.
Anwendung von Pembrolizumab bei Patienten mit Urothelkarzinom, die als nicht für eine Cisplatin-basierte Therapie geeignet gelten und deren Tumoren PD‑L1 mit einem CPS ≥ 10 exprimieren
Entsprechend der Baselinecharakteristika und der prognostischen Charakteristika der Erkrankung der Studienpopulation von KEYNOTE‑052 war ein Teil der Patienten für eine Carboplatin-basierte Kombinationstherapie geeignet; der Nutzen für diese Patienten wurde in einer Vergleichsstudie (KEYNOTE-361) untersucht. In KEYNOTE-361 wurde innerhalb der ersten 6 Monate nach Therapiebeginn unter einer Pembrolizumab-Monotherapie im Vergleich zu Chemotherapie eine höhere Anzahl an Todesfällen, gefolgt von einem Langzeitüberlebensvorteil, beobachtet (siehe Abschnitt 5.1). Spezifische, mit den frühen Todesfällen assoziierte Faktoren konnten nicht identifiziert werden. Ärzte sollten vor Beginn der Behandlung von Patienten mit Urothelkarzinom, die für eine Kombinationschemotherapie mit Carboplatin geeignet sind, den verzögerten Wirkungseintritt von Pembrolizumab berücksichtigen. KEYNOTE-052 schloss darüber hinaus Patienten ein, die für eine Mono-Chemotherapie geeignet waren. Zu dieser Patientengruppe stehen keine randomisierten Daten zur Verfügung. Außerdem liegen keine Daten hinsichtlich Sicherheit und Wirksamkeit bei gebrechlicheren Patienten (z. B. ECOG-Performance-Status 3), die als nicht für eine Chemotherapie geeignet gelten, vor. In Ermangelung dieser Daten sollte Pembrolizumab mit Vorsicht bei dieser Population und nur nach sorgfältiger Abwägung des potenziellen individuellen Nutzen-Risikoprofils angewendet werden.
Anwendung von Pembrolizumab zur Erstlinienbehandlung bei Patienten mit NSCLC
Im Allgemeinen treten Nebenwirkungen unter einer Pembrolizumab‑Kombinationstherapie häufiger auf als unter einer Pembrolizumab‑Monotherapie oder unter einer Chemotherapie allein, da alle Komponenten dazu beitragen (siehe Abschnitte 4.2 und 4.8). Ein direkter Vergleich zwischen der Anwendung von Pembrolizumab in Kombination mit Chemotherapie und einer Pembrolizumab-Monotherapie steht nicht zur Verfügung.
Ärzte sollten das Nutzen-Risiko-Verhältnis der verfügbaren Behandlungsoptionen (Pembrolizumab als Monotherapie oder Pembrolizumab in Kombination mit Chemotherapie) vor Beginn einer Behandlung nicht-vorbehandelter Patienten mit NSCLC, deren Tumoren PD‑L1 exprimieren, abwägen.
In KEYNOTE-042 wurde innerhalb der ersten 4 Monate nach Therapiebeginn einer Pembrolizumab-Monotherapie im Vergleich zu Chemotherapie eine erhöhte Anzahl an Todesfällen, gefolgt von einem Langzeitüberlebensvorteil, beobachtet (siehe Abschnitt 5.1).
Anwendung von Pembrolizumab zur Erstlinienbehandlung bei Patienten mit HNSCC
Im Allgemeinen treten Nebenwirkungen unter einer Pembrolizumab‑Kombinationstherapie häufiger auf als unter einer Pembrolizumab‑Monotherapie oder unter einer Chemotherapie allein, da alle Komponenten dazu beitragen (siehe Abschnitt 4.8).
Ärzte sollten das Nutzen-Risiko-Verhältnis der verfügbaren Behandlungsoptionen (Pembrolizumab als Monotherapie oder Pembrolizumab in Kombination mit Chemotherapie) vor Beginn einer Behandlung von Patienten mit HNSCC, deren Tumoren PD‑L1 exprimieren, abwägen (siehe Abschnitt 5.1).
Anwendung von Pembrolizumab zur Behandlung bei Patienten mit fortgeschrittenem oder rezidivierendem MSI-H- oder dMMR-Endometriumkarzinom
Ein direkter Vergleich zwischen der Anwendung von Pembrolizumab in Kombination mit Lenvatinib und einer Pembrolizumab-Monotherapie steht nicht zur Verfügung. Ärzte sollten das Nutzen-Risiko-Verhältnis der verfügbaren Behandlungsoptionen (Pembrolizumab‑Monotherapie oder Pembrolizumab in Kombination mit Lenvatinib) vor Beginn einer Behandlung von Patienten mit fortgeschrittenem oder rezidivierendem MSI‑H- oder dMMR-Endometriumkarzinom abwägen.
Anwendung von Pembrolizumab zur adjuvanten Behandlung bei Patienten mit Melanom
Bei Patienten ≥ 75 Jahre wurde eine Tendenz zu einem häufigeren Auftreten schwerer und schwerwiegender Nebenwirkungen beobachtet. Die Daten hinsichtlich Sicherheit bei Patienten ≥ 75 Jahre im Rahmen einer adjuvanten Behandlung des Melanoms sind begrenzt.
Anwendung von Pembrolizumab in Kombination mit Axitinib zur Erstlinienbehandlung bei Patienten mit Nierenzellkarzinom (RCC)
Bei Gabe von Pembrolizumab mit Axitinib wurden bei Patienten mit fortgeschrittenem RCC häufiger als erwartet ALT- und AST-Erhöhungen mit Grad 3 und Grad 4 berichtet (siehe Abschnitt 4.8). Die Leberenzymwerte sollten vor Behandlungsbeginn und in regelmäßigen Abständen während der Behandlung überwacht werden. Im Vergleich zu einer Anwendung der Arzneimittel als Monotherapie kann eine häufigere Überwachung der Leberenzyme erwogen werden. Die Vorgaben zum Therapiemanagement für beide Arzneimittel sind zu beachten (siehe Abschnitt 4.2 sowie die Fachinformation von Axitinib).
Anwendung von Pembrolizumab zur Erstlinienbehandlung bei Patienten mit MSI-H-/dMMR-CRC
In KEYNOTE-177 waren innerhalb der ersten 4 Monate nach Therapiebeginn unter Pembrolizumab im Vergleich zu Chemotherapie die Hazardraten für das Gesamtüberleben höher, gefolgt von einem Langzeitüberlebensvorteil unter Pembrolizumab (siehe Abschnitt 5.1).
Anwendung von Pembrolizumab zur Erstlinienbehandlung bei Patienten mit BTC
Cholangitis und Gallengangsentzündungen sind nicht ungewöhnlich bei Patienten mit BTC. In KEYNOTE-966 wurde in beiden Behandlungsarmen über das Auftreten von Cholangitis berichtet (11,2 % [n = 59] bei Studienteilnehmern im Pembrolizumab-plus-Chemotherapie-Arm bzw. 10,3 % [n = 55] bei Studienteilnehmern im Placebo-plus-Chemotherapie-Arm). Patienten mit biliären Stents und Drainagen (n = 74) hatten in KEYNOTE-966 ein erhöhtes Risiko für Cholangitis und Gallengangsentzündungen (39,4 % [n = 13] bei Studienteilnehmern im Pembrolizumab-plus-Chemotherapie-Arm vs. 29,3 % [n = 12] bei Studienteilnehmern im Placebo-plus-Chemotherapie-Arm). Patienten mit BTC (insbesondere diejenigen mit biliären Stents) sollen vor Beginn der Behandlung und regelmäßig im Anschluss daran engmaschig hinsichtlich der Entwicklung von Cholangitis oder Gallengangsentzündungen überwacht werden.
Von klinischen Studien ausgeschlossene Patienten
Patienten mit folgenden Erkrankungen waren von den klinischen Studien ausgeschlossen: aktiven ZNS-Metastasen; Patienten mit ECOG-Performance-Status ≥ 2 (außer bei Urothelkarzinom und RCC); HIV-Infektion, Hepatitis‑B- oder Hepatitis‑C-Infektion (außer bei BTC); aktiven, systemischen Autoimmunerkrankungen; interstitieller Lungenkrankheit; einer früheren Pneumonitis, die eine systemische Kortikosteroidbehandlung erforderte; schwerer Überempfindlichkeit gegen einen anderen monoklonalen Antikörper in der Anamnese; laufender Therapie mit Immunsuppressiva sowie Patienten mit schweren immunvermittelten Nebenwirkungen unter Ipilimumab in der Anamnese, definiert als jegliche Grad‑4‑ oder Grad‑3‑Toxizität, die eine Kortikosteroid-Behandlung über mehr als 12 Wochen erforderte (mehr als 10 mg/Tag Prednison oder eines Äquivalents in entsprechender Dosierung). Patienten mit aktiven Infektionserkrankungen wurden von den klinischen Studien ausgeschlossen und mussten ihre Infektion behandeln lassen, bevor sie mit Pembrolizumab behandelt werden konnten. Patienten, bei denen während der Behandlung mit Pembrolizumab aktive Infektionen auftraten, erhielten eine adäquate medizinische Behandlung. Patienten mit klinisch relevanten Abweichungen der Nierenfunktion (> 1,5‑fachen Erhöhung von Serumkreatinin über dem oberen Normwert (ULN)) oder Leberfunktion (> 1,5‑fachen Erhöhung von Bilirubin über dem oberen Normwert (ULN); > 2,5‑fachen Erhöhung von ALT oder AST über dem oberen Normwert (ULN) ohne Vorliegen von Lebermetastasen) vor Behandlungsbeginn waren von den klinischen Studien ausgeschlossen. Daher liegen nur begrenzte Daten bei Patienten mit schwerer Einschränkung der Nierenfunktion und bei Patienten mit moderater bis schwerer Einschränkung der Leberfunktion vor.
Bei Patienten mit Melanom des Auges stehen limitierte Daten zur Sicherheit und Wirksamkeit von KEYTRUDA zur Verfügung (siehe Abschnitt 5.1).
Diese Patientengruppen können mit Pembrolizumab unter adäquater medizinischer Therapie behandelt werden, nach sorgfältiger Abwägung des möglicherweise erhöhten Risikos.
Patientenkarte
Jeder Arzt, der KEYTRUDA verordnet, muss mit der Fachinformation und den Vorgaben zur Behandlung vertraut sein. Der verordnende Arzt muss die Risiken einer Therapie mit KEYTRUDA mit dem Patienten besprechen. Die Patientenkarte wird dem Patienten bei jeder Verordnung zur Verfügung gestellt.
Es wurden keine formalen pharmakokinetischen Wechselwirkungsstudien mit Pembrolizumab durchgeführt. Da Pembrolizumab durch katabolischen Abbau aus dem Blutkreislauf eliminiert wird, sind keine Wechselwirkungen mit anderen Arzneimitteln zu erwarten.
Eine systemische Anwendung von Kortikosteroiden oder Immunsuppressiva vor Therapiebeginn mit Pembrolizumab sollte aufgrund möglicher Beeinträchtigungen der pharmakodynamischen Aktivität und der Wirksamkeit von Pembrolizumab vermieden werden. Systemische Kortikosteroide oder andere Immunsuppressiva können jedoch nach Beginn der Therapie mit Pembrolizumab zur Behandlung von immunvermittelten Nebenwirkungen angewendet werden (siehe Abschnitt 4.4). Kortikosteroide können ebenfalls als Prämedikation zur antiemetischen Prophylaxe und/oder Linderung von chemotherapiebedingten Nebenwirkungen gegeben werden, wenn Pembrolizumab in Kombination mit Chemotherapie angewendet wird.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung mit Pembrolizumab und noch mindestens vier Monate nach der letzten Dosis von Pembrolizumab eine zuverlässige Verhütungsmethode anwenden.
Schwangerschaft
Daten zur Anwendung von Pembrolizumab bei Schwangeren liegen nicht vor. Reproduktionsstudien bei Tieren wurden mit Pembrolizumab nicht durchgeführt; bei Modellen mit trächtigen Mäusen wurde jedoch gezeigt, dass die Blockierung des PD‑L1-Signalwegs die feto-maternale Toleranz stört und zu einer Erhöhung der Abortrate führt (siehe Abschnitt 5.3). Diese Ergebnisse deuten auf ein potenzielles Risiko, dass die Gabe von Pembrolizumab während der Schwangerschaft, basierend auf dem Wirkmechanismus, eine fötale Beeinträchtigung, einschließlich erhöhter Abort- und Totgeburtsraten, verursachen kann. Es ist bekannt, dass humane Immunglobuline vom G4-Typ (IgG4) plazentagängig sind. Daher besteht die Möglichkeit, dass Pembrolizumab, als IgG4-Antikörper, von der Mutter auf den sich entwickelnden Fötus übertragen werden kann. Pembrolizumab sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der klinische Zustand der Frau erfordert eine Behandlung mit Pembrolizumab.
Stillzeit
Es ist nicht bekannt, ob Pembrolizumab in die Muttermilch übergeht. Da Antikörper bekanntlich in die Muttermilch übergehen können, kann ein Risiko für das Neugeborene bzw. den Säugling nicht ausgeschlossen werden. Eine Entscheidung muss darüber getroffen werden, ob das Stillen zu unterbrechen ist, oder ob auf die Behandlung mit Pembrolizumab verzichtet werden soll/die Behandlung mit Pembrolizumab zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie mit Pembrolizumab für die stillende Patientin zu berücksichtigen.
Fertilität
Es sind keine klinischen Daten über mögliche Auswirkungen von Pembrolizumab auf die Fertilität verfügbar. Bei einer 1‑Monats- und einer 6‑Monats-Studie zur Toxizität bei wiederholter Gabe bei Affen wurden keine beachtenswerten Wirkungen auf männliche und weibliche Reproduktionsorgane beobachtet (siehe Abschnitt 5.3).
Pembrolizumab hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Bei einigen Patienten wurde nach Gabe von Pembrolizumab über Schwindelgefühl und Ermüdung/Fatigue berichtet (siehe Abschnitt 4.8).
Zusammenfassung des Sicherheitsprofils
Pembrolizumab ist am häufigsten mit immunvermittelten Nebenwirkungen assoziiert. Die meisten dieser Nebenwirkungen, einschließlich schwerer Reaktionen, klangen nach Einleitung einer adäquaten medizinischen Behandlung oder nach Absetzen von Pembrolizumab ab (siehe unten „Beschreibung ausgewählter Nebenwirkungen“). Die unten und in Tabelle 2 aufgeführten Häufigkeiten basieren auf allen berichteten Nebenwirkungen, ungeachtet der Einschätzung eines Kausalzusammenhangs seitens des Prüfarztes.
Pembrolizumab als Monotherapie (siehe Abschnitt 4.2)
Die Sicherheit von Pembrolizumab als Monotherapie wurde bei 7 631 Patienten mit verschiedenen Tumorarten und über vier Dosierungen (2 mg/kg KG alle 3 Wochen, 200 mg alle 3 Wochen oder 10 mg/kg KG alle 2 oder 3 Wochen) in klinischen Studien untersucht. In dieser Patientenpopulation betrug die mediane Beobachtungszeit 8,5 Monate (Spanne: 1 Tag bis 39 Monate) und die häufigsten Nebenwirkungen unter Pembrolizumab waren Ermüdung/Fatigue (31 %), Diarrhö (22 %) und Übelkeit (20 %). Die Mehrheit der berichteten Nebenwirkungen unter Monotherapie entsprach Schweregrad 1 oder 2. Die schwerwiegendsten Nebenwirkungen waren immunvermittelte Nebenwirkungen und schwere Reaktionen im Zusammenhang mit einer Infusion (siehe Abschnitt 4.4). Unter Pembrolizumab-Monotherapie im adjuvanten Setting betrug die Inzidenz immunvermittelter Nebenwirkungen 37 % jeglichen Schweregrades, davon 9 % Grad 3 – 5 und im metastasierten Setting 25 % jeglichen Schweregrades, davon 6 % Grad 3 – 5. Unter adjuvanter Behandlung wurden keine neuen immunvermittelten Nebenwirkungen identifiziert.
Pembrolizumab in Kombination mit Chemotherapie oder Radiochemotherapie (chemoradiotherapy, CRT) (siehe Abschnitt 4.2)
Bei Anwendung von Pembrolizumab in Kombination sind die SmPCs der jeweiligen Komponente der begleitenden Therapeutika vor Behandlungsbeginn zu berücksichtigen.
Die Sicherheit von Pembrolizumab in einer Dosierung von 200 mg, 2 mg/kg KG oder 10 mg/kg KG alle 3 Wochen in Kombination mit Chemotherapie oder CRT wurde im Rahmen klinischer Studien bei 6 334 Patienten mit verschiedenen Tumorarten untersucht. Bei dieser Patientenpopulation waren die häufigsten Nebenwirkungen Übelkeit (52 %), Anämie (51 %), Ermüdung/Fatigue (36 %), Diarrhö (35 %), Obstipation (32 %), Erbrechen (28 %), Verringerung der Anzahl der Neutrophilen (27 %) und verminderter Appetit (27 %). Die Häufigkeit von Nebenwirkungen mit Schweregrad 3 – 5 betrug bei Patienten mit NSCLC 69 % unter einer Pembrolizumab-Kombinationstherapie und 61 % unter alleiniger Chemotherapie, bei Patienten mit HNSCC 85 % unter einer Pembrolizumab-Kombinationstherapie und 84 % unter Chemotherapie in Kombination mit Cetuximab, bei Patienten mit Ösophaguskarzinom 86 % unter einer Pembrolizumab-Kombinationstherapie und 83 % unter alleiniger Chemotherapie, bei Patienten mit TNBC 80 % unter einer Pembrolizumab-Kombinationstherapie und 77 % unter alleiniger Chemotherapie, bei Patienten mit Zervixkarzinom 77 % unter einer Pembrolizumab-Kombinationstherapie (Chemotherapie mit oder ohne Bevacizumab oder in Kombination mit CRT) und 71 % unter Chemotherapie, mit oder ohne Bevacizumab oder unter alleiniger CRT, bei Patienten mit Magenkarzinom 74 % unter Pembrolizumab-Kombinationstherapie (Chemotherapie mit oder ohne Trastuzumab) und 68 % unter Chemotherapie mit oder ohne Trastuzumab, bei Patienten mit biliärem Karzinom 85 % unter einer Pembrolizumab-Kombinationstherapie und 84 % unter alleiniger Chemotherapie, bei Patienten mit Endometriumkarzinom 59 % unter einer Pembrolizumab-Kombinationstherapie und 46 % unter alleiniger Chemotherapie und bei Patienten mit malignem Pleuramesotheliom 44 % unter einer Pembrolizumab-Kombinationstherapie und 30 % unter alleiniger Chemotherapie.
Pembrolizumab in Kombination mit einem Tyrosinkinase-Inhibitor (TKI) (siehe Abschnitt 4.2)
Bei Anwendung von Pembrolizumab in Kombination mit Axitinib oder Lenvatinib ist vor Behandlungsbeginn die SmPC von Axitinib bzw. Lenvatinib zu berücksichtigen. Weitere Sicherheitshinweise zu Lenvatinib im Zusammenhang mit fortgeschrittenem RCC finden Sie in der SmPC von „Kisplyx“ und zu fortgeschrittenem EC in der SmPC von „Lenvima“. Zusätzliche Sicherheitshinweise zu Axitinib bei erhöhten Leberenzymwerten finden Sie auch in Abschnitt 4.4.
Die Sicherheit von Pembrolizumab in Kombination mit Axitinib oder Lenvatinib bei fortgeschrittenem RCC sowie in Kombination mit Lenvatinib bei fortgeschrittenem EC wurde bei insgesamt 1 456 Patienten mit fortgeschrittenem RCC oder fortgeschrittenem EC, die in klinischen Studien 200 mg Pembrolizumab alle 3 Wochen mit – wie jeweils angemessen – entweder Axitinib 5 mg zweimal/Tag oder Lenvatinib 20 mg einmal/Tag erhielten, untersucht. Bei diesen Patientengruppen waren die häufigsten Nebenwirkungen Diarrhö (58 %), Hypertonie (54 %), Hypothyreose (46 %), Ermüdung/Fatigue (41 %), verminderter Appetit (40 %), Übelkeit (40 %), Arthralgie (30 %), Erbrechen (28 %), Gewichtsverlust (28 %), Dysphonie (28 %), Abdominalschmerzen (28 %), Proteinurie (27 %), palmar-plantares Erythrodysästhesie-Syndrom (26 %), Ausschlag (26 %), Stomatitis (25 %), Obstipation (25 %), Schmerzen des Muskel- und Skelettsystems (23 %), Kopfschmerzen (23 %) und Husten (21 %). Nebenwirkungen mit Schweregrad 3 – 5 traten bei 80 % der Patienten mit RCC unter Pembrolizumab in Kombination mit entweder Axitinib oder Lenvatinib und bei 71 % der Patienten unter Sunitinib-Monotherapie auf. Bei Patienten mit EC traten Nebenwirkungen mit Schweregrad 3 – 5 bei 89 % unter Pembrolizumab in Kombination mit Lenvatinib und bei 73 % unter alleiniger Chemotherapie auf.
Tabellarische Zusammenfassung der Nebenwirkungen
In Tabelle 2 sind die Nebenwirkungen gelistet, die unter der Behandlung mit Pembrolizumab als Monotherapie oder in Kombination mit einer Chemotherapie oder CRT oder anderen antitumoralen Arzneimitteln im Rahmen der klinischen Studien beobachtet oder nach Markteinführung berichtet wurden. Die Nebenwirkungen sind nach Systemorganklasse und Häufigkeit aufgelistet. Häufigkeiten sind wie folgt definiert: sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1 000, < 1/100); selten (≥ 1/10 000, < 1/1 000); sehr selten (< 1/10 000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen nach abnehmendem Schweregrad aufgeführt. Nebenwirkungen, deren Auftreten unter alleiniger Gabe von Pembrolizumab oder einer Komponente einer Kombinationstherapie bekannt ist, können ebenfalls während der Kombinationsbehandlung auftreten, auch wenn diese Nebenwirkungen in klinischen Studien unter der Kombinationstherapie nicht berichtet wurden.
Weitere Sicherheitshinweise zur Anwendung von Pembrolizumab in Kombinationstherapie finden Sie in der SmPC der jeweiligen Komponente der Kombinationstherapie.
Tabelle 2: Nebenwirkungen bei Patienten unter Behandlung mit Pembrolizumab†
MedDRA SOC und Häufigkeitskategorie | Monotherapie | In Kombination mit Chemotherapie oder Radiochemotherapie | In Kombination mit Axitinib oder Lenvatinib |
Infektionen und parasitäre Erkrankungen | |||
Sehr häufig | Harnwegsinfektionen | ||
Häufig | Pneumonie | Pneumonie | Pneumonie |
Erkrankungen des Blutes und des Lymphsystems | |||
Sehr häufig | Anämie | Anämie, Neutropenie, Thrombozytopenie | Anämie |
Häufig | Thrombozytopenie, Neutropenie, Lymphopenie | Febrile Neutropenie, Leukopenie, Lymphopenie | Neutropenie, Thrombozytopenie, Lymphopenie, Leukopenie |
Gelegentlich | Leukopenie, Immunthrombozytopenie, Eosinophilie | Hämolytische Anämie⁎, Eosinophilie | Eosinophilie |
Selten | Hämolytische Anämie⁎, hämophagozytische Lymphohistiozytose, isolierte aplastische Anämie | Immunthrombozytopenie | |
Erkrankungen des Immunsystems | |||
Häufig | Reaktionen im Zusammenhang mit einer Infusion⁎ | Reaktionen im Zusammenhang mit einer Infusion⁎ | Reaktionen im Zusammenhang mit einer Infusion⁎ |
Gelegentlich | Sarkoidose⁎ | ||
Selten | Sarkoidose | ||
Nicht bekannt | Abstoßung eines soliden Organtransplantats | ||
Endokrine Erkrankungen | |||
Sehr häufig | Hypothyreose⁎ | Hypothyreose⁎ | Hypothyreose |
Häufig | Hyperthyreose | Nebenniereninsuffizienz⁎, Hyperthyreose⁎, Thyreoiditis⁎ | Nebenniereninsuffizienz⁎, Hyperthyreose, Thyreoiditis⁎ |
Gelegentlich | Nebenniereninsuffizienz⁎, Hypophysitis⁎, Thyreoiditis⁎ | Hypophysitis⁎ | Hypophysitis⁎ |
Selten | Hypoparathyreoidismus | Hypoparathyreoidismus | Hypoparathyreoidismus |
Stoffwechsel- und Ernährungsstörungen | |||
Sehr häufig | Verminderter Appetit | Hypokaliämie, verminderter Appetit | Verminderter Appetit |
Häufig | Hyponatriämie, Hypokaliämie, Hypokalzämie | Hyponatriämie, Hypokalzämie | Hyponatriämie, Hypokaliämie, Hypokalzämie |
Gelegentlich | Diabetes mellitus Typ 1⁎ | Diabetes mellitus Typ 1⁎ | Diabetes mellitus Typ 1⁎ |
Psychiatrische Erkrankungen | |||
Sehr häufig | Schlaflosigkeit | ||
Häufig | Schlaflosigkeit | Schlaflosigkeit | |
Erkrankungen des Nervensystems | |||
Sehr häufig | Kopfschmerzen | Periphere Neuropathie, Kopfschmerzen, Schwindelgefühl | Kopfschmerzen, Dysgeusie |
Häufig | Schwindelgefühl, periphere Neuropathie, Lethargie, Dysgeusie | Dysgeusie | Schwindelgefühl, periphere Neuropathie, Lethargie |
Gelegentlich | Myastheniesyndrom⁎, Epilepsie | Enzephalitis⁎, Epilepsie, Lethargie | Myastheniesyndrom⁎, Enzephalitis⁎ |
Selten | Guillain-Barré-Syndrom⁎, Enzephalitis⁎, Myelitis⁎, Optikusneuritis, Meningitis (aseptisch)⁎ | Myastheniesyndrom⁎, Guillain-Barré-Syndrom⁎, Myelitis, Optikusneuritis, Meningitis (aseptisch) | Optikusneuritis |
Augenerkrankungen | |||
Häufig | Trockene Augen | Trockene Augen | Trockene Augen |
Gelegentlich | Uveitis⁎ | Uveitis⁎ | Uveitis⁎ |
Selten | Vogt-Koyanagi-Harada-Syndrom | Vogt-Koyanagi-Harada-Syndrom | |
Herzerkrankungen | |||
Häufig | Kardiale Arrhythmie‡ (einschl. Vorhofflimmern) | Kardiale Arrhythmie‡ (einschl. Vorhofflimmern) | Kardiale Arrhythmie‡ (einschl. Vorhofflimmern) |
Gelegentlich | Myokarditis, Perikarditis⁎, Perikarderguss | Myokarditis⁎, Perikarditis⁎, Perikarderguss | Myokarditis, Perikarderguss |
Gefäßerkrankungen | |||
Sehr häufig | Hypertonie | ||
Häufig | Hypertonie | Hypertonie | |
Gelegentlich | Vaskulitis⁎ | Vaskulitis⁎ | |
Selten | Vaskulitis⁎ | ||
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |||
Sehr häufig | Dyspnoe, Husten | Dyspnoe, Husten | Dyspnoe, Husten |
Häufig | Pneumonitis⁎ | Pneumonitis⁎ | Pneumonitis⁎ |
Erkrankungen des Gastrointestinaltrakts | |||
Sehr häufig | Diarrhö, Abdominalschmerzen⁎, Übelkeit, Erbrechen, Obstipation | Diarrhö, Übelkeit, Erbrechen, Abdominalschmerzen⁎, Obstipation | Diarrhö, Abdominalschmerzen⁎, Übelkeit, Erbrechen, Obstipation |
Häufig | Kolitis⁎, Mundtrockenheit | Kolitis⁎, Gastritis⁎, Mundtrockenheit | Kolitis⁎, Pankreatitis⁎, Gastritis⁎, Mundtrockenheit |
Gelegentlich | Pankreatitis⁎, Gastritis⁎, gastrointestinale Ulzeration⁎ | Pankreatitis⁎, gastrointestinale Ulzeration⁎ | Gastrointestinale Ulzeration⁎ |
Selten | Exokrine Pankreasinsuffizienz, Dünndarmperforation, Zöliakie | Exokrine Pankreasinsuffizienz, Dünndarmperforation, Zöliakie | Dünndarmperforation |
Nicht bekannt | Exokrine Pankreasinsuffizienz, Zöliakie | ||
Leber- und Gallenerkrankungen | |||
Häufig | Hepatitis⁎ | Hepatitis⁎ | Hepatitis⁎ |
Selten | Sklerosierende Cholangitis | Sklerosierende Cholangitis⁎ | |
Erkrankungen der Haut und des Unterhautgewebes | |||
Sehr häufig | Pruritus⁎, Ausschlag⁎ | Ausschlag⁎, Alopezie, Pruritus⁎ | Ausschlag⁎, Pruritus⁎ |
Häufig | Schwere Hautreaktionen⁎, Erythem, Dermatitis, trockene Haut, Vitiligo⁎, Ekzem, Alopezie, akneiforme Dermatitis | Schwere Hautreaktionen⁎, Dermatitis, Erythem, trockene Haut, akneiforme Dermatitis, Ekzem | Schwere Hautreaktionen⁎, Dermatitis, trockene Haut, Erythem, akneiforme Dermatitis, Alopezie |
Gelegentlich | Psoriasis, lichenoide Keratose⁎, Papeln, Änderungen der Haarfarbe | Psoriasis, lichenoide Keratose⁎, Vitiligo⁎, Papeln | Ekzem, lichenoide Keratose⁎, Psoriasis, Vitiligo⁎, Papeln, Änderungen der Haarfarbe |
Selten | Stevens-Johnson-Syndrom, Erythema nodosum, toxische epidermale Nekrolyse | Stevens-Johnson-Syndrom, Erythema nodosum, Änderungen der Haarfarbe | Toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |||
Sehr häufig | Schmerzen des Muskel- und Skelettsystems⁎, Arthralgie | Schmerzen des Muskel- und Skelettsystems⁎, Arthralgie | Arthralgie, Schmerzen des Muskel- und Skelettsystems⁎, Myositis⁎, Schmerzen in den Extremitäten |
Häufig | Myositis⁎, Schmerzen in den Extremitäten, Arthritis⁎ | Myositis⁎, Schmerzen in den Extremitäten, Arthritis⁎ | Arthritis⁎ |
Gelegentlich | Tendosynovitis⁎ | Tendosynovitis⁎ | Tendosynovitis⁎ |
Selten | Sjögren-Syndrom | Sjögren-Syndrom | Sjögren-Syndrom |
Erkrankungen der Nieren und Harnwege | |||
Häufig | Akutes Nierenversagen | Nephritis⁎ | |
Gelegentlich | Nephritis⁎ | Nephritis⁎, nicht-infektiöse Zystitis | |
Selten | Nicht-infektiöse Zystitis | Nicht-infektiöse Zystitis | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |||
Sehr häufig | Ermüdung/Fatigue, Asthenie, Ödeme⁎, Fieber | Ermüdung/Fatigue, Asthenie, Fieber, Ödeme⁎ | Ermüdung/Fatigue, Asthenie, Ödeme⁎, Fieber |
Häufig | Grippeähnliche Erkrankung, Schüttelfrost | Grippeähnliche Erkrankung, Schüttelfrost | Grippeähnliche Erkrankung, Schüttelfrost |
Untersuchungen | |||
Sehr häufig | Alaninaminotransferase (ALT) erhöht, Aspartataminotransferase (AST) erhöht | Lipase erhöht, Alaninaminotransferase (ALT) erhöht, Aspartataminotransferase (AST) erhöht, Kreatinin im Blut erhöht | |
Häufig | Alaninaminotransferase (ALT) erhöht, Aspartataminotransferase (AST) erhöht, alkalische Phosphatase im Blut erhöht, Hyperkalzämie, Bilirubin im Blut erhöht, Kreatinin im Blut erhöht | Bilirubin im Blut erhöht, alkalische Phosphatase im Blut erhöht, Kreatinin im Blut erhöht, Hyperkalzämie | Amylase erhöht, Bilirubin im Blut erhöht, alkalische Phosphatase im Blut erhöht, Hyperkalzämie |
Gelegentlich | Amylase erhöht | Amylase erhöht | |
† Die in Tabelle 2 aufgelisteten Nebenwirkungshäufigkeiten müssen nicht ausschließlich auf Pembrolizumab allein zurückzuführen sein, sondern können anteilig durch die zugrunde liegende Erkrankung oder durch andere in Kombination angewendete Arzneimittel bedingt sein.
|
Pembrolizumab in Kombination mit Enfortumab vedotin (siehe Abschnitt 4.2)
Bei Anwendung von Pembrolizumab in Kombination mit Enfortumab vedotin ist vor Beginn der Behandlung die Fachinformation (Summary of Product Characteristics, SmPC) von Enfortumab vedotin zu berücksichtigen.
Die Sicherheit von Pembrolizumab in Kombination mit Enfortumab vedotin wurde bei 564 Patienten mit nicht resezierbarem oder metastasierendem Urothelkarzinom untersucht. Die Patienten erhielten 200 mg Pembrolizumab an Tag 1 und 1,25 mg/kg Enfortumab vedotin an den Tagen 1 und 8 jedes 21-Tage-Zyklus.
Insgesamt wurde unter Pembrolizumab in Kombination mit Enfortumab vedotin eine höhere Inzidenz von Nebenwirkungen als unter Pembrolizumab-Monotherapie beobachtet, was den Beitrag von Enfortumab vedotin und die längere Behandlungsdauer der Kombinationstherapie widerspiegelt.
Die Nebenwirkungen ähnelten im Allgemeinen denen bei Patienten, die Pembrolizumab oder Enfortumab vedotin als Monotherapie erhielten. Die Häufigkeit von makulo-papulösem Ausschlag betrug 36 % jeglichen Schweregrades (davon 10 % Grad 3 – 4) und war somit höher als unter Pembrolizumab-Monotherapie.
Im Allgemeinen war die Häufigkeit von Nebenwirkungen bei Patienten im Alter von ≥ 65 Jahren höher als bei Patienten < 65 Jahren. Dies galt insbesondere für schwerwiegende Nebenwirkungen (56,3 % bzw. 35,3 %) und Nebenwirkungen von ≥ Grad 3 (80,3 % bzw. 64,2 %). Dies ähnelte den Beobachtungen bei der Vergleichschemotherapie.
Beschreibung ausgewählter Nebenwirkungen
Daten über die folgenden immunvermittelten Nebenwirkungen stammen von Patienten aller vier Dosierungsarme von Pembrolizumab (2 mg/kg KG alle 3 Wochen, 10 mg/kg KG alle 2 oder 3 Wochen oder 200 mg alle 3 Wochen) in klinischen Studien (siehe Abschnitt 5.1). Die Vorgaben zum Management dieser Nebenwirkungen sind in Abschnitt 4.4 beschrieben.
Immunvermittelte Nebenwirkungen (siehe Abschnitt 4.4)
Immunvermittelte Pneumonitis
Pneumonitis trat bei 324 (4,2 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2, Grad 3, Grad 4 oder Grad 5 bei 143 (1,9 %), 81 (1,1 %), 19 (0,2 %) bzw. 9 (0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Pneumonitis betrug 3,9 Monate (Spanne: 2 Tage bis 27,2 Monate). Die mediane Dauer betrug 2,0 Monate (Spanne: 1 Tag bis 51,0+ Monate). Pneumonitis trat bei Patienten mit einer früheren Bestrahlung des Thorax in der Krankengeschichte häufiger auf (8,1 %) als bei Patienten, die keine frühere Bestrahlung des Thorax erhalten hatten (3,9 %). Pneumonitis führte bei 131 (1,7 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Pneumonitis heilte bei 196 Patienten ab, bei 6 Patienten blieben Folgeschäden.
Pneumonitis trat bei 230 (6,1 %) Patienten mit NSCLC auf, darunter Fälle von Grad 2, Grad 3, Grad 4 oder Grad 5 bei 103 (2,7 %), 63 (1,7 %), 17 (0,4 %) bzw. 10 (0,3 %) Patienten. Pneumonitis trat bei 8,9 % der Patienten mit lokal fortgeschrittenem oder metastasierendem NSCLC und einer zurückliegenden Bestrahlung des Thorax in der Krankengeschichte auf. Bei Patienten mit klassischem HL bewegte sich die Inzidenz einer Pneumonitis (alle Grade) in KEYNOTE‑087 (n = 210) bzw. KEYNOTE‑204 (n = 148) zwischen 5,2 % und 10,8 %.
Immunvermittelte Kolitis
Kolitis trat bei 158 (2,1 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2, Grad 3 oder Grad 4 bei 49 (0,6 %), 82 (1,1 %) bzw. 6 (0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Kolitis betrug 4,3 Monate (Spanne: 2 Tage bis 24,3 Monate). Die mediane Dauer betrug 1,1 Monate (Spanne: 1 Tag bis 45,2 Monate). Kolitis führte bei 48 (0,6 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Kolitis heilte bei 132 Patienten ab, bei 2 Patienten blieben Folgeschäden. Bei Patienten mit CRC unter Pembrolizumab-Monotherapie (n = 153) betrug die Inzidenz einer Kolitis 6,5 % (alle Grade), darunter waren 2,0 % mit Grad 3 und 1,3 % mit Grad 4.
Immunvermittelte Hepatitis
Hepatitis trat bei 80 (1,0 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2, Grad 3 oder Grad 4 bei 12 (0,2 %), 55 (0,7 %) bzw. 8 (0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Hepatitis betrug 3,5 Monate (Spanne: 8 Tage bis 26,3 Monate). Die mediane Dauer betrug 1,3 Monate (Spanne: 1 Tag bis 29,0+ Monate). Hepatitis führte bei 37 (0,5 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Hepatitis heilte bei 60 Patienten ab.
Immunvermittelte Nephritis
Nephritis trat bei 37 (0,5 %) Patienten unter Pembrolizumab als Monotherapie auf, darunter Fälle von Grad 2, Grad 3 oder Grad 4 bei 11 (0,1 %), 19 (0,2 %) bzw. 2 (< 0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Nephritis betrug 4,2 Monate (Spanne: 12 Tage bis 21,4 Monate). Die mediane Dauer betrug 3,3 Monate (Spanne: 6 Tage bis 28,2+ Monate). Nephritis führte bei 17 (0,2 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Nephritis heilte bei 25 Patienten ab, bei 5 Patienten blieben Folgeschäden. Bei Patienten mit nicht-plattenepithelialem NSCLC unter Pembrolizumab in Kombination mit Pemetrexed und einer Platin-Chemotherapie (n = 488) betrug die Inzidenz einer Nephritis 1,4 % (alle Grade), darunter waren 0,8 % mit Grad 3 und 0,4 % mit Grad 4.
Immunvermittelte Endokrinopathien
Nebenniereninsuffizienz trat bei 74 (1,0 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2, Grad 3 oder Grad 4 bei 34 (0,4 %), 31 (0,4 %) bzw. 4 (0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Nebenniereninsuffizienz betrug 5,4 Monate (Spanne: 1 Tag bis 23,7 Monate). Die mediane Dauer wurde nicht erreicht (Spanne: 3 Tage bis 40,1+ Monate). Nebenniereninsuffizienz führte bei 13 (0,2 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Nebenniereninsuffizienz heilte bei 28 Patienten ab, bei 11 Patienten blieben Folgeschäden.
Hypophysitis trat bei 52 (0,7 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2, Grad 3 oder Grad 4 bei 23 (0,3 %), 24 (0,3 %) bzw. 1 (< 0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Hypophysitis betrug 5,9 Monate (Spanne: 1 Tag bis 17,7 Monate). Die mediane Dauer betrug 3,6 Monate (Spanne: 3 Tage bis 48,1+ Monate). Hypophysitis führte bei 14 (0,2 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Hypophysitis heilte bei 23 Patienten ab, bei 8 Patienten blieben Folgeschäden.
Hyperthyreose trat bei 394 (5,2 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2 oder Grad 3 bei 108 (1,4 %) bzw. 9 (0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Hyperthyreose betrug 1,4 Monate (Spanne: 1 Tag bis 23,2 Monate). Die mediane Dauer betrug 1,6 Monate (Spanne: 4 Tage bis 43,1+ Monate). Hyperthyreose führte bei 4 (0,1 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Hyperthyreose heilte bei 326 (82,7 %) Patienten ab, bei 11 Patienten blieben Folgeschäden. Bei Patienten mit Melanom, NSCLC und RCC unter adjuvanter Behandlung mit Pembrolizumab als Monotherapie (n = 2 060) betrug die Inzidenz einer Hyperthyreose 11,0 %, die meisten davon Grad 1 oder Grad 2.
Hypothyreose trat bei 939 (12,3 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2 oder Grad 3 bei 687 (9,0 %) bzw. 8 (0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der Hypothyreose betrug 3,4 Monate (Spanne: 1 Tag bis 25,9 Monate). Die mediane Dauer wurde nicht erreicht (Spanne: 2 Tage bis 63,0+ Monate). Hypothyreose führte bei 6 (0,1 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die Hypothyreose heilte bei 216 (23,0 %) Patienten ab, bei 16 Patienten blieben Folgeschäden. Bei Patienten mit klassischem HL (n = 389) betrug die Inzidenz einer Hypothyreose 17 %, davon alle Grad 1 oder Grad 2. Bei Patienten mit HNSCC unter Pembrolizumab als Monotherapie (n = 909) betrug die Inzidenz einer Hypothyreose 16,1 % (alle Grade), darunter 0,3 % mit Grad 3. Bei Patienten mit HNSCC unter Pembrolizumab in Kombination mit Platin- und 5‑FU-Chemotherapie (n = 276) betrug die Inzidenz einer Hypothyreose 15,2 %, davon alle Grad 1 oder Grad 2. Bei Patienten unter Pembrolizumab in Kombination mit Axitinib oder Lenvatinib (n = 1 456) betrug die Inzidenz einer Hypothyreose 46,2 % (alle Grade), darunter 0,8 % mit Grad 3 oder Grad 4. Bei Patienten mit Melanom, NSCLC und RCC unter adjuvanter Behandlung mit Pembrolizumab als Monotherapie (n = 2 060) betrug die Inzidenz einer Hypothyreose 18,5 %, die meisten davon Grad 1 oder Grad 2.
Immunvermittelte Nebenwirkungen an der Haut
Immunvermittelte schwere Hautreaktionen traten bei 130 (1,7 %) Patienten unter Pembrolizumab auf, darunter Fälle von Grad 2, Grad 3, Grad 4 oder Grad 5 bei 11 (0,1 %), 103 (1,3 %), 1 (< 0,1 %) und 1 (< 0,1 %) Patienten. Die mediane Zeit bis zum Auftreten der schweren Hautreaktionen betrug 2,8 Monate (Spanne: 2 Tage bis 25,5 Monate). Die mediane Dauer betrug 1,9 Monate (Spanne: 1 Tag bis 47,1+ Monate). Schwere Hautreaktionen führten bei 18 (0,2 %) Patienten zum dauerhaften Absetzen der Therapie mit Pembrolizumab. Die schweren Hautreaktionen heilten bei 95 Patienten ab, bei zwei Patienten blieben Folgeschäden.
Seltene Fälle von SJS und TEN, darunter einige mit tödlichem Ausgang, wurden beobachtet (siehe Abschnitte 4.2 und 4.4).
Komplikationen bei allogener HSZT bei klassischem HL
Von 14 Patienten in KEYNOTE‑013, die im Anschluss an die Behandlung mit Pembrolizumab eine allogene HSZT erhielten, wurde bei 6 Patienten eine akute und bei einem Patienten eine chronische GVHD berichtet, keiner der Patienten verstarb. Zwei Patienten entwickelten eine Lebervenenverschlusskrankheit, einer der Patienten verstarb. Ein Patient entwickelte nach der Transplantation ein Engraftment-Syndrom.
Von 32 Patienten in KEYNOTE‑087, die im Anschluss an die Behandlung mit Pembrolizumab eine allogene HSZT erhielten, wurde bei 16 Patienten eine akute und bei 7 Patienten eine chronische GVHD berichtet, zwei der Patienten verstarben. Keiner der Patienten entwickelte eine Lebervenenverschlusskrankheit. Keiner der Patienten entwickelte nach der Transplantation ein Engraftment-Syndrom.
Von 14 Patienten in KEYNOTE‑204, die im Anschluss an die Behandlung mit Pembrolizumab eine allogene HSZT erhielten, wurde bei 8 Patienten eine akute und bei 3 Patienten eine chronische GVHD berichtet, keiner der Patienten verstarb. Keiner der Patienten entwickelte eine Lebervenenverschlusskrankheit. Ein Patient entwickelte nach der Transplantation ein Engraftment-Syndrom.
Erhöhungen der Leberenzymwerte unter Pembrolizumab in Kombination mit Axitinib bei RCC
In einer klinischen Studie mit bisher unbehandelten Patienten mit RCC wurden unter Pembrolizumab in Kombination mit Axitinib häufiger als erwartet Erhöhungen von ALT (20 %) und AST (13 %) mit Schweregrad 3 und 4 beobachtet. Die mediane Zeitspanne bis zum Auftreten der Erhöhung von ALT betrug 2,3 Monate (Spanne: 7 Tage bis 19,8 Monate). Bei 94 % der Patienten mit einer ≥ 3‑fachen Erhöhung von ALT über dem oberen Normwert (Grad 2 − 4, n = 116) klang die Erhöhung von ALT auf Grad 0 − 1 ab. 59 % der Patienten mit einer Erhöhung von ALT erhielten systemische Kortikosteroide. Von den Patienten, die sich erholten, wurde die Therapie bei 92 Patienten (84 %) wiederaufgenommen, entweder mit Pembrolizumab (3 %) oder Axitinib (31 %) als Monotherapie oder mit beiden Arzneimitteln (50 %). Bei 55 % dieser Patienten traten keine weiteren > 3‑fachen Erhöhungen von ALT über dem oberen Normwert auf; alle Patienten, bei denen eine > 3‑fache Erhöhung von ALT über dem oberen Normwert erneut auftrat, erholten sich. Es traten keine Grad 5 Nebenwirkungen der Leber auf.
Abweichungen bei Laborwerten
Die Anteile der Patienten unter Pembrolizumab-Monotherapie mit einer Grad‑3‑ oder Grad‑4‑Abweichung der Laborwerte vom Ausgangswert waren wie folgt: bei 9,9 % Verringerung der Anzahl der Lymphozyten; bei 7,3 % Erniedrigung des Natriumspiegels; bei 5,7 % Erniedrigung des Hämoglobinwerts; bei 4,6 % Erhöhung des Glucosespiegels; bei 4,5 % Erniedrigung des Phosphatspiegels; bei 3,1 % erhöhte Werte von Alaninaminotransferase (ALT); bei 2,9 % erhöhte Werte von Aspartataminotransferase (AST); bei 2,6 % erhöhte Werte von alkalischer Phosphatase; bei 2,2 % Erniedrigung des Kaliumspiegels; bei 2,1 % Verringerung der Anzahl der Neutrophilen; bei 1,7 % Erhöhung des Bilirubinspiegels; bei 1,7 % Verringerung der Anzahl der Blutplättchen; bei 1,7 % Erhöhung des Kaliumspiegels; bei 1,6 % Erhöhung des Kalziumspiegels; bei 1,4 % Erniedrigung des Albuminspiegels; bei 1,3 % Erniedrigung des Kalziumspiegels; bei 1,2 % Erhöhung des Kreatininspiegels; bei 0,8 % Verringerung der Anzahl der Leukozyten; bei 0,8 % Erhöhung des Magnesiumspiegels; bei 0,6 % Erniedrigung des Glucosespiegels; bei 0,2 % Erniedrigung des Magnesiumspiegels sowie bei 0,2 % Erhöhung des Natriumspiegels.
Die Anteile der Patienten unter Pembrolizumab in Kombination mit Chemotherapie oder CRT mit einer Grad‑3‑ oder Grad‑4‑Abweichung der Laborwerte vom Ausgangswert waren wie folgt: bei 37,6 % Verringerung der Anzahl der Neutrophilen; bei 30,9 % Verringerung der Anzahl der Lymphozyten; bei 24,4 % Verringerung der Anzahl der Leukozyten; bei 20,7 % Erniedrigung des Hämoglobinwerts; bei 12,4 % Verringerung der Anzahl der Blutplättchen; bei 9,3 % Erniedrigung des Natriumspiegels; bei 7,9 % Erniedrigung des Kaliumspiegels; bei 7,3 % Erniedrigung des Phosphatspiegels; bei 5,5 % Erhöhung des Glucosespiegels; bei 5,1 % erhöhte Werte von Alaninaminotransferase (ALT); bei 4,6 % erhöhte Werte von Aspartataminotransferase (AST); bei 3,5 % Erniedrigung des Kalziumspiegels; bei 3,1 % Erhöhung des Bilirubinspiegels; bei 3,0 % Erhöhung des Kaliumspiegels; bei 3,0 % Erhöhung des Kreatininspiegels; bei 2,4 % erhöhte Werte von alkalischer Phosphatase; bei 2,3 % Erniedrigung des Albuminspiegels; bei 1,6 % Erhöhung des Kalziumspiegels; bei 0,9 % Erniedrigung des Glucosespiegels sowie bei 0,4 % Erhöhung des Natriumspiegels.
Die Anteile der Patienten unter Pembrolizumab in Kombination mit Axitinib oder Lenvatinib mit einer Grad‑3‑ oder Grad‑4‑Abweichung der Laborwerte vom Ausgangswert waren wie folgt: bei 23,0 % erhöhte Werte von Lipase (bei Patienten unter Pembrolizumab und Axitinib nicht gemessen); bei 12,3 % Verringerung der Anzahl der Lymphozyten; bei 11,4 % Erniedrigung des Natriumspiegels; bei 11,2 % Erhöhung des Amylasespiegels; bei 11,2 % Erhöhung des Triglyceridspiegels; bei 10,4 % erhöhte Werte von Alaninaminotransferase (ALT); bei 8,9 % erhöhte Werte von Aspartataminotransferase (AST); bei 7,8 % Erhöhung des Glucosespiegels; bei 6,8 % Erniedrigung des Phosphatspiegels; bei 6,1 % Erniedrigung des Kaliumspiegels; bei 5,1 % Erhöhung des Kaliumspiegels; bei 4,5 % Erhöhung des Cholesterinspiegels; bei 4,4 % Erhöhung des Kreatininspiegels; bei 4,2 % Erniedrigung des Hämoglobinwerts; bei 4,0 % Verringerung der Anzahl der Neutrophilen; bei 3,1 % erhöhte Werte von alkalischer Phosphatase; bei 3,0 % Verringerung der Anzahl der Blutplättchen; bei 2,8 % Erhöhung des Bilirubinspiegels; bei 2,2 % Erniedrigung des Kalziumspiegels; bei 2,2 % Erhöhung des Magnesiumspiegels; bei 1,7 % Verringerung der Anzahl der Leukozyten; bei 1,5 % Erniedrigung des Magnesiumspiegels; bei 1,5 % Erhöhung des INR‑Wertes; bei 1,4 % Erniedrigung des Glucosespiegels; bei 1,2 % Erniedrigung des Albuminspiegels; bei 1,0 % Erhöhung des Kalziumspiegels; bei 0,4 % Erhöhung des Natriumspiegels und bei 0,1 % Erhöhung des Hämoglobinwerts.
Immunogenität
In klinischen Studien mit Patienten unter Pembrolizumab als Monotherapie in einer Dosierung von 2 mg/kg KG alle drei Wochen, 200 mg alle drei Wochen oder 10 mg/kg KG alle zwei oder drei Wochen, wurden 36 (1,8 %) Patienten von 2 034 auswertbaren Patienten positiv auf therapiebedingte Antikörper gegen Pembrolizumab getestet, von denen 9 (0,4 %) Patienten neutralisierende Antikörper gegen Pembrolizumab hatten. Es gab keinen Hinweis auf ein verändertes pharmakokinetisches Profil oder Sicherheitsprofil im Zusammenhang mit der Bildung von Anti-Pembrolizumab-bindenden oder -neutralisierenden Antikörpern.
Kinder und Jugendliche
Die Sicherheit von Pembrolizumab als Monotherapie wurde im Rahmen der Phase-I-/-II-Studie KEYNOTE‑051 bei 161 Kindern und Jugendlichen im Alter von 9 Monaten bis 17 Jahren mit fortgeschrittenem Melanom, Lymphom oder PD‑L1-positiven, fortgeschrittenen, rezidivierenden oder refraktären soliden Tumoren in einer Dosierung von 2 mg/kg KG alle 3 Wochen untersucht. Die Population mit klassischem HL (n = 22) umfasste Patienten zwischen 11 und 17 Jahren. Das Sicherheitsprofil bei Kindern und Jugendlichen war mit dem bei erwachsenen Patienten unter Pembrolizumab beobachteten Sicherheitsprofil im Allgemeinen vergleichbar. Die häufigsten (bei mindestens 20 % der Kinder und Jugendlichen berichteten) Nebenwirkungen waren Fieber (33 %), Erbrechen (30 %), Kopfschmerzen (26 %), Abdominalschmerzen (22 %), Anämie (21 %), Husten (21 %) und Obstipation (20 %). Die meisten unter Monotherapie berichteten Nebenwirkungen entsprachen Schweregrad 1 oder 2. 76 (47,2 %) Patienten hatten eine oder mehrere Nebenwirkungen mit Schweregrad 3 bis 5, davon hatten 5 (3,1 %) Patienten eine oder mehrere Nebenwirkungen mit tödlichem Ausgang. Die Häufigkeiten basierten auf allen berichteten Nebenwirkungen unabhängig der Einschätzung eines Kausalzusammenhangs seitens des Prüfarztes. Daten zur Langzeitsicherheit von Pembrolizumab bei Kindern und Jugendlichen mit Melanom in den Tumorstadien IIB, IIC und III im Rahmen einer adjuvanten Behandlung liegen derzeit nicht vor.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer anzuzeigen über:
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51 – 59, 63225 Langen, Tel.: +49 6103 77 0, Fax: +49 6103 77 1234, Website: http://www.pei.de
Informationen zu einer Überdosierung mit Pembrolizumab liegen nicht vor.
Im Falle einer Überdosierung müssen die Patienten engmaschig auf Anzeichen oder Symptome von Nebenwirkungen überwacht und angemessen symptomatisch behandelt werden.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, PD‑1/PDL‑1 (Programmed Cell Death-1-Rezeptor/Programmed Cell Death-Ligand-1)-Inhibitoren. ATC-Code: L01FF02
Wirkmechanismus
KEYTRUDA ist ein humanisierter monoklonaler Antikörper, der an den „Programmed cell death‑1“ (PD‑1)-Rezeptor bindet und die Interaktion mit seinen Liganden PD‑L1 und PD‑L2 blockiert. Der PD‑1-Rezeptor ist ein negativer Regulator der T-Zell-Aktivität, der nachweislich an der Kontrolle der T‑Zell-Immunreaktion beteiligt ist. KEYTRUDA verstärkt die T‑Zell-Reaktion einschließlich der Immunreaktion gegen den Tumor durch Hemmung der Bindung des PD‑1-Rezeptors an seine Liganden PD‑L1 und PD‑L2, die auf Antigen-präsentierenden Zellen exprimiert werden und von Tumoren oder anderen Zellen in der Mikroumgebung des Tumors exprimiert werden können.
Die anti-angiogene Wirkung von Lenvatinib (Multi‑TKI) in Kombination mit der immunstimulierenden Wirkung von Pembrolizumab (PD‑1-Rezeptor-Antikörper) führt zu einer stärkeren T‑Zell-Aktivierung in der Mikroumgebung des Tumors, die supportiv primäre und erworbene Resistenzen gegen die Immuntherapie überwinden und das Ansprechen des Tumors im Vergleich zu jeweiliger Monotherapie verbessern kann. In präklinischen Mausmodellen zeigten PD‑1-Inhibitoren in Kombination mit TK‑Inhibitoren eine erhöhte anti-tumorale Aktivität im Vergleich zu alleiniger Gabe der einzelnen Wirkstoffe.
Klinische Wirksamkeit und Sicherheit
Die Gabe von Pembrolizumab in Dosierungen von 2 mg/kg KG alle 3 Wochen, 10 mg/kg KG alle 3 Wochen sowie 10 mg/kg KG alle 2 Wochen wurde in klinischen Studien bei Patienten mit Melanom oder vorbehandeltem NSCLC untersucht. Basierend auf „Modelling“ und Simulation von Dosis-Expositions-Beziehungen hinsichtlich Wirksamkeit und Sicherheit von Pembrolizumab ergaben sich keine klinisch signifikanten Unterschiede in der Wirksamkeit oder der Sicherheit zwischen den Dosierungen 200 mg alle 3 Wochen, 2 mg/kg KG alle 3 Wochen sowie 400 mg alle 6 Wochen (siehe Abschnitt 4.2).
Melanom
KEYNOTE‑006: Kontrollierte Studie bei Ipilimumab-naiven Patienten mit Melanom
Die Sicherheit und Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑006, einer multizentrischen, offenen, kontrollierten Phase-III-Studie zur Behandlung des fortgeschrittenen Melanoms bei Ipilimumab-naiven Patienten, untersucht. Die Patienten erhielten randomisiert (1:1:1) entweder Pembrolizumab in einer Dosis von 10 mg/kg KG alle zwei (n = 279) oder drei (n = 277) Wochen oder Ipilimumab 3 mg/kg KG alle 3 Wochen (n = 278). Eine vorherige Behandlung mit einem BRAF-Inhibitor war bei den Patienten mit BRAF-V600E-positivem Melanom nicht vorausgesetzt.
Die Patienten wurden mit Pembrolizumab bis zum Fortschreiten der Krebserkrankung oder dem Auftreten unzumutbarer Toxizität behandelt. Klinisch stabile Patienten mit initialen Anzeichen eines Fortschreitens der Krebserkrankung durften bis zur Bestätigung des Fortschreitens der Krebserkrankung weiterbehandelt werden. Die Beurteilung des Tumorstatus erfolgte nach 12 Wochen, danach alle 6 Wochen bis Woche 48, im Anschluss daran alle 12 Wochen.
Von den 834 Patienten waren 60 % Männer, 44 % waren ≥ 65 Jahre (das mediane Alter betrug 62 Jahre [Spanne: 18 – 89 Jahre]) und 98 % waren kaukasischer Herkunft. Bei 65 % der Patienten lagen Metastasen im M1c-Stadium vor, 9 % hatten Hirnmetastasen in der Krankengeschichte, 66 % hatten keine vorhergehende systemische Therapie erhalten, während 34 % eine vorhergehende Therapie erhalten hatten. Bei 31 % lag ein ECOG-Performance-Status von 1 vor; bei 69 % lag ein ECOG-Performance-Status von 0 vor und 32 % hatten einen erhöhten LDH-Wert. BRAF-mutierte Tumoren wurden bei 302 Patienten (36 %) berichtet. Von den Patienten mit BRAF-mutierten Tumoren waren 139 Patienten (46 %) vorher bereits mit einem BRAF-Inhibitor behandelt worden.
Primäre Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Krebserkrankung („Progression Free Survival“ [PFS]), das mittels einer integrierten radiologischen und onkologischen Bewertung („Integrated Radiology and Oncology Assessment [IRO] Review“) gemäß RECIST-Kriterien („Response Evaluation Criteria in Solid Tumors“ [RECIST‑v1.1]) bewertet wurde, und das Gesamtüberleben („Overall Survival“ [OS]). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate („Objective Response Rate“ [ORR]) und die Dauer des Ansprechens. Tabelle 3 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte bei Ipilimumab-naiven Patienten nach finaler Analyse nach einer Nachbeobachtungszeit von mindestens 21 Monaten. Die Kaplan-Meier-Kurven für OS und PFS basierend auf der finalen Analyse sind in den Abbildungen 1 und 2 dargestellt.
Tabelle 3: Wirksamkeitsergebnisse in KEYNOTE-006
Endpunkt | Pembrolizumab | Pembrolizumab | Ipilimumab |
Gesamtüberleben (OS) | |||
Anzahl (%) Patienten mit Ereignis | 119 (43 %) | 122 (44 %) | 142 (51 %) |
Hazard-Ratio* (95-%-KI) | 0,68 (0,53; 0,86) | 0,68 (0,53; 0,87) | --- |
p-Wert† | < 0,001 | < 0,001 | --- |
Median in Monaten (95-%-KI) | Nicht erreicht | Nicht erreicht | 16 |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | |||
Anzahl (%) Patienten mit Ereignis | 183 (66 %) | 181 (65 %) | 202 (73 %) |
Hazard-Ratio* (95-%-KI) | 0,61 (0,50; 0,75) | 0,61 (0,50; 0,75) | --- |
p-Wert† | < 0,001 | < 0,001 | --- |
Median in Monaten (95-%-KI) | 4,1 | 5,6 | 2,8 |
Bestes objektives Ansprechen | |||
ORR % (95-%-KI) | 36 % | 37 % | 13 % |
Vollständiges Ansprechen | 13 % | 12 % | 5 % |
Partielles Ansprechen | 23 % | 25 % | 8 % |
Dauer des Ansprechens‡ | |||
Median in Monaten (Spanne) | Nicht erreicht | Nicht erreicht | Nicht erreicht |
% mit andauerndem Ansprechen nach 18 Monaten | 68 %§ | 71 %§ | 70 %§ |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Ipilimumab) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | |||
Abbildung 1: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑006 (Intent-to-Treat-Population)
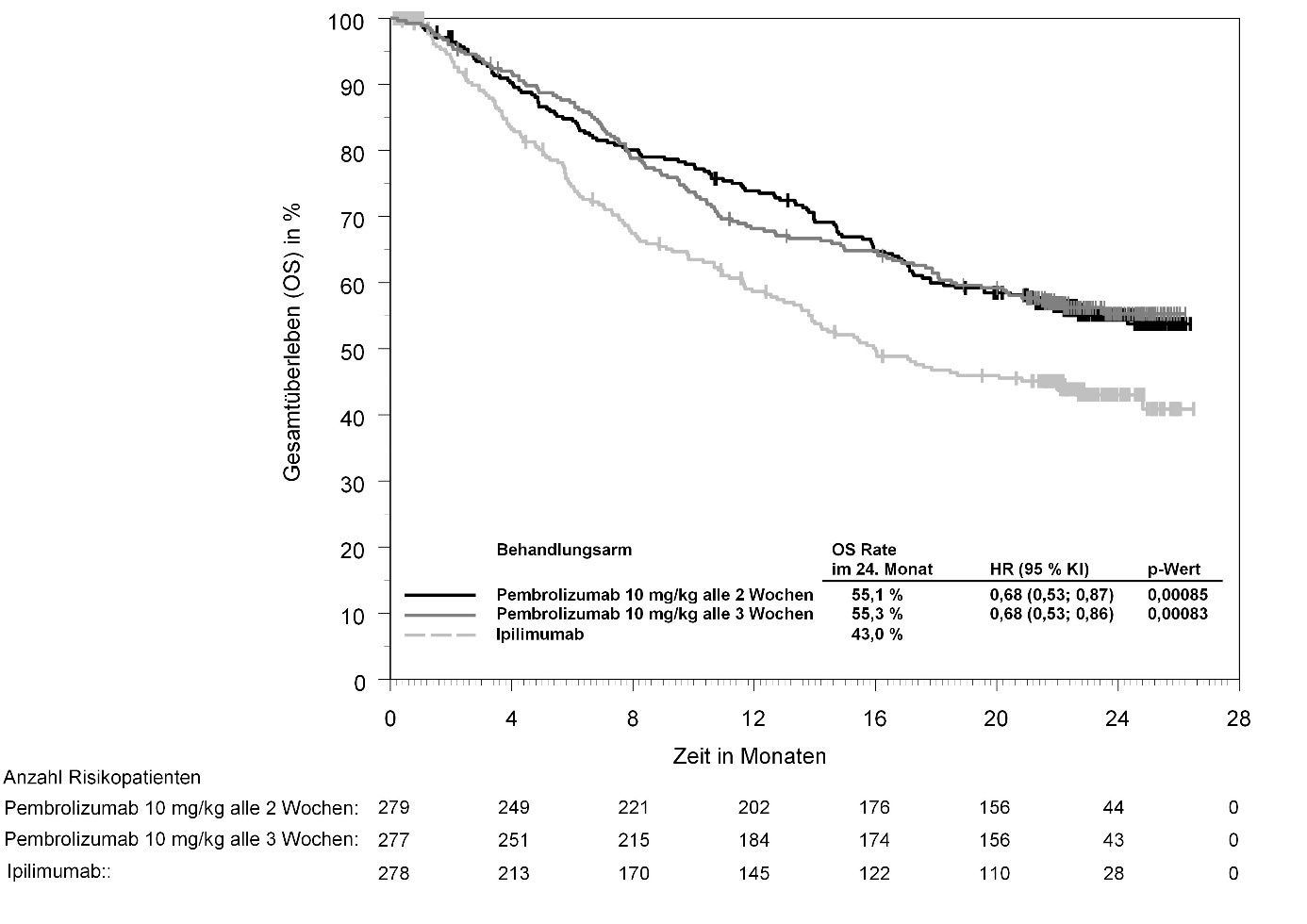
Abbildung 2: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑006 (Intent-to-Treat-Population)
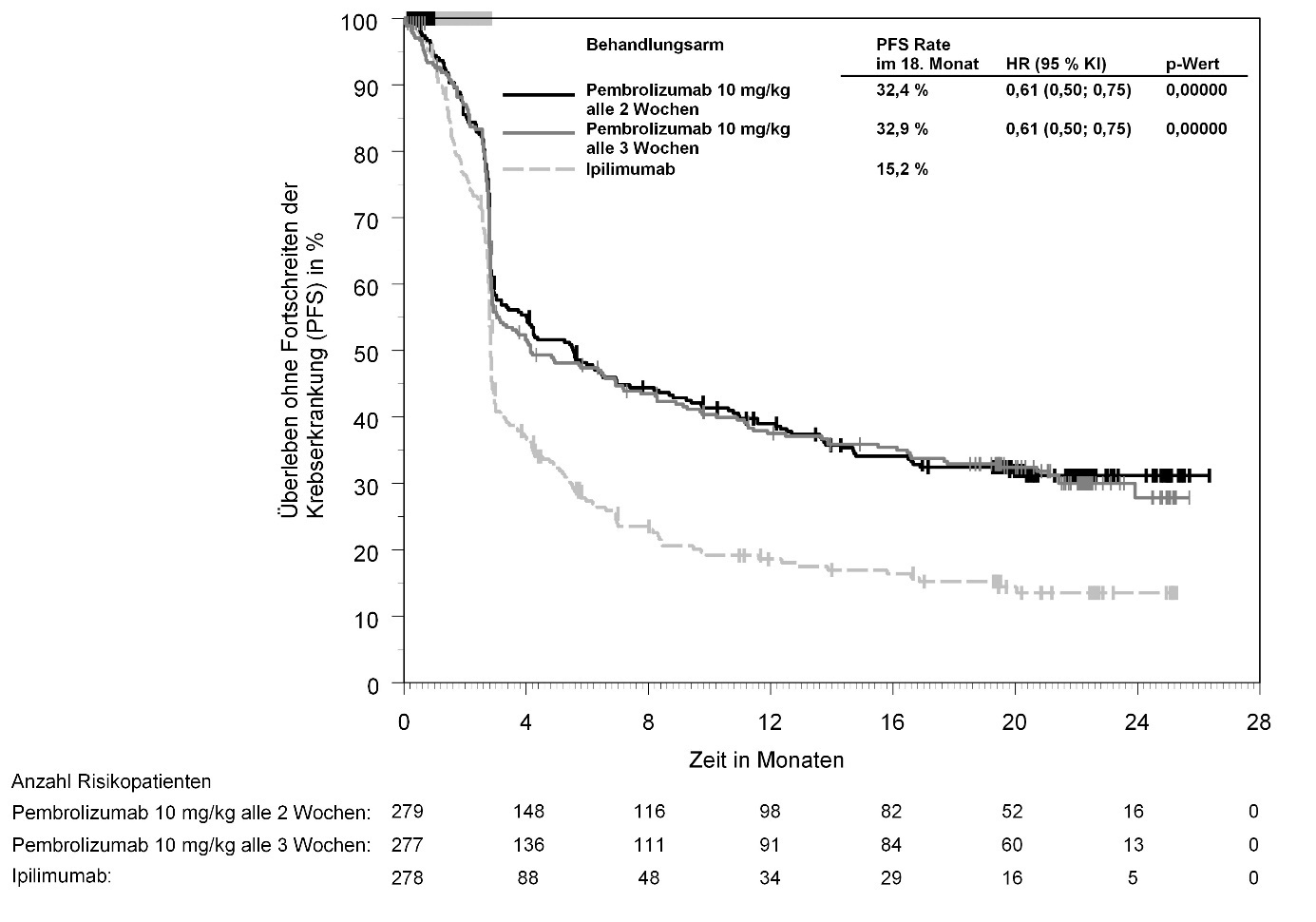
KEYNOTE‑002: Kontrollierte Studie bei Ipilimumab-vorbehandelten Patienten mit Melanom
Die Sicherheit und Wirksamkeit von Pembrolizumab wurden in KEYNOTE‑002, einer multizentrischen, doppel-blinden, kontrollierten Studie zur Behandlung des fortgeschrittenen Melanoms bei Ipilimumab-vorbehandelten Patienten, die zusätzlich, bei Vorliegen einer BRAF-V600-Mutation, mit einem BRAF- oder MEK-Inhibitor vorbehandelt waren, untersucht. Die Patienten erhielten randomisiert (1:1:1) Pembrolizumab in einer Dosis von 2 mg/kg KG (n = 180) oder 10 mg/kg KG (n = 181) alle 3 Wochen oder Chemotherapie (n = 179; einschließlich Dacarbazin, Temozolomid, Carboplatin, Paclitaxel oder Carboplatin+Paclitaxel). Die Studie schloss Patienten mit einer Autoimmunerkrankung oder unter Immunsuppressiva aus; sowie Patienten mit schweren oder lebensbedrohlichen immunvermittelten Nebenwirkungen unter Ipilimumab in der Anamnese, definiert als jegliche Grad‑4‑Toxizität oder Grad‑3‑Toxizität, die eine Kortikosteroid-Behandlung über mehr als 12 Wochen erforderlich machte (mehr als 10 mg/Tag Prednison oder eines Äquivalents in entsprechender Dosierung); sowie Patienten mit anhaltenden Nebenwirkungen ≥ Grad 2 einer vorhergehenden Ipilimumab-Behandlung; ferner Patienten mit einer früheren schweren Überempfindlichkeit gegen andere monoklonale Antikörper; Patienten mit Pneumonitis oder interstitieller Lungenerkrankung in der Anamnese; Patienten mit einer HIV‑Infektion, Hepatitis‑B- oder Hepatitis‑C-Infektion sowie Patienten mit einem ECOG-Performance-Status ≥ 2.
Die Patienten wurden bis zum Fortschreiten der Krebserkrankung oder dem Auftreten unzumutbarer Toxizität mit Pembrolizumab behandelt. Klinisch stabile Patienten mit initialen Anzeichen eines Fortschreitens der Krebserkrankung durften bis zur Bestätigung des Fortschreitens der Krebserkrankung weiterbehandelt werden. Die Beurteilung des Tumorstatus erfolgte nach 12 Wochen, danach alle 6 Wochen bis Woche 48, im Anschluss daran alle 12 Wochen. Patienten unter Chemotherapie, die ein von unabhängiger Seite bestätigtes Fortschreiten der Krebserkrankung nach der ersten planmäßigen Beurteilung der Krebserkrankung aufwiesen, konnten die Therapie wechseln und erhielten doppel-verblindet 2 mg/kg KG oder 10 mg/kg KG Pembrolizumab alle 3 Wochen.
Von den 540 Patienten waren 61 % Männer, 43 % waren ≥ 65 Jahre (das mediane Alter betrug 62 Jahre [Spanne: 15 – 89 Jahre]) und 98 % waren kaukasischer Herkunft. Bei 82 % lagen Metastasen im M1c-Stadium vor, 73 % hatten zuvor mindestens zwei und 32 % der Patienten hatten drei oder mehr systemische Therapien zur Behandlung des fortgeschrittenen Melanoms erhalten. Bei 45 % lag ein ECOG-Performance-Status von 1 vor; 40 % hatten einen erhöhten LDH-Wert und 23 % hatten BRAF-mutierte (V600-Mutation-positive) Tumoren.
Primäre Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Krebserkrankung (PFS), das mittels „IRO“ gemäß RECIST-Kriterien (Version 1.1) bewertet wurde, sowie das Gesamtüberleben (OS). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens. Tabelle 4 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte bei Ipilimumab-vorbehandelten Patienten nach finaler Analyse, Abbildung 3 zeigt die Kaplan-Meier-Kurve für das Überleben ohne Fortschreiten der Krebserkrankung (PFS). Beide Pembrolizumab-Arme waren bezüglich des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) der Chemotherapie überlegen; zwischen den beiden Pembrolizumab-Dosierungen gab es keinen Unterschied. Es zeigte sich kein statistisch signifikanter Unterschied zwischen Pembrolizumab und Chemotherapie in der finalen, noch nicht an die potenziellen Störeffekte des Therapiewechsels („Crossover“) angepassten OS-Analyse. Von den in den Chemotherapiearm randomisierten Patienten wechselten 55 % die Therapie und erhielten anschließend eine Behandlung mit Pembrolizumab.
Tabelle 4: Wirksamkeitsergebnisse in KEYNOTE‑002
Endpunkt | Pembrolizumab | Pembrolizumab | Chemotherapie |
n = 180 | n = 181 | n = 179 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | |||
Anzahl (%) Patienten mit Ereignis | 150 (83 %) | 144 (80 %) | 172 (96 %) |
Hazard-Ratio* (95-%-KI) | 0,58 (0,46; 0,73) | 0,47 (0,37; 0,60) | --- |
p-Wert† | < 0,001 | < 0,001 | --- |
Median in Monaten (95-%-KI) | 2,9 (2,8; 3,8) | 3,0 (2,8; 5,2) | 2,8 (2,6; 2,8) |
Gesamtüberleben (OS) | |||
Anzahl (%) Patienten mit Ereignis | 123 (68 %) | 117 (65 %) | 128 (72 %) |
Hazard-Ratio* (95-%-KI) | 0,86 (0,67; 1,10) | 0,74 (0,57; 0,96) | --- |
p-Wert† | 0,1173 | 0,0106‡ | --- |
Median in Monaten (95-%-KI) | 13,4 (11,0; 16,4) | 14,7 (11,3; 19,5) | 11,0 (8,9; 13,8) |
Bestes objektives Ansprechen | |||
ORR % (95-%-KI) | 22 % (16; 29) | 28 % (21; 35) | 5 % (2; 9) |
Vollständiges Ansprechen | 3 % | 7 % | 0 % |
Partielles Ansprechen | 19 % | 20 % | 5 % |
Dauer des Ansprechens§ | |||
Median in Monaten (Spanne) | 22,8 | Nicht erreicht | 6,8 |
% mit andauerndem Ansprechen nach 12 Monaten | 73 %¶ | 79 %¶ | 0 %¶ |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Chemotherapie) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | |||
Abbildung 3: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑002 (Intent-to-Treat-Population)
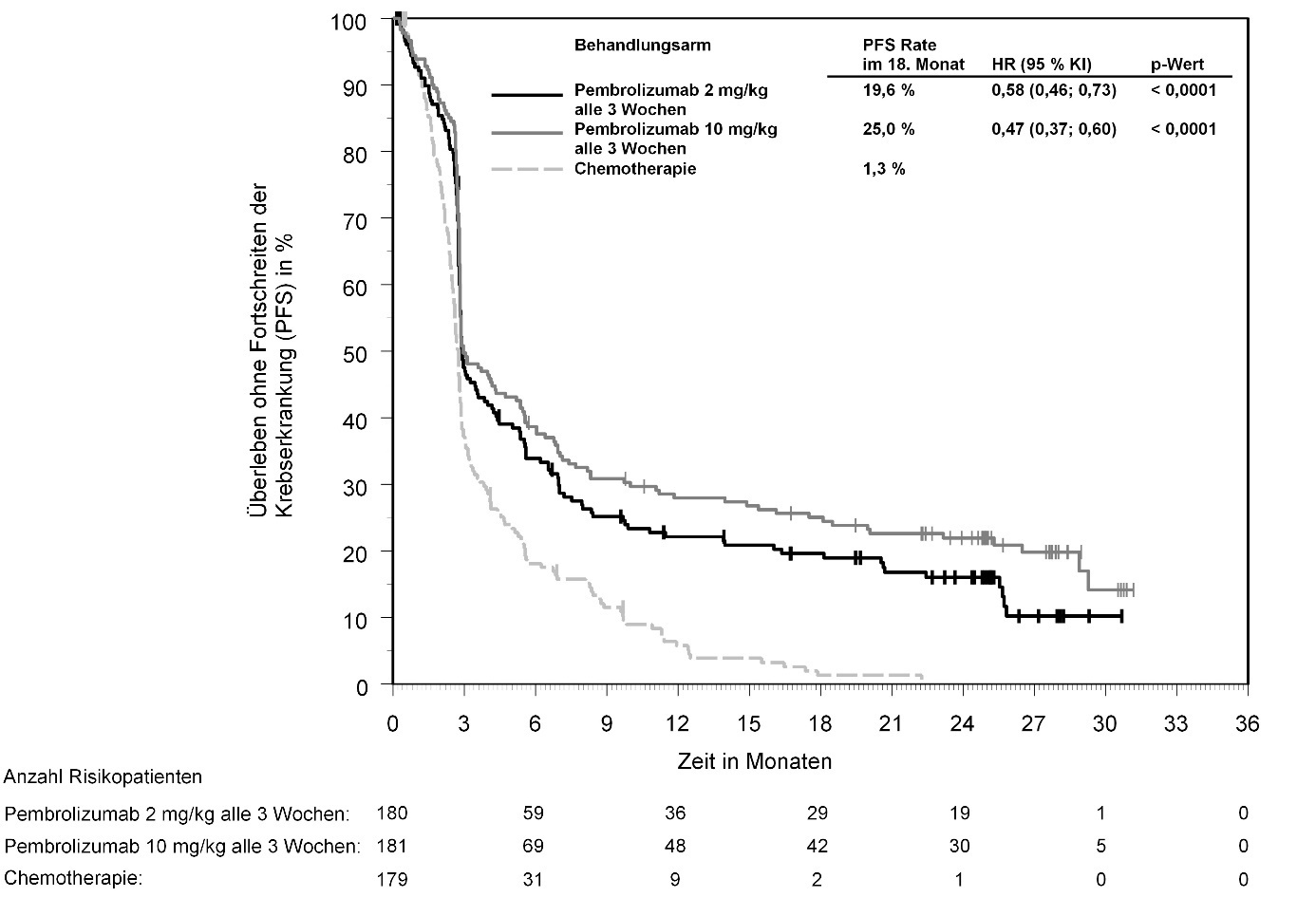
KEYNOTE‑001: Open-Label Studie bei Ipilimumab-naiven und Ipilimumab-vorbehandelten Patienten mit Melanom
Die Sicherheit und Wirksamkeit von Pembrolizumab bei Patienten mit fortgeschrittenem Melanom wurden in einer unkontrollierten Open-Label Studie, KEYNOTE‑001, untersucht. Die Wirksamkeit wurde bei 276 Patienten aus zwei definierten Kohorten bewertet, eine davon schloss Ipilimumab-vorbehandelte Patienten (und zusätzlich, bei Vorliegen einer BRAF-V600-Mutation, auch eine BRAF- oder MEK-Inhibitor-Vorbehandlung) ein, die andere schloss Ipilimumab-naive Patienten ein. Die Patienten erhielten randomisiert Pembrolizumab in Dosierungen von 2 mg/kg KG alle 3 Wochen oder 10 mg/kg KG alle 3 Wochen. Die Patienten wurden bis zum Fortschreiten der Krebserkrankung oder bis zum Auftreten einer nicht zumutbaren Toxizität mit Pembrolizumab behandelt. Klinisch stabile Patienten mit initialen Anzeichen eines Fortschreitens der Krebserkrankung durften bis zur Bestätigung des Fortschreitens der Krebserkrankung weiterbehandelt werden. Die Ausschlusskriterien entsprachen im Wesentlichen denen der KEYNOTE‑002 Studie.
Von den 89 Ipilimumab-vorbehandelten Patienten unter der 2 mg/kg KG Dosierung von Pembrolizumab waren 53 % Männer, 33 % waren ≥ 65 Jahre, das mediane Alter betrug 59 Jahre (Spanne: 18 – 88 Jahre). Bis auf zwei Patienten waren alle kaukasischer Herkunft. Bei 84 % lagen Metastasen im M1c-Stadium vor und 8 % der Patienten hatten Hirnmetastasen in ihrer Krankengeschichte. Siebzig Prozent hatten mindestens zwei und 35 % der Patienten hatten drei oder mehr systemische Therapien zur Behandlung des fortgeschrittenen Melanoms erhalten. BRAF-V600-Mutationen wurden bei 13 % der Studienpopulation berichtet. Alle Patienten mit BRAF-mutierten (V600-Mutation positiven) Tumoren wurden vorher bereits mit einem BRAF-Inhibitor behandelt.
Von den 51 Ipilimumab-naiven Patienten unter der 2 mg/kg KG Dosierung von Pembrolizumab waren 63 % Männer, 35 % waren ≥ 65 Jahre, das mediane Alter betrug 60 Jahre (Spanne: 35 – 80 Jahre). Bis auf einen Patienten waren alle kaukasischer Herkunft. Bei 63 % lagen Metastasen im M1c-Stadium vor und 2 % der Patienten hatten Hirnmetastasen in ihrer Krankengeschichte. Fünfundvierzig Prozent hatten keine Vortherapie zur Behandlung des fortgeschrittenen Melanoms erhalten. BRAF-Mutationen der Tumoren wurden bei 20 Patienten (39 %) berichtet. Von den Patienten mit BRAF-mutierten (V600-Mutation positiven) Tumoren wurden 10 Patienten (50 %) vorher bereits mit einem BRAF-Inhibitor behandelt.
Primärer Wirksamkeitsendpunkt war die Objektive Ansprechrate (ORR), die mittels einer unabhängigen Bewertung gemäß RECIST‑v1.1-Kriterien bewertet wurde. Sekundäre Wirksamkeitsendpunkte waren Krankheitskontrollrate („disease control rate“ [DCR]) (einschließlich vollständigem Ansprechen, partiellem Ansprechen und stabiler Erkrankung), Dauer des Ansprechens, Überleben ohne Fortschreiten der Krebserkrankung (PFS) sowie Gesamtüberleben (OS). Das Tumor-Ansprechen wurde in 12 Wochen Intervallen untersucht. In Tabelle 5 ist eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte bei Ipilimumab-vorbehandelten oder Ipilimumab-naiven Patienten unter einer Dosis Pembrolizumab von 2 mg/kg KG basierend auf einer Nachbeobachtungszeit von mindestens 30 Monaten bei allen Patienten dargestellt.
Tabelle 5: Wirksamkeitsergebnisse in KEYNOTE‑001
Endpunkt | Pembrolizumab 2 mg/kg KG alle 3 Wochen bei | Pembrolizumab 2 mg/kg KG alle 3 Wochen bei |
Bestes objektives Ansprechen* gemäß IRO† | ||
ORR % (95-%-KI) | 26 % (17; 36) | 35 % (22; 50) |
Vollständiges Ansprechen | 7 % | 12 % |
Partielles Ansprechen | 19 % | 24 % |
Krankheitskontrollrate %‡ | 48 % | 49 % |
Dauer des Ansprechens§ | ||
Median in Monaten (Spanne) | 30,5 | 27,4 |
% mit andauerndem Ansprechen nach 24 Monaten¶ | 75 % | 71 % |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Median in Monaten (95-%-KI) | 4,9 (2,8; 8,3) | 4,7 (2,8; 13,8) |
PFS-Rate nach 12 Monaten | 34 % | 38 % |
Gesamtüberleben (OS) | ||
Median in Monaten | 18,9 | 28,0 |
Gesamtüberlebensrate (OS-Rate) nach 24 Monaten | 44 % | 56 % |
* Schließt Patienten ohne messbare Erkrankung (beurteilt mittels unabhängiger radiologischer Untersuchung) zu Behandlungsbeginn ein | ||
Die Ergebnisse bei Ipilimumab-vorbehandelten (n = 84) und bei Ipilimumab-naiven (n = 52) Patienten unter der Dosierung von 10 mg/kg KG Pembrolizumab alle 3 Wochen entsprachen im Wesentlichen den Ergebnissen, die bei Patienten unter der Dosierung von 2 mg/kg KG Pembrolizumab alle 3 Wochen beobachtet wurden.
Subpopulationsanalysen
BRAF-V600-Mutations-Status bei Melanom
In KEYNOTE‑002 wurde als Teil der finalen Analyse eine Subgruppenanalyse der Patienten mit Tumoren mit BRAF-Wildtyp (n = 414; 77 %) oder BRAF-Mutation (BRAF-V600-Mutation) mit einer BRAF-Inhibitor-Vorbehandlung (n = 126; 23 %) durchgeführt, wie in Tabelle 6 zusammengefasst.
Tabelle 6: Wirksamkeitsergebnisse nach BRAF-Mutations-Status in KEYNOTE‑002
BRAF-Wildtyp | BRAF-Mutation mit einer BRAF-Inhibitor-Vorbehandlung | |||
Endpunkt | Pembrolizumab 2 mg/kg KG alle 3 Wochen | Chemotherapie | Pembrolizumab 2 mg/kg KG alle 3 Wochen | Chemotherapie |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) Hazard-Ratio* (95-%-KI) | 0,50 | --- | 0,79 | --- |
Gesamtüberleben (OS) Hazard-Ratio* (95-%-KI) | 0,78 | --- | 1,07 | --- |
ORR % | 26 % | 6 % | 9 % | 0 % |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Chemotherapie) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||||
In KEYNOTE‑006 wurde als Teil der finalen Analyse eine Subgruppenanalyse der Patienten mit Tumoren mit BRAF-Wildtyp (n = 525; 63 %), mit BRAF-Mutation (BRAF-V600-Mutation) ohne BRAF-Inhibitor-Vorbehandlung (n = 163; 20 %) sowie mit BRAF-Mutation (BRAF-V600-Mutation) mit einer BRAF-Inhibitor-Vorbehandlung (n = 139; 17 %) durchgeführt, wie in Tabelle 7 zusammengefasst.
Tabelle 7: Wirksamkeitsergebnisse nach BRAF-Mutations-Status in KEYNOTE‑006
BRAF-Wildtyp | BRAF-Mutation ohne | BRAF-Mutation mit einer | ||||
Endpunkt | Pembrolizumab 10 mg/kg KG alle 2 oder 3 Wochen (gepoolt) | Ipilimumab | Pembrolizumab 10 mg/kg KG alle 2 oder 3 Wochen (gepoolt) | Ipilimumab | Pembrolizumab 10 mg/kg KG alle 2 oder 3 Wochen (gepoolt) | Ipilimumab |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) Hazard-Ratio* (95-%-KI) | 0,61 | --- | 0,52 | --- | 0,76 | --- |
Gesamtüberleben (OS) Hazard-Ratio* (95-%-KI) | 0,68 | --- | 0,70 | --- | 0,66 | --- |
ORR % | 38 % | 14 % | 41 % | 15 % | 24 % | 10 % |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Ipilimumab) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||||||
PD‑L1-Status bei Melanom
In KEYNOTE‑002 wurde als Teil der finalen Analyse eine Subgruppenanalyse der Patienten mit positivem PD‑L1-Status („PD‑L1-Expression in ≥ 1 % der Tumorzellen sowie der tumorassoziierten Immunzellen im Verhältnis zu allen lebensfähigen Tumorzellen – MEL Score“) versus negativem PD‑L1-Status durchgeführt. Die PD‑L1-Expression wurde nachträglich mit einem immunhistochemischen (IHC) Test mit einem 22C3-Anti‑PD‑L1-Antikörper untersucht. Unter den Patienten, die für eine Auswertung der PD‑L1-Expression (79 %) in Frage kamen, waren 69 % (n = 294) PD‑L1-positiv und 31 % (n = 134) PD‑L1-negativ. Die Wirksamkeitsergebnisse entsprechend PD‑L1-Expression sind in Tabelle 8 zusammengefasst.
Tabelle 8: Wirksamkeitsergebnisse entsprechend PD‑L1-Expression in KEYNOTE‑002
Endpunkt | Pembrolizumab 2 mg/kg KG alle 3 Wochen | Chemotherapie | Pembrolizumab 2 mg/kg KG alle 3 Wochen | Chemotherapie |
PD‑L1-positiv | PD‑L1-negativ | |||
Überleben ohne Fortschreiten der Krebserkrankung (PFS) Hazard-Ratio* (95-%-KI) | 0,55 | --- | 0,81 | --- |
Gesamtüberleben (OS) Hazard-Ratio* (95-%-KI) | 0,90 | --- | 1,18 | --- |
ORR % | 25 % | 4 % | 10 % | 8 % |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Chemotherapie) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||||
In KEYNOTE‑006 wurde als Teil der finalen Analyse eine Subgruppenanalyse der Patienten mit positivem PD‑L1-Status (n = 671; 80 %) versus negativem PD‑L1-Status (n = 150; 18 %) durchgeführt. Unter den Patienten, die für eine Auswertung der PD‑L1-Expression (98 %) in Frage kamen, waren 82 % PD‑L1-positiv und 18 % PD‑L1-negativ. Die Wirksamkeitsergebnisse entsprechend PD‑L1-Expression sind in Tabelle 9 zusammengefasst.
Tabelle 9: Wirksamkeitsergebnisse entsprechend PD-L1-Expression in KEYNOTE-006
Endpunkt | Pembrolizumab | Ipilimumab | Pembrolizumab | Ipilimumab |
PD‑L1-positiv | PD‑L1-negativ | |||
Überleben ohne Fortschreiten der Krebserkrankung (PFS) Hazard-Ratio* (95-%-KI) | 0,53 | --- | 0,87 | --- |
Gesamtüberleben (OS) Hazard-Ratio* (95-%-KI) | 0,63 | --- | 0,76 | --- |
ORR % | 40 % | 14 % | 24 % | 13 % |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Ipilimumab) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||||
Melanom des Auges
Bei 20 Patienten mit Melanom des Auges, die in KEYNOTE‑001 eingeschlossen waren, wurde kein objektives Ansprechen berichtet; eine stabile Erkrankung wurde bei 6 Patienten berichtet.
KEYNOTE‑716: Placebokontrollierte Studie zur adjuvanten Behandlung von Patienten mit reseziertem Stadium-IIB- oder -IIC-Melanom
Die Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑716, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie bei Patienten mit reseziertem Stadium-IIB- oder -IIC-Melanom, untersucht. Insgesamt 976 Patienten erhielten randomisiert (1:1) entweder Pembrolizumab 200 mg (oder die bei Kindern und Jugendlichen [im Alter von 12 bis 17 Jahren] empfohlene Dosis von 2 mg/kg KG als intravenöse Gabe [bis zu einem Maximum von 200 mg]) alle drei Wochen (n = 487) oder Placebo (n = 489) bis zu einem Jahr oder bis zum Auftreten eines Rezidivs oder unzumutbarer Toxizität. Die Randomisierung wurde stratifiziert nach Tumorstadium entsprechend der Klassifikation des „American Joint Committee on Cancer“ (AJCC), 8. Auflage. Patienten mit einer aktiven Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, die ein Melanom der Schleimhaut oder des Auges hatten, waren von der Studie ausgeschlossen. Patienten, die außer einer Operation vorher eine andere Therapie des Melanoms erhalten hatten, waren von der Studie ausgeschlossen. Die Patienten unterzogen sich ab Randomisierung bis einschließlich des vierten Jahres alle 6 Monate bildgebender Kontrolle und anschließend einmal im fünften Jahr ab Randomisierung oder bis zum Auftreten eines Rezidivs, je nachdem, was zuerst eintrat.
Die 976 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 61 Jahre (Spanne: 16 – 87 Jahre; 39 % waren 65 Jahre oder älter; zwei jugendliche Patienten [einer je Behandlungsarm]); 60 % waren Männer; und es lag ein ECOG‑Performance‑Status von 0 (93 %) bzw. 1 (7 %) vor. 64 % der Patienten wiesen Tumorstadium IIB und 35 % Tumorstadium IIC auf.
Primärer Wirksamkeitsendpunkt war das vom Prüfarzt beurteilte Rezidivfreie Überleben („recurrence-free survival“ [RFS]) in der Gesamtpopulation. Hierbei war RFS als Zeitraum zwischen Zeitpunkt der Randomisierung und Zeitpunkt des Auftretens des ersten Rezidivs (lokal, regional oder Fernmetastasenbildung) oder Zeitpunkt des Todes definiert, je nachdem welches Ereignis zuerst eintrat. Sekundäre Wirksamkeitsendpunkte waren Fernmetastasenfreies Überleben („distant metastasis-free survival“ [DMFS]) und OS in der Gesamtpopulation. Zum Zeitpunkt dieser Analysen wurde OS nicht formal bewertet. Die Studie zeigte in ihrer präspezifizierten Interimsanalyse zunächst eine statistisch signifikante Verbesserung des RFS (HR 0,65; 95-%-KI: 0,46; 0,92; p‑Wert = 0,00658) für die in den Pembrolizumab-Arm randomisierten Patienten im Vergleich zu Placebo. Die Ergebnisse der präspezifizierten finalen Analyse für RFS nach einer medianen Nachbeobachtungszeit von 20,5 Monaten sind in Tabelle 10 zusammengefasst. Im Vergleich zu Placebo waren die aktualisierten RFS-Ergebnisse nach einer medianen Nachbeobachtungszeit von 38,5 Monaten mit denen der finalen Analyse für RFS bei Patienten, die in den Pembrolizumab-Arm randomisiert wurden, konsistent (HR 0,62; 95-%-KI: 0,49; 0,79) (siehe Abbildung 4). Die Studie zeigte in ihrer präspezifizierten Interimsanalyse bei einer medianen Nachbeobachtungszeit von 26,9 Monaten eine statistisch signifikante Verbesserung des DMFS (HR 0,64; 95-%-KI: 0,47; 0,88; p‑Wert = 0,00292) bei Patienten, die in den Pembrolizumab-Arm randomisiert wurden, im Vergleich zu Placebo. Die Ergebnisse der präspezifizierten finalen Analyse des DMFS bei einer medianen Nachbeobachtungszeit von 38,5 Monaten sind in Tabelle 10 und Abbildung 5 zusammengefasst.
Tabelle 10: Wirksamkeitsergebnisse in KEYNOTE-716
Endpunkt | Pembrolizumab | Placebo |
n = 487 | n = 489 | |
Rezidivfreies Überleben (RFS) | ||
Anzahl (%) Patienten mit Ereignis | 72 (15 %) | 115 (24 %) |
Median in Monaten (95-%-KI) | N.e. (N.e.; N.e.) | N.e. (29,9; N.e.) |
Hazard-Ratio* (95-%-KI) | 0,61 (0,45; 0,82) | |
p-Wert (stratifizierter Log-Rank)† | 0,00046 | |
Fernmetastasenfreies Überleben (DMFS) | ||
Anzahl (%) Patienten mit Ereignis | 74 (15,2 %) | 119 (24,3 %) |
Median in Monaten (95-%-KI) | N.e. (N.e.; N.e.) | N.e. (N.e.; N.e.) |
Hazard-Ratio* (95-%-KI) | 0,59 (0,44; 0,79) | |
* Basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 4: Kaplan-Meier-Kurve des Rezidivfreien Überlebens (RFS) nach Behandlungsarm in KEYNOTE‑716 (Intent-to-Treat-Population)
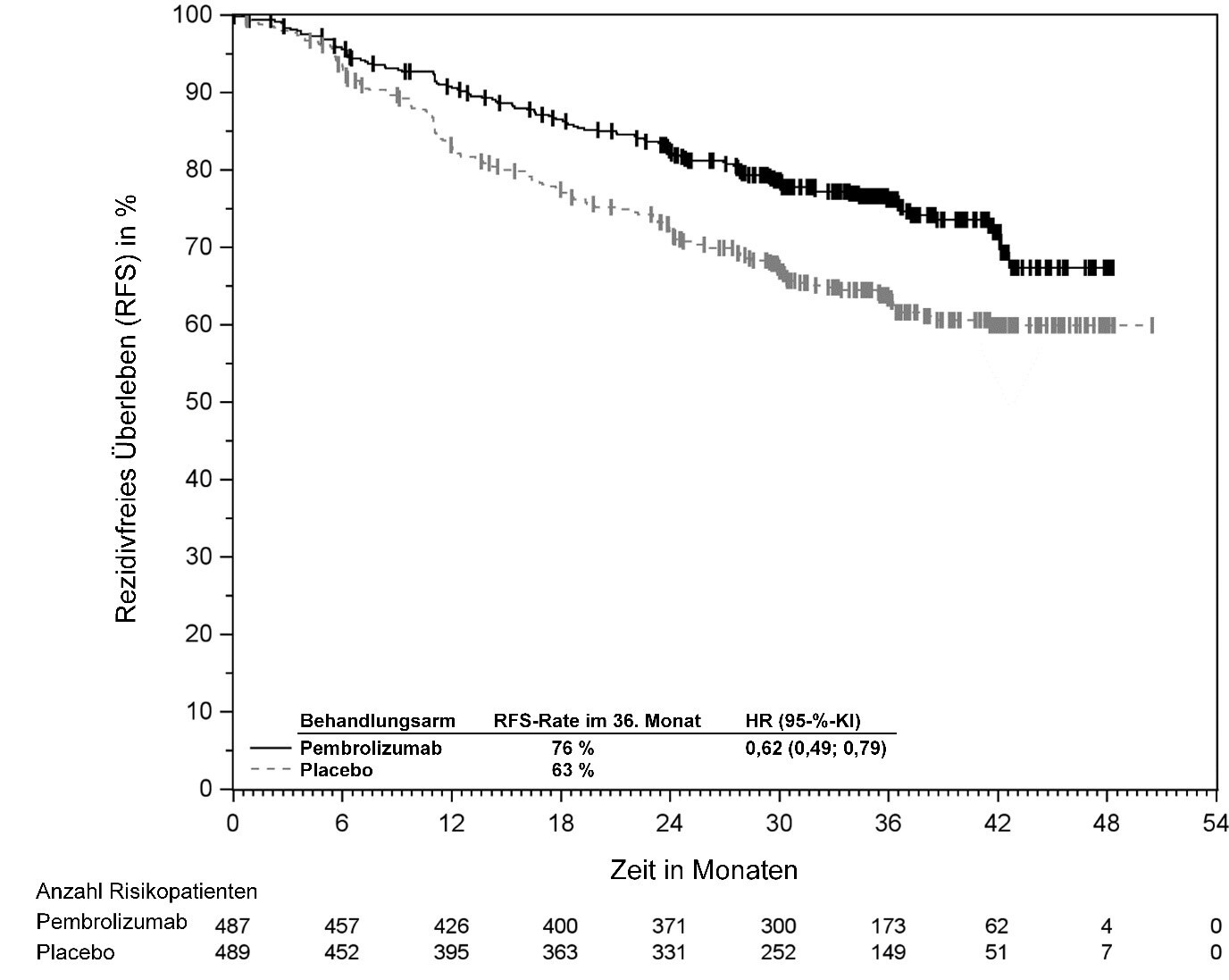
Abbildung 5: Kaplan-Meier-Kurve des Fernmetastasenfreien Überlebens (DMFS) nach Behandlungsarm in KEYNOTE‑716 (Intent-to-Treat-Population)
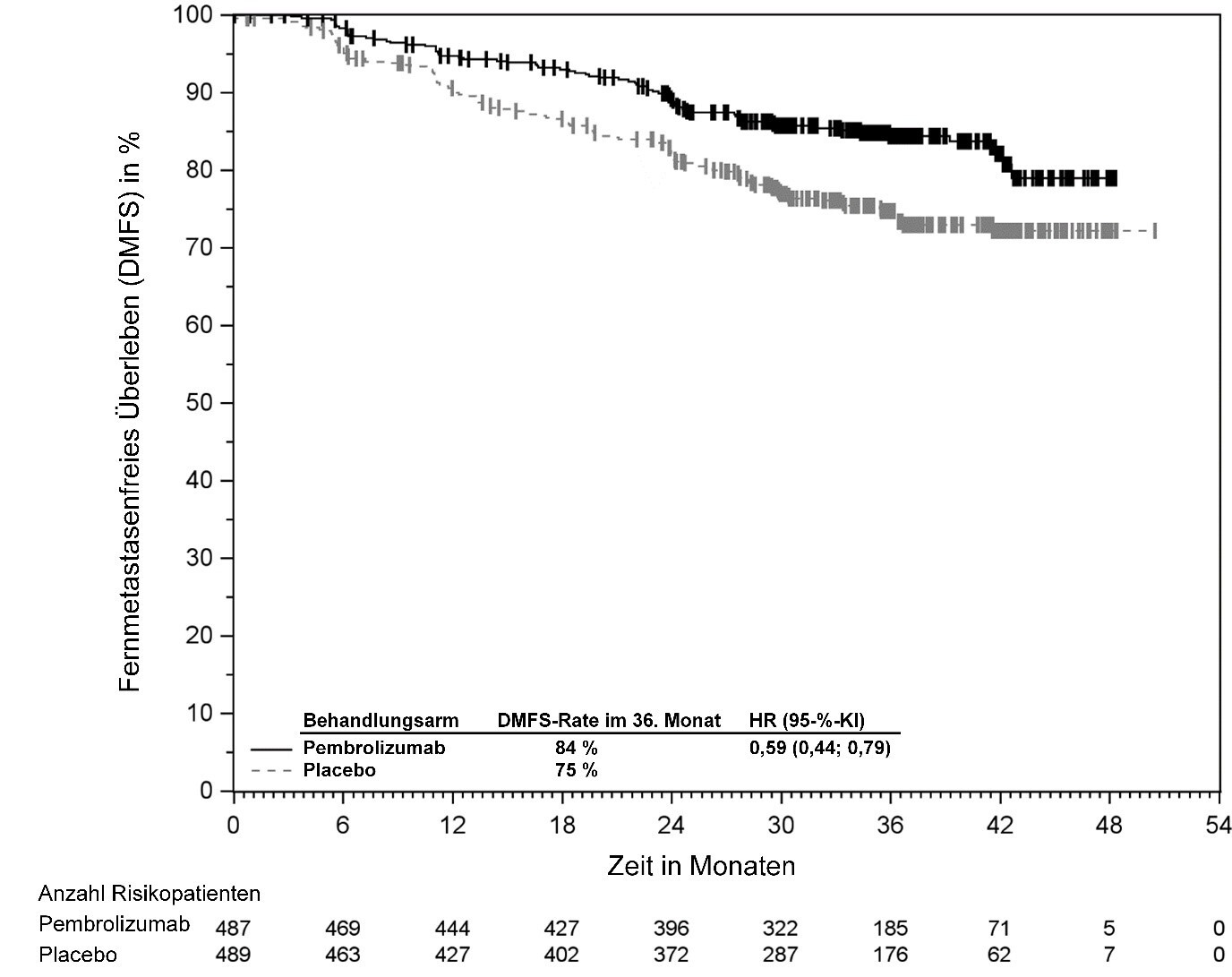
KEYNOTE‑054: Placebokontrollierte Studie zur adjuvanten Behandlung von Patienten mit vollständig reseziertem Stadium-III-Melanom
Die Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑054, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie bei Patienten mit vollständig reseziertem Stadium-IIIA- (> 1 mm Lymphknoten-Metastasen), -IIIB- oder -IIIC-Melanom, untersucht. Insgesamt 1 019 erwachsene Patienten erhielten randomisiert (1:1) entweder Pembrolizumab 200 mg alle drei Wochen (n = 514) oder Placebo (n = 505) bis zu einem Jahr lang oder bis zum Wiederauftreten der Krebserkrankung oder bis zum Auftreten unzumutbarer Toxizität. Die Randomisierung wurde stratifiziert nach Tumorstadium entsprechend der Klassifikation des AJCC, 7. Auflage (IIIA vs. IIIB vs. IIIC 1 – 3 positive Lymphknoten vs. IIIC ≥ 4 positive Lymphknoten) sowie nach geografischer Region (Nordamerika, europäische Länder, Australien sowie andere Länder, wie angegeben). Die Patienten mussten sich einer Lymphknotendissektion unterzogen haben und, falls indiziert, eine Strahlentherapie innerhalb von 13 Wochen vor Beginn der Behandlung erhalten haben. Patienten mit einer aktiven Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, die ein Melanom der Schleimhaut oder des Auges hatten, waren von der Studie ausgeschlossen. Patienten, die außer einer Operation oder einer Interferonbehandlung für dicke primäre Melanome ohne Hinweis auf Lymphknotenbeteiligung vorher eine andere Therapie des Melanoms erhalten hatten, waren von der Studie ausgeschlossen. Die Patienten unterzogen sich nach der ersten Dosis Pembrolizumab in den ersten beiden Jahren alle 12 Wochen bildgebender Kontrolle, anschließend vom dritten bis zum fünften Jahr alle 6 Monate, im Anschluss daran einmal pro Jahr.
Die 1 019 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 54 Jahre (25 % waren 65 Jahre oder älter); 62 % waren Männer; und es lag ein ECOG‑Performance‑Status von 0 (94 %) bzw. 1 (6 %) vor. Bei 16 % der Patienten lag Tumorstadium IIIA; bei 46 % Tumorstadium IIIB; bei 18 % Tumorstadium IIIC (1 – 3 positive Lymphknoten) und bei 20 % Tumorstadium IIIC (≥ 4 positive Lymphknoten) vor; 50 % hatten Tumoren mit BRAF-V600-Mutation und 44 % hatten Tumoren mit BRAF-Wildtyp. Die PD‑L1-Expression wurde retrospektiv mittels eines IHC-Tests mit dem 22C3-Anti-PD‑L1-Antikörper bestimmt; 84 % der Patienten hatten ein PD‑L1-positives Melanom (PD‑L1-Expression bei ≥ 1 % der Tumorzellen und der tumorassoziierten Immunzellen im Verhältnis zu allen lebensfähigen Tumorzellen). Das gleiche Scoring-System wurde im Anwendungsgebiet „metastasierendes Melanom“ angewendet (MEL-Score).
Primärer Wirksamkeitsendpunkt war das vom Prüfarzt beurteilte Rezidivfreie Überleben (RFS) in der Gesamtpopulation und in der Population mit PD‑L1-positiven Tumoren. Hierbei war RFS als Zeitraum zwischen Zeitpunkt der Randomisierung und Zeitpunkt des Auftretens des ersten Rezidivs (lokal, regional oder Fernmetastasenbildung) oder Zeitpunkt des Todes definiert, je nachdem welches Ereignis zuerst eintrat. Sekundäre Wirksamkeitsendpunkte waren Fernmetastasenfreies Überleben (DMFS) und OS in der Gesamtpopulation sowie in der Population mit PD-L1-positiven Tumoren. Zum Zeitpunkt dieser Analysen wurde OS nicht formal bewertet. Die Studie zeigte in ihrer präspezifizierten Interimsanalyse zunächst eine statistisch signifikante Verbesserung des RFS (HR 0,57; 98,4-%-KI: 0,43; 0,74; p‑Wert < 0,0001) für die randomisierten Patienten im Pembrolizumab-Arm im Vergleich zu Placebo. Aktualisierte Wirksamkeitsergebnisse nach einer medianen Nachbeobachtungszeit von 45,5 Monaten sind in Tabelle 11 und in den Abbildungen 6 und 7 zusammengefasst.
Tabelle 11: Wirksamkeitsergebnisse in KEYNOTE‑054
Endpunkt | Pembrolizumab | Placebo |
n = 514 | n = 505 | |
Rezidivfreies Überleben (RFS) | ||
Anzahl (%) Patienten mit Ereignis | 203 (40 %) | 288 (57 %) |
Median in Monaten (95-%-KI) | N.e. | 21,4 (16,3; 27,0) |
Hazard-Ratio* (95-%-KI) | 0,59 (0,49; 0,70) | |
Fernmetastasenfreies Überleben (DMFS) | ||
Anzahl (%) Patienten mit Ereignis | 173 (34 %) | 245 (49 %) |
Median in Monaten (95-%-KI) | N.e. | 40,0 (27,7; N.e.) |
Hazard-Ratio* (95-%-KI) | 0,60 (0,49; 0,73) | |
p-Wert (stratifizierter Log-Rank) | < 0,0001 | |
* Basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 6: Kaplan-Meier-Kurve des Rezidivfreien Überlebens (RFS) nach Behandlungsarm in KEYNOTE‑054 (Intent-to-Treat-Population)
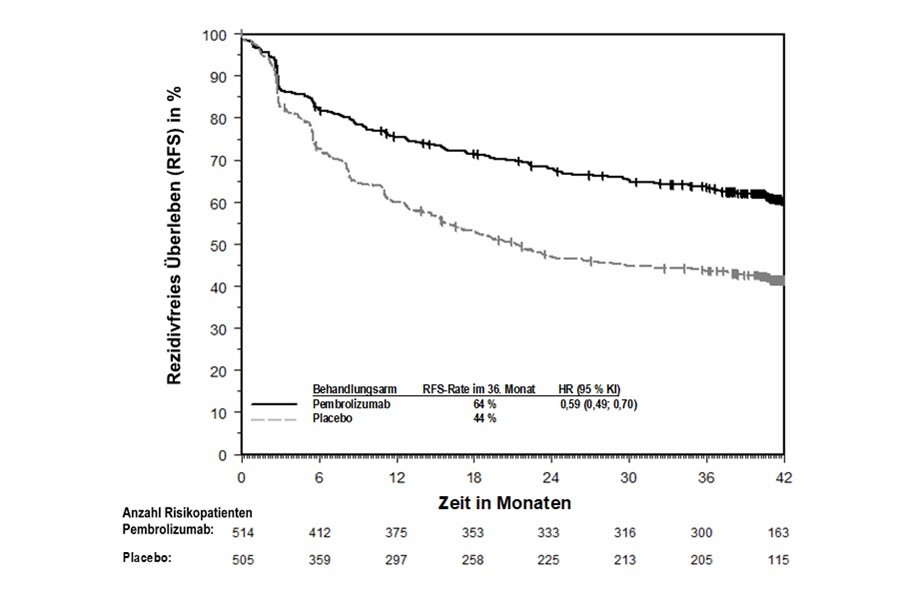
Abbildung 7: Kaplan-Meier-Kurve des Fernmetastasenfreien Überlebens (DMFS) nach Behandlungsarm in KEYNOTE‑054 (Intent-to-Treat-Population)
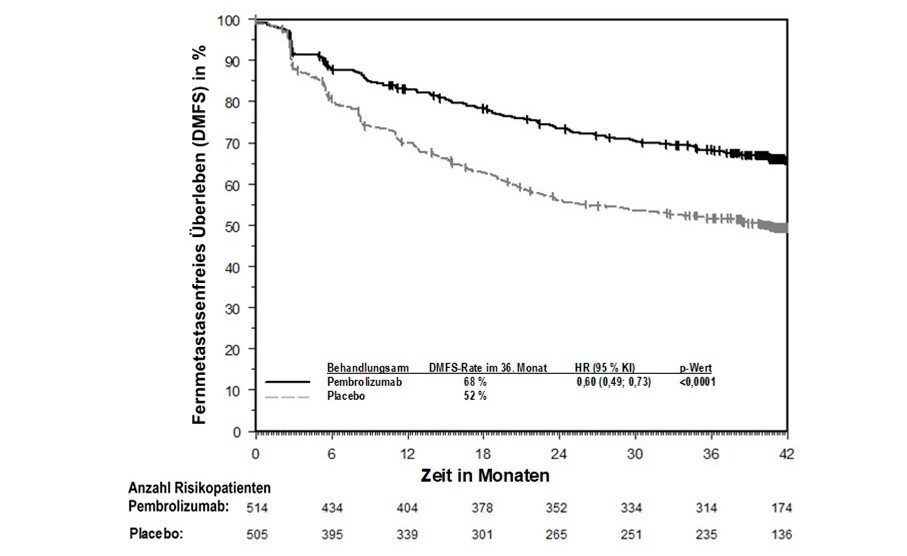
Der Vorteil hinsichtlich Rezidivfreien Überlebens (RFS) sowie Fernmetastasenfreien Überlebens (DMFS) wurde durchgängig in allen Subgruppen, einschließlich PD-L1-Tumorexpression, BRAF-Mutations-Status sowie Erkrankungsstadium nachgewiesen (gemäß AJCC, 7. Auflage). Diese Ergebnisse entsprachen denjenigen einer Post-Hoc-Analyse nach Reklassifizierung gemäß Einstufungs-Kriterien der aktuellen 8. Auflage des AJCC.
Nicht-kleinzelliges Lungenkarzinom
KEYNOTE‑671: Kontrollierte Studie zur neoadjuvanten und adjuvanten Behandlung von Patienten mit resezierbarem nicht-kleinzelligen Lungenkarzinom (NSCLC)
Die Wirksamkeit von Pembrolizumab in Kombination mit Platin-basierter Chemotherapie zur neoadjuvanten und anschließend als Monotherapie zur adjuvanten Behandlung wurde in KEYNOTE‑671, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie, untersucht. Die wichtigsten Einschlusskriterien waren zuvor unbehandelte Patienten mit resezierbarem NSCLC und hohem Rezidivrisiko (Stadium II, IIIA oder IIIB (N2) gemäß AJCC, 8. Ausgabe), ungeachtet der mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmten PD‑L1-Tumorexpression. Tests auf genomische Tumoraberrationen oder onkogene Treibermutationen waren für die Aufnahme in die Studie nicht obligatorisch.
Die folgenden Selektionskriterien definieren Patienten mit hohem Rezidivrisiko, die in das Anwendungsgebiet eingeschlossen sind und die eine Patientenpopulation mit einer Erkrankung des Stadiums II – IIIB (N2) gemäß der 8. Auflage der Stagingkriterien widerspiegeln: Tumorgröße > 4 cm; oder Tumoren jeglicher Größe, mit entweder N1‑ oder N2‑Status; oder Tumoren, die in thorakale Strukturen eindringen (direkt in die Pleura parietalis, die Brustwand, das Zwerchfell, den Nervus phrenicus, die Pleura mediastinalis, das Perikard parietalis, das Mediastinum, das Herz, die großen Gefäße, die Luftröhre, den Nervus laryngeus recurrens, die Speiseröhre, die Wirbelkörper, die Carina); oder Tumoren, die einen Hauptbronchus mit einem Tumor > 4 cm einbeziehen; oder Tumoren > 4 cm, die eine sich bis zum Hilus erstreckende obstruktive Atelektase verursachen; oder Tumoren mit separaten Knoten im selben Lappen oder einem anderen ipsilateralen Lappen als dem Primärlappen.
Falls indiziert, erhielten die Patienten eine adjuvante Strahlentherapie vor der adjuvanten Behandlung mit Pembrolizumab oder Placebo. Patienten mit einer aktiven Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung erfolgte stratifiziert nach Stadium (II vs. III), PD‑L1-Tumorexpression (TPS ≥ 50 % oder < 50 %), Histologie (plattenepithelial vs. nicht-plattenepithelial) und geografischer Region (Ostasien vs. Nicht-Ostasien).
Die Patienten wurden randomisiert (1:1) einem der folgenden Studienarme zugeteilt:
Behandlungsarm A: neoadjuvante Therapie mit Pembrolizumab 200 mg an Tag 1 in Kombination mit Cisplatin 75 mg/m2 und entweder Pemetrexed 500 mg/m2 an Tag 1 oder Gemcitabin 1 000 mg/m2 an den Tagen 1 und 8 eines jeden 21‑tägigen Zyklus für bis zu 4 Zyklen. Im Anschluss an die Operation wurde Pembrolizumab 200 mg alle 3 Wochen für bis zu 13 Zyklen gegeben.
Behandlungsarm B: neoadjuvante Therapie mit Placebo an Tag 1 in Kombination mit Cisplatin 75 mg/m2 und entweder Pemetrexed 500 mg/m2 an Tag 1 oder Gemcitabin 1 000 mg/m2 an den Tagen 1 und 8 eines jeden 21‑tägigen Zyklus für bis zu 4 Zyklen. Im Anschluss an die Operation wurde Placebo alle 3 Wochen für bis zu 13 Zyklen gegeben.
Die Gabe der Studienmedikation erfolgte jeweils als intravenöse Infusion. Die Behandlung mit Pembrolizumab oder Placebo wurde bis zum Abschluss der Behandlung (17 Zyklen), bis zum Fortschreiten der Krebserkrankung, das eine kurative Operation ausschloss, bis zum Auftreten eines Rezidivs in der adjuvanten Phase, bis zum Fortschreiten der Erkrankung bei denjenigen, die nicht operiert wurden oder eine unvollständige Resektion hatten und in die adjuvante Phase eintraten, oder bis zum Auftreten unzumutbarer Toxizität fortgeführt. Eine Bewertung des Tumorstatus erfolgte zu Studienbeginn, in Woche 7 und Woche 13 der neoadjuvanten Phase sowie innerhalb von 4 Wochen vor Beginn der adjuvanten Phase. Nach Beginn der adjuvanten Phase wurde die Bewertung des Tumorstatus alle 16 Wochen bis zum Ende des dritten Jahres und danach alle 6 Monate durchgeführt.
Primäre Wirksamkeitsendpunkte waren OS und das vom Prüfarzt beurteilte Ereignisfreie Überleben („Event Free Survival“ [EFS]). Sekundäre Wirksamkeitsendpunkte waren die pathologische Komplettremissionsrate („pathological Complete Response“ [pCR]‑Rate) und die Rate starken pathologischen Ansprechens („major Pathological Response“ [mPR]‑Rate), die mittels einer verblindeten unabhängigen pathologischen Beurteilung („Blinded Independent Pathology Review“ [BIPR]) bewertet wurden.
Insgesamt wurden 797 Patienten in KEYNOTE‑671 randomisiert: 397 Patienten in den Pembrolizumab-Arm und 400 Patienten in den Placebo-Arm. Zu Studienbeginn waren sie wie folgt charakterisiert: medianes Alter 64 Jahre (Spanne: 26 bis 83 Jahre), 45 % waren 65 Jahre oder älter; 71 % waren Männer; 61 % waren kaukasischer, 31 % asiatischer und 2 % afrikanischer Herkunft. Bei 63 % bzw. 37 % lag ein ECOG‑Performance‑Status von 0 bzw. 1 vor; 30 % wiesen ein Erkrankungsstadium von II und 70 % von III auf; 33 % zeigten einen TPS ≥ 50 % und 67 % einen TPS < 50 %; 43 % hatten Tumoren mit plattenepithelialer Histologie und 57 % mit nicht-plattenepithelialer Histologie; 31 % stammten aus der Region Ostasien. Bei 4 % der Patienten zeigten sich EGFR-Mutationen und bei 66 % war der EGFR-Mutationsstatus unbekannt. Bei 3 % der Patienten lagen ALK-Translokationen vor und bei 68 % war der ALK-Translokationsstatus unbekannt.
Im Behandlungsarm mit Pembrolizumab in Kombination mit Platin-basierter Chemotherapie hatten 81 % der Patienten eine kurative Operation, verglichen mit 76 % der Patienten im Behandlungsarm mit Platin-basierter Chemotherapie.
Die Studie zeigte statistisch signifikante Verbesserungen hinsichtlich OS, EFS, pCR und mPR bei Patienten, die zu Pembrolizumab in Kombination mit Platin-basierter Chemotherapie gefolgt von Pembrolizumab-Monotherapie randomisiert wurden, im Vergleich zu Patienten, die randomisiert Placebo in Kombination mit Platin-basierter Chemotherapie gefolgt von Placebo allein erhielten. Bei einer präspezifizierten Interimsanalyse (mediane Nachbeobachtungszeit von 21,4 Monaten [Spanne: 0,4 bis 50,6 Monate]) lag die EFS‑HR bei 0,58 (95-%-KI: 0,46; 0,72; p‑Wert < 0,0001) bei Patienten, die zu Pembrolizumab in Kombination mit Platin-basierter Chemotherapie gefolgt von Pembrolizumab-Monotherapie randomisiert wurden, im Vergleich zu Patienten, die randomisiert Placebo in Kombination mit Platin-basierter Chemotherapie gefolgt von Placebo allein erhielten. Die OS‑Ergebnisse waren zum Zeitpunkt dieser Analyse noch nicht aussagekräftig.
Tabelle 12 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte zum Zeitpunkt einer präspezifizierten Interimsanalyse bei einer medianen Nachbeobachtungszeit von 29,8 Monaten (Spanne: 0,4 bis 62,0 Monate). Die Kaplan-Meier-Kurven für OS und EFS sind in den Abbildungen 8 und 9 dargestellt.
Tabelle 12: Wirksamkeitsergebnisse in KEYNOTE‑671
Endpunkt | Pembrolizumab mit | Placebo mit |
n = 397 | n = 400 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 110 (28 %) | 144 (36 %) |
Median in Monaten* (95‑%‑KI) | N.e. (N.e.; N.e.) | 52,4 (45,7; N.e.) |
Hazard-Ratio† (95‑%‑KI) | 0,72 (0,56; 0,93) | |
p-Wert‡ | 0,00517 | |
Ereignisfreies Überleben (EFS) | ||
Anzahl (%) Patienten mit Ereignis | 174 (44 %) | 248 (62 %) |
Median in Monaten* (95‑%‑KI) | 47,2 (32,9; N.e.) | 18,3 (14,8; 22,1) |
Hazard-Ratio† (95‑%‑KI) | 0,59 (0,48; 0,72) | |
* Basierend auf Kaplan-Meier-Schätzungen | ||
Abbildung 8: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑671 (Intent-to-Treat-Population)
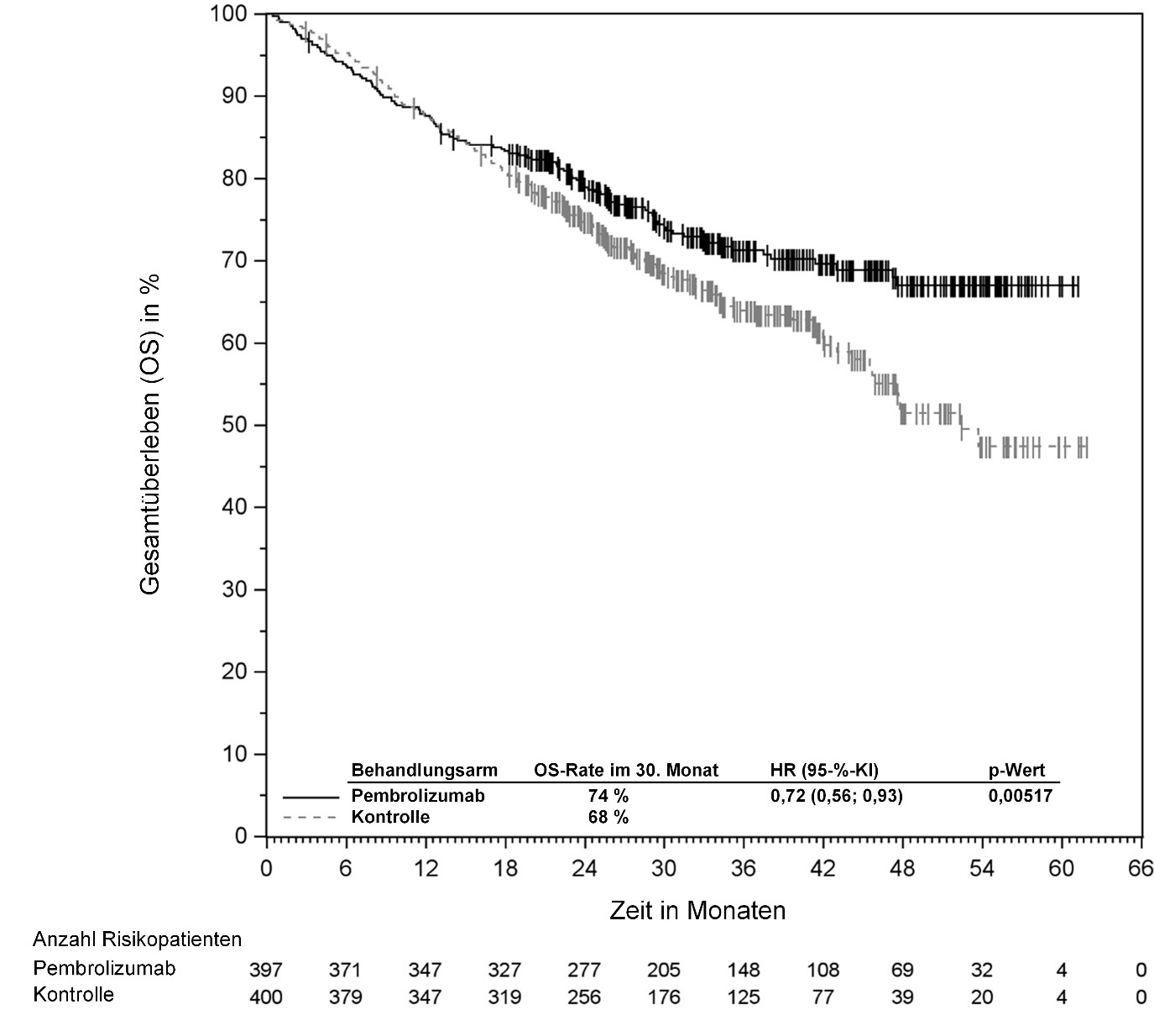
Abbildung 9: Kaplan-Meier-Kurve des Ereignisfreien Überlebens (EFS) nach Behandlungsarm in KEYNOTE‑671 (Intent-to-Treat-Population)
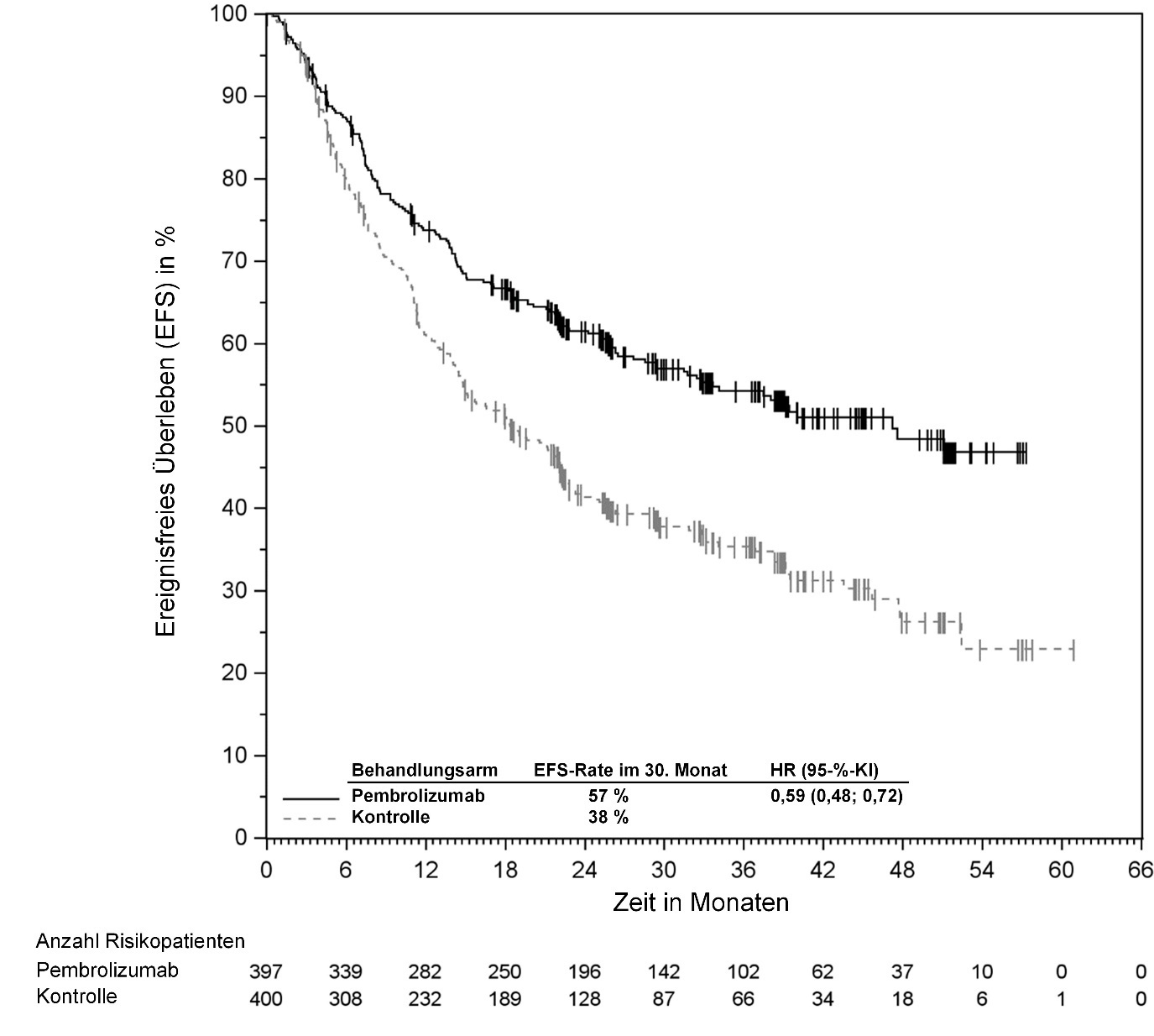
In KEYNOTE‑671 wurde eine explorative Post-hoc-Subgruppenanalyse der Patienten mit PD‑L1-Status mit TPS ≥ 50 % (Pembrolizumab-Arm [n = 132; 33 %] vs. Placebo-Arm [n = 134; 34 %]); TPS = 1 – 49 % (Pembrolizumab-Arm [n = 127; 32 %] vs. Placebo-Arm [n = 115; 29 %]) und TPS < 1 % (Pembrolizumab-Arm [n = 138; 35 %] vs. Placebo-Arm [n = 151; 38 %]) durchgeführt. Die EFS‑HR betrug 0,48 (95-%-KI: 0,33; 0,71) bei Patienten mit einem TPS ≥ 50 %, 0,52 (95-%-KI: 0,36; 0,73) bei Patienten mit einem TPS = 1 – 49 % und 0,75 (95-%-KI: 0,56; 1,01) bei Patienten mit einem TPS < 1 %. Die OS‑HR betrug 0,55 (95-%-KI: 0,33; 0,92) bei Patienten mit einem TPS ≥ 50 %, 0,69 (95-%-KI: 0,44; 1,07) bei Patienten mit einem TPS = 1 – 49 % und 0,91 (95-%-KI: 0,63; 1,32) bei Patienten mit einem TPS < 1 %.
KEYNOTE‑091: Placebokontrollierte Studie zur adjuvanten Behandlung von Patienten mit reseziertem NSCLC
Die Wirksamkeit von Pembrolizumab wurde in KEYNOTE-091, einer multizentrischen, randomisierten, dreifach verblindeten, placebokontrollierten Studie bei Patienten mit NSCLC und hohem Rezidivrisiko (Stadium IB [T2a ≥ 4 cm], II oder IIIA gemäß AJCC, 7. Auflage) nach vollständiger Resektion, unabhängig vom PD-L1-Expressionsstatus des Tumors, untersucht. Die Patienten hatten keine vorhergehende neoadjuvante Strahlentherapie und/oder neoadjuvante Chemotherapie und keine vorhergehende adjuvante Strahlentherapie für den bestehenden Tumor erhalten, eine adjuvante Strahlentherapie war nicht geplant. Tests auf genomische Tumoraberrationen/onkogene Treibermutationen waren für die Aufnahme in die Studie nicht obligatorisch.
Die folgenden Selektionskriterien definieren Patienten mit hohem Rezidivrisiko, die in das Anwendungsgebiet eingeschlossen sind und die eine Patientenpopulation mit einer Erkrankung des Stadiums IB [T2a ≥ 4 cm], II oder IIIA gemäß der 7. Auflage der Stagingkriterien widerspiegeln: Tumorgröße ≥ 4 cm; oder Tumoren jeglicher Größe, mit entweder N1‑ oder N2‑Status; oder Tumoren, die in thorakale Strukturen eindringen (direkt in die Pleura parietalis, die Brustwand, das Zwerchfell, den Nervus phrenicus, die Pleura mediastinalis, das Perikard parietalis, das Mediastinum, das Herz, die großen Gefäße, die Luftröhre, den Nervus laryngeus recurrens, die Speiseröhre, die Wirbelkörper, die Carina); oder Tumoren, die den Hauptbronchus < 2 cm distal der Carina einbeziehen, jedoch ohne Beteiligung der Carina; oder Tumoren, die mit Atelektasen oder obstruktiver Pneumonitis der gesamten Lunge einhergehen; oder Tumoren mit separaten Knoten im selben Lappen oder einem anderen ipsilateralen Lappen als dem Primärlappen. Die Studie inkludierte keine Patienten mit N2‑Status mit Tumoren, die auch das Mediastinum, das Herz, die großen Gefäße, die Luftröhre, den Nervus laryngeus recurrens, die Speiseröhre, die Wirbelkörper, die Carina einbezogen oder die separate Tumorknoten in einem anderen ipsilateralen Lappen aufwiesen.
Die Patienten konnten mit einer adjuvanten Chemotherapie vorbehandelt sein oder nicht, entsprechend der Empfehlung ihres Arztes. Patienten mit einer Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, die mehr als 4 Zyklen adjuvanter Chemotherapie erhalten hatten, waren von der Studie ausgeschlossen. Die Randomisierung erfolgte stratifiziert nach Stadium (IB vs. II vs. IIIA), adjuvanter Chemotherapie (keine adjuvante Chemotherapie vs. adjuvante Chemotherapie), PD‑L1-Status (TPS < 1 % [negativ] vs. TPS 1 – 49 % vs. TPS ≥ 50 %) und geografischer Region (Westeuropa vs. Osteuropa vs. Asien vs. Rest der Welt). Die Patienten erhielten randomisiert (1:1) entweder Pembrolizumab 200 mg (n = 590) oder Placebo (n = 587) intravenös alle 3 Wochen.
Die Behandlung wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten, vom Prüfarzt ermittelten Fortschreiten der Krebserkrankung, Auftreten unzumutbarer Toxizität oder bis zu einer Dauer von ca. einem Jahr (18 Dosen) fortgeführt. Die Patienten unterzogen sich nach der ersten Dosis Pembrolizumab im ersten Jahr alle 12 Wochen bildgebender Kontrolle, anschließend vom zweiten bis zum dritten Jahr alle 6 Monate, im Anschluss daran einmal jährlich bis zum Ende des fünften Jahres. Nach dem fünften Jahr erfolgt die bildgebende Kontrolle entsprechend lokalem Behandlungsstandard.
Von 1 177 randomisierten Patienten erhielten 1 010 (86 %) nach vollständiger Resektion eine adjuvante Platin-basierte Chemotherapie. Diese 1 010 Patienten in KEYNOTE-091 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 64 Jahre (Spanne: 35 bis 84 Jahre), 49 % waren 65 Jahre oder älter; 68 % waren Männer; 77 % waren kaukasischer und 18 % asiatischer Herkunft; 86 % waren aktive oder ehemalige Raucher. Bei 61 % bzw. 39 % lag ein ECOG‑Performance‑Status von 0 bzw. 1 vor. 12 % wiesen ein Erkrankungsstadium von IB (T2a ≥ 4 cm), 57 % von II und 31 % von IIIA auf. 39 % waren PD‑L1‑Nicht‑Exprimierer (TPS < 1 % [negativ]); 33 % zeigten eine PD‑L1-Tumorexpression von TPS 1 – 49 %, 28 % von TPS ≥ 50 %. 7 % hatten bekannte EGFR-Mutationen, 38 % keine EGFR-Mutationen und bei 56 % war der EGFR-Mutationsstatus unbekannt. 52 % stammten aus Westeuropa, 20 % aus Osteuropa, 17 % aus Asien und 11 % aus dem Rest der Welt.
Primäre Wirksamkeitsendpunkte waren das vom Prüfarzt beurteilte Krankheitsfreie Überleben („Disease Free Survival“ [DFS]) in der Gesamtpopulation und in der Population mit einer PD‑L1-Tumorexpression von TPS ≥ 50 %. Hierbei war DFS als Zeitraum zwischen Zeitpunkt der Randomisierung und Zeitpunkt des Auftretens des ersten Rezidivs (lokal, regional oder Fernmetastasenbildung), eines zweiten Tumors oder Zeitpunkt des Todes definiert, je nachdem welches Ereignis zuerst eintrat. Sekundäre Wirksamkeitsendpunkte waren das vom Prüfarzt beurteilte DFS in der Population mit einer PD‑L1-Tumorexpression von TPS ≥ 1 % sowie OS in der Gesamtpopulation und in den Populationen mit einer PD‑L1-Tumorexpression von TPS ≥ 50 % und TPS ≥ 1 %.
Bei einer präspezifizierten Interimsanalyse mit einer medianen Nachbeobachtungszeit von 32,4 Monaten (Spanne: 0,6 bis 68 Monate) zeigte die Studie eine statistisch signifikante Verbesserung des DFS in der Gesamtpopulation (HR = 0,76 [95-%-KI: 0,63; 0,91; p‑Wert = 0,0014]) bei Patienten, die in den Pembrolizumab-Arm randomisiert wurden im Vergleich zu in den Placebo-Arm randomisierten Patienten. Tabelle 13 und Abbildung 10 enthalten eine Zusammenfassung der Wirksamkeitsergebnisse bei finaler Analyse des DFS nach einer medianen Nachbeobachtungszeit von 46,7 Monaten (Spanne: 0,6 bis 84,2 Monate) bei Patienten mit adjuvanter Chemotherapie. Die OS‑Ergebnisse waren zum Zeitpunkt dieser Analyse mit nur 58 % der präspezifizierten OS-Ereignisse in der Gesamtpopulation noch nicht aussagekräftig. Eine explorative Analyse des OS deutete bei Patienten, die eine adjuvante Chemotherapie erhalten haben, auf einen Trend zugunsten von Pembrolizumab mit einer HR von 0,79 (95-%-KI: 0,62; 1,01) im Vergleich zu Placebo hin.
Tabelle 13: Wirksamkeitsergebnisse in KEYNOTE-091 bei Patienten, die eine adjuvante Chemotherapie erhalten haben
Endpunkt | Pembrolizumab | Placebo |
n = 506 | n = 504 | |
Krankheitsfreies Überleben (DFS) | ||
Anzahl (%) Patienten mit Ereignis | 225 (44 %) | 262 (52 %) |
Hazard-Ratio* (95-%-KI) | 0,76 (0,64; 0,91) | |
Median in Monaten (95-%-KI) | 53,8 (46,2; 70,4) | 40,5 (32,9; 47,4) |
* Basierend auf dem multivariaten Cox-Regressionsmodell | ||
Abbildung 10: Kaplan-Meier-Kurve des Krankheitsfreien Überlebens (DFS) nach Behandlungsarm in KEYNOTE‑091 (bei Patienten, die eine adjuvante Chemotherapie erhalten haben)
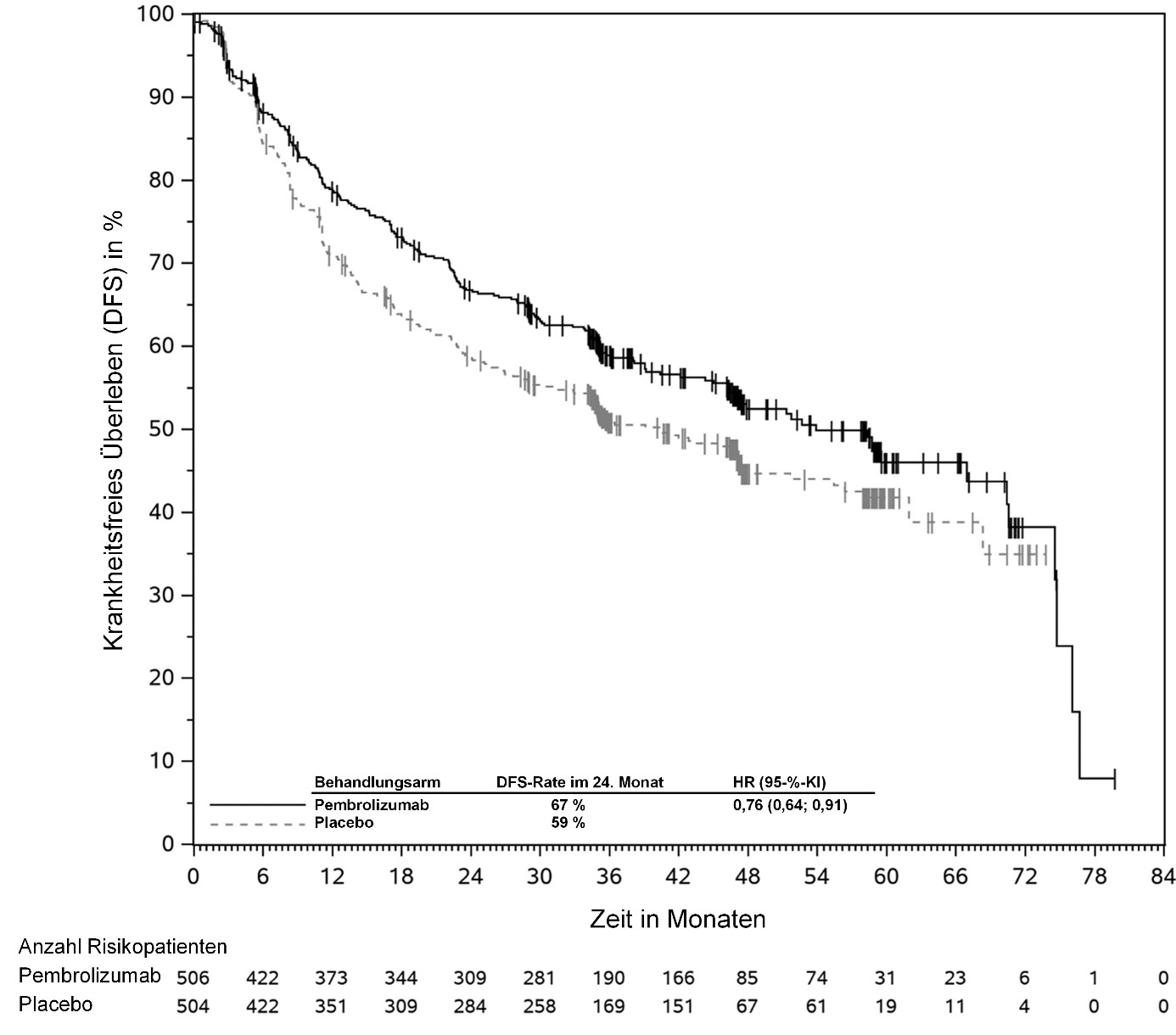
KEYNOTE‑024: Kontrollierte Studie bei nicht-vorbehandelten Patienten mit NSCLC
Die Sicherheit und Wirksamkeit von Pembrolizumab wurde in KEYNOTE-024, einer multizentrischen, offenen, kontrollierten Studie bei nicht-vorbehandelten Patienten mit metastasierendem NSCLC, untersucht. Bei den Patienten lag eine mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmte PD‑L1-Expression mit einem TPS ≥ 50 % („Tumour Proportion Score“ [prozentualer Anteil PD‑L1-positiver Tumorzellen einer Gewebeprobe]) vor.
Die Patienten erhielten randomisiert (1:1) entweder Pembrolizumab in einer Dosierung von 200 mg alle 3 Wochen (n = 154) oder eine vom Prüfarzt ausgewählte Platin-haltige Chemotherapie (n = 151; einschließlich Pemetrexed+Carboplatin, Pemetrexed+Cisplatin, Gemcitabin+Cisplatin, Gemcitabin+Carboplatin oder Paclitaxel+Carboplatin. Patienten mit nicht-plattenepithelialem NSCLC konnten eine Pemetrexed-Erhaltungstherapie bekommen). Die Patienten wurden bis zum Auftreten unzumutbarer Toxizität oder bis zu einem Fortschreiten der Krebserkrankung mit Pembrolizumab behandelt. Die Behandlung konnte bei Fortschreiten der Erkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Patienten ohne Fortschreiten der Krebserkrankung konnten bis zu 24 Monate behandelt werden. Von der Studie ausgeschlossen wurden Patienten mit Tumoren mit aktivierender EGFR-Mutation oder ALK-Translokation; einer Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte; einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, deren thorakale Strahlendosis 30 Gy innerhalb der vorangegangenen 26 Wochen überschritten hatte. Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen. Patienten unter Chemotherapie mit einem von unabhängiger Seite bestätigten Fortschreiten der Krebserkrankung konnten in den Pembrolizumab-Arm wechseln.
Die 305 Patienten in KEYNOTE‑024 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 65 Jahre (54 % waren 65 Jahre oder älter); 61 % waren Männer; 82 % waren kaukasischer und 15 % waren asiatischer Herkunft; ein ECOG-Performance-Status von 0 bzw. 1 lag bei 35 % bzw. 65 % vor. Krankheitsmerkmale waren: NSCLC mit Plattenepithelhistologie (18 %) und Nicht-Plattenepithelhistologie (82 %); das Vorhandensein von Metastasen im M1-Stadium (99 %) sowie das Vorhandensein von Hirnmetastasen (9 %).
Primärer Wirksamkeitsendpunkt war das Überleben ohne Fortschreiten der Krebserkrankung (PFS), bewertet mittels einer verblindeten, unabhängigen und zentralen Beurteilung („Blinded Independent central Review“ [BICR]) gemäß RECIST‑v1.1-Kriterien. Sekundäre Wirksamkeitsendpunkte waren Gesamtüberleben (OS) und Objektive Ansprechrate (ORR) (bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien). Tabelle 14 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte für die gesamte Intent-to-Treat(ITT)-Population. Die Ergebnisse für das Überleben ohne Fortschreiten der Krebserkrankung (PFS) sowie der Objektiven Ansprechrate (ORR) wurden im Rahmen einer Interimsanalyse nach einer medianen Nachbeobachtungszeit von 11 Monaten berichtet. Die Ergebnisse für das Gesamtüberleben (OS) wurden nach finaler Analyse nach einer medianen Nachbeobachtungszeit von 25 Monaten berichtet.
Tabelle 14: Wirksamkeitsergebnisse in KEYNOTE‑024
Endpunkt | Pembrolizumab | Chemotherapie |
n = 154 | n = 151 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 73 (47 %) | 116 (77 %) |
Hazard-Ratio* (95-%-KI) | 0,50 (0,37; 0,68) | |
p-Wert† | < 0,001 | |
Median in Monaten (95-%-KI) | 10,3 (6,7; N.v.) | 6,0 (4,2; 6,2) |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 73 (47 %) | 96 (64 %) |
Hazard-Ratio* (95-%-KI) | 0,63 (0,47; 0,86) | |
p-Wert† | 0,002 | |
Median in Monaten (95-%-KI) | 30,0 | 14,2 |
Objektive Ansprechrate | ||
ORR % (95-%-KI) | 45 % (37; 53) | 28 % (21; 36) |
Vollständiges Ansprechen | 4 % | 1 % |
Partielles Ansprechen | 41 % | 27 % |
Dauer des Ansprechens‡ | ||
Median in Monaten (Spanne) | Nicht erreicht | 6,3 |
% mit einer Dauer ≥ 6 Monaten | 88 %§ | 59 %¶ |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Chemotherapie) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 11: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑024 (Intent-to-Treat-Population)
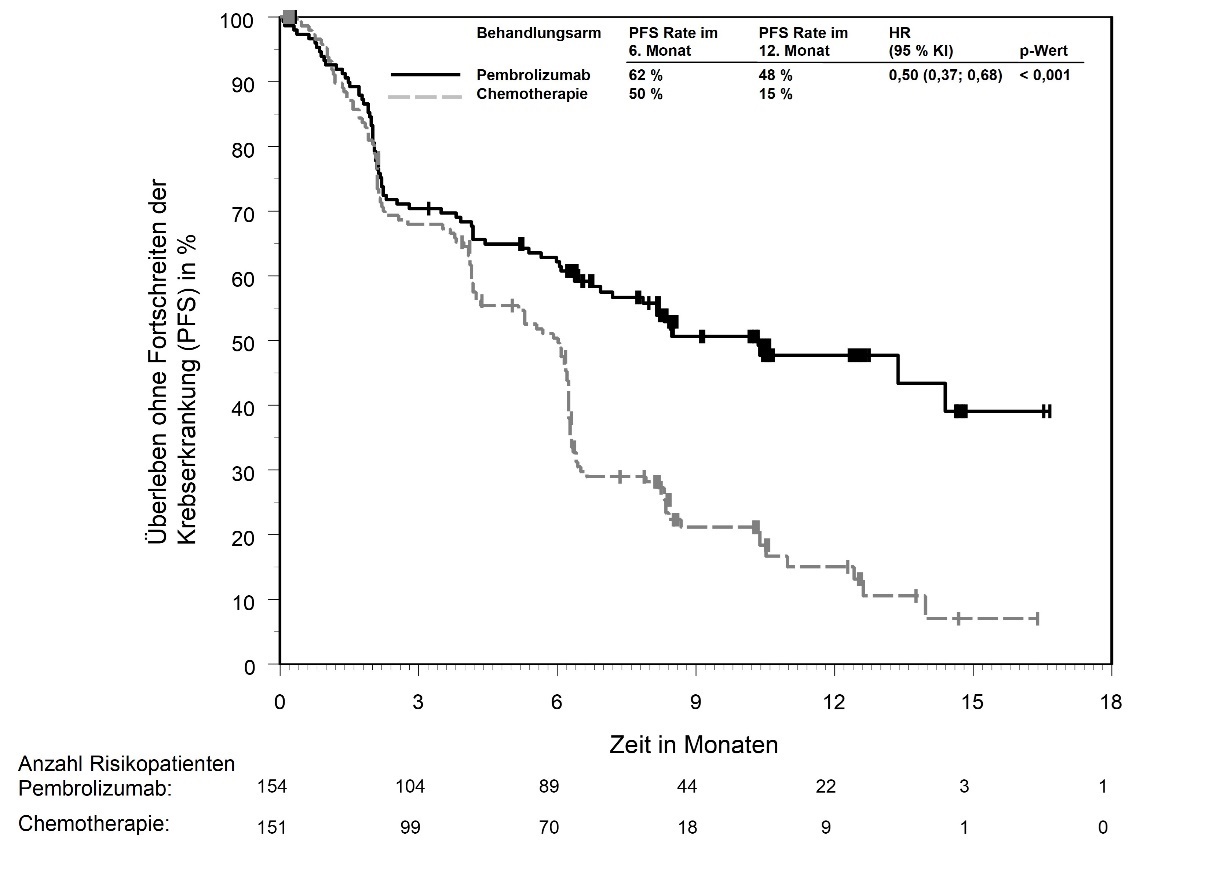
Abbildung 12: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑024 (Intent-to-Treat-Population)
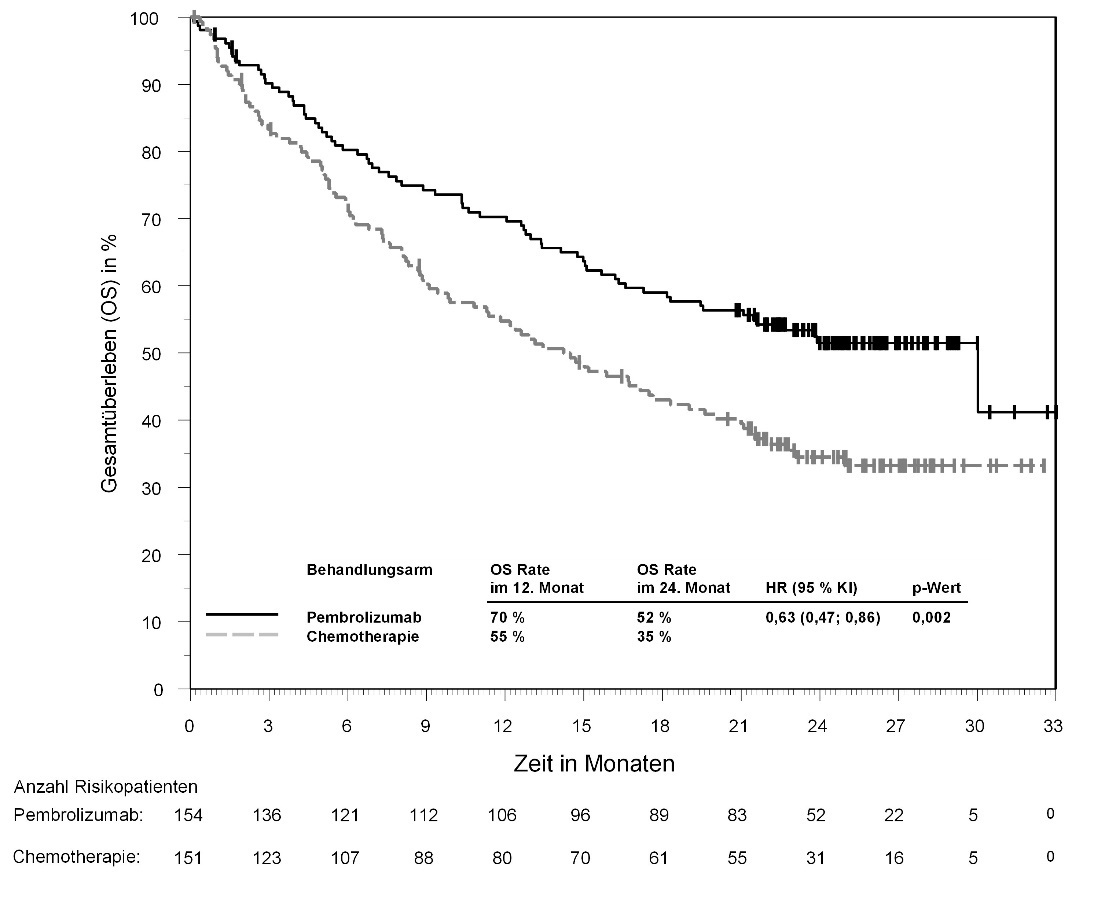
Im Rahmen einer Subgruppenanalyse wurde ein geringerer Überlebensvorteil für Pembrolizumab im Vergleich zu Chemotherapie bei der geringen Anzahl der Patienten, welche nie geraucht hatten, beobachtet. Aufgrund der geringen Anzahl der Patienten können jedoch keine eindeutigen Schlussfolgerungen aus diesen Daten gezogen werden.
KEYNOTE-042: Kontrollierte Studie bei nicht-vorbehandelten Patienten mit NSCLC
Sicherheit und Wirksamkeit von Pembrolizumab wurden ebenfalls in KEYNOTE-042, einer multizentrischen, kontrollierten Studie zur Behandlung nicht-vorbehandelter Patienten mit lokal fortgeschrittenem oder metastasierendem NSCLC, untersucht. Das Studiendesign war dem von KEYNOTE-024 vergleichbar, abgesehen davon, dass bei den Patienten eine mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmte PD‑L1-Expression mit einem TPS ≥ 1 % vorlag. Die Patienten erhielten randomisiert (1:1) entweder Pembrolizumab in einer Dosierung von 200 mg alle 3 Wochen (n = 637) oder eine Platin-haltige Chemotherapie nach Maßgabe des Prüfarztes (n = 637; entweder Pemetrexed+Carboplatin oder Paclitaxel+Carboplatin. Patienten mit nicht-plattenepithelialem NSCLC konnten eine Pemetrexed-Erhaltungstherapie bekommen). Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen in den ersten 45 Wochen, im Anschluss daran alle 12 Wochen.
Von den 1 274 Patienten in KEYNOTE-042 lag bei 599 (47 %) Patienten eine mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmte PD‑L1-Expression der Tumoren mit einem TPS ≥ 50 % vor. Diese 599 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 63 Jahre (45 % waren 65 Jahre oder älter); 69 % waren Männer; 63 % waren kaukasischer und 32 % waren asiatischer Herkunft; 17 % waren hispanischer oder lateinamerikanischer Herkunft; ein ECOG-Performance-Status von 0 bzw. 1 lag bei 31 % bzw. 69 % vor. Krankheitsmerkmale waren: plattenepitheliales NSCLC (37 %) und nicht-plattenepitheliales NSCLC (63 %); Stadium IIIA (0,8 %), Stadium IIIB (9 %), Stadium IV (90 %) sowie das Vorhandensein von behandelten Hirnmetastasen (6 %).
Primärer Wirksamkeitsendpunkt war das Gesamtüberleben (OS). Sekundäre Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Krebserkrankung (PFS) und die Objektive Ansprechrate (ORR) (bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien). Die Studie zeigte eine statistisch signifikante Verbesserung hinsichtlich des Gesamtüberlebens (OS) im Vergleich zu Chemotherapie bei den Patienten im Pembrolizumab-Monotherapie-Arm mit PD‑L1 TPS ≥ 1 % exprimierenden Tumoren (HR 0,82; 95-%-KI: 0,71; 0,93 zum Zeitpunkt der finalen Analyse) sowie bei Patienten im Pembrolizumab-Monotherapie-Arm mit PD‑L1 TPS ≥ 50 % exprimierenden Tumoren. Tabelle 15 enthält eine Zusammenfassung der wichtigsten Wirksamkeitsendpunkte für die TPS ≥ 50 %-Population zum Zeitpunkt der finalen Analyse, nach einer medianen Nachbeobachtungszeit von 15,4 Monaten. Die Kaplan-Meier-Kurve für das Gesamtüberleben (OS) für die TPS ≥ 50 %-Population basierend auf der finalen Analyse ist in Abbildung 13 dargestellt.
Tabelle 15: Wirksamkeitsergebnisse (PD‑L1 TPS ≥ 50 %) in KEYNOTE‑042
Endpunkt | Pembrolizumab | Chemotherapie |
n = 299 | n = 300 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 180 (60 %) | 220 (73 %) |
Hazard-Ratio* (95-%-KI) | 0,70 (0,58; 0,86) | |
p-Wert† | 0,0003 | |
Median in Monaten (95-%-KI) | 20,0 (15,9; 24,2) | 12,2 (10,4; 14,6) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 238 (80 %) | 250 (83 %) |
Hazard-Ratio* (95-%-KI) | 0,84 (0,70; 1,01) | |
Median in Monaten (95-%-KI) | 6,5 (5,9; 8,5) | 6,4 (6,2; 7,2) |
Objektive Ansprechrate (ORR) | ||
ORR % (95-%-KI) | 39 % (34; 45) | 32 % (27; 38) |
Vollständiges Ansprechen | 1 % | 0,3 % |
Partielles Ansprechen | 38 % | 32 % |
Dauer des Ansprechens‡ | ||
Median in Monaten (Spanne) | 22,0 (2,1+; 36,5+) | 10,8 (1,8+; 30,4+) |
% mit einer Dauer ≥ 18 Monaten | 57 % | 34 % |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Chemotherapie) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 13: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑042 (Patienten mit PD‑L1 Expression TPS ≥ 50 %; Intent-to-Treat-Population)
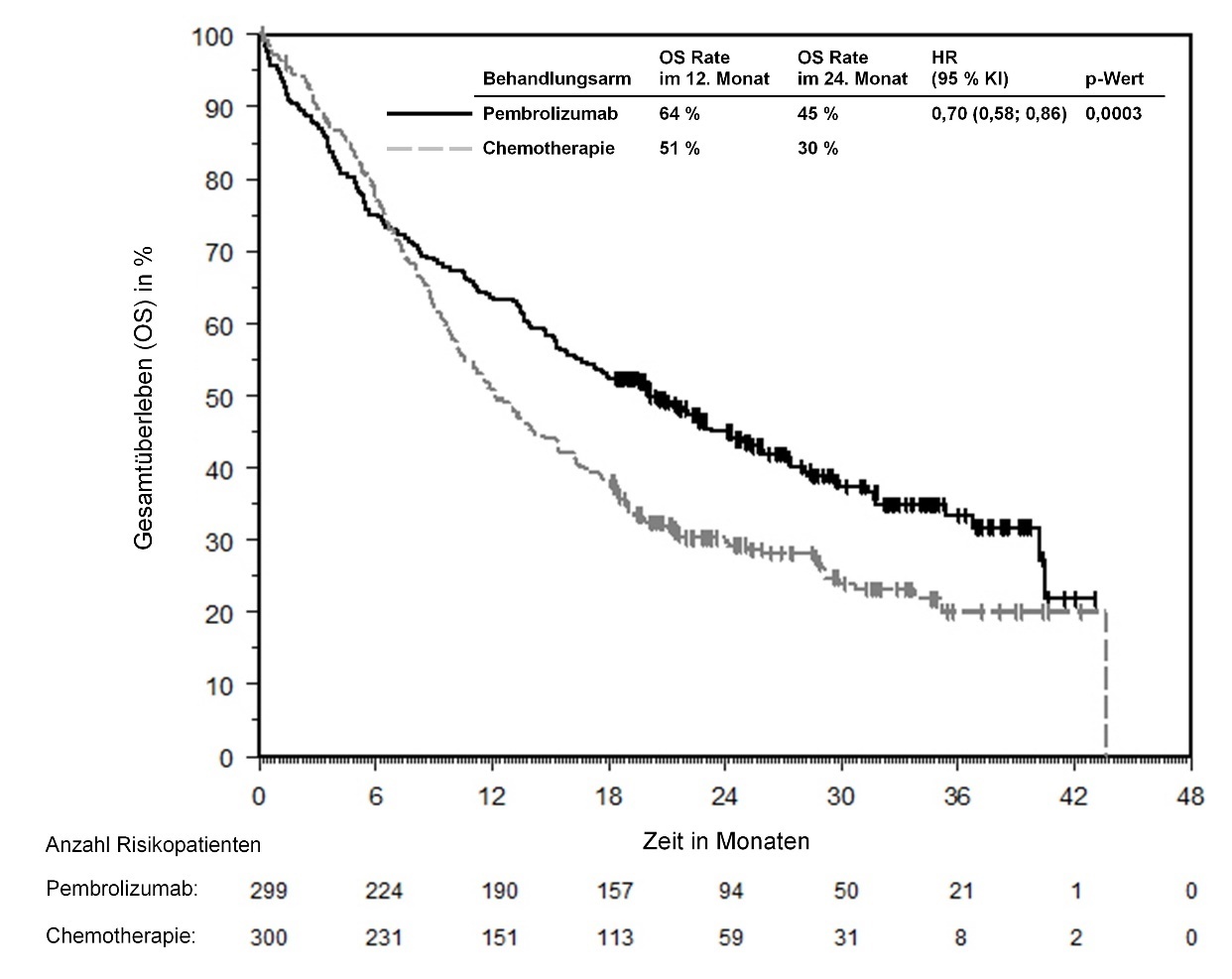
Die Ergebnisse einer explorativen Post-hoc-Subgruppenanalyse deuteten für Patienten, die nie geraucht haben, auf einen Trend in Richtung eines geringeren Überlebensvorteils für Pembrolizumab im Vergleich zu Chemotherapie hin, sowohl während der ersten 4 Monate als auch über die gesamte Behandlungsdauer. Jedoch können aufgrund des explorativen Charakters dieser Subgruppenanalyse keine eindeutigen Schlussfolgerungen gezogen werden.
KEYNOTE‑189: Kontrollierte Studie einer Kombinationstherapie bei nicht-vorbehandelten Patienten mit nicht-plattenepithelialem NSCLC
Die Wirksamkeit von Pembrolizumab in Kombination mit Pemetrexed und Platin-Chemotherapie wurde im Rahmen der multizentrischen, randomisierten, aktiv-kontrollierten, doppelblinden Studie KEYNOTE‑189 untersucht. Die wichtigsten Einschlusskriterien waren metastasierendes nicht-plattenepitheliales NSCLC, keine vorhergehende systemische Therapie des metastasierenden NSCLC sowie keine EGFR- oder ALK-genomischen Tumoraberrationen. Patienten mit einer Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte; einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, deren thorakale Strahlendosis 30 Gy innerhalb der vorangegangenen 26 Wochen überschritten hatte, waren von der Studie ausgeschlossen. Die Patienten erhielten randomisiert (2:1) eines der folgenden Therapie-Regime:
Pembrolizumab 200 mg mit Pemetrexed 500 mg/m2 sowie nach Maßgabe des Prüfarztes entweder Cisplatin 75 mg/m2 oder Carboplatin AUC 5 mg/ml/min intravenös alle 3 Wochen für 4 Zyklen, gefolgt von Pembrolizumab 200 mg und Pemetrexed 500 mg/m2 intravenös alle 3 Wochen (n = 410);
Placebo mit Pemetrexed 500 mg/m2 sowie nach Maßgabe des Prüfarztes entweder Cisplatin 75 mg/m2 oder Carboplatin AUC 5 mg/ml/min intravenös alle 3 Wochen für 4 Zyklen, gefolgt von Placebo und Pemetrexed 500 mg/m2 intravenös alle 3 Wochen (n = 206).
Die Behandlung mit Pembrolizumab wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten, vom Prüfarzt ermittelten Fortschreiten der Krebserkrankung, Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Gabe von Pembrolizumab konnte bei mittels BICR gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung oder nach Abbruch von Pemetrexed fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Bei Patienten, die 24 Monate behandelt wurden oder bei denen vollständiges Ansprechen vorlag, konnte die Behandlung mit Pembrolizumab bei Fortschreiten der Krebserkrankung wieder aufgenommen und bis zu einem weiteren Jahr fortgeführt werden. Eine Bewertung des Tumorstatus erfolgte nach 6 Wochen sowie nach 12 Wochen und im Anschluss daran alle 9 Wochen. Patienten unter Placebo plus Chemotherapie, die ein von unabhängiger Seite bestätigtes Fortschreiten ihrer Krebserkrankung aufwiesen, konnten, wenn gewünscht, Pembrolizumab als Monotherapie erhalten.
Die 616 Patienten in KEYNOTE‑189 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 64 Jahre (49 % waren 65 Jahre oder älter); 59 % waren Männer; 94 % waren kaukasischer und 3 % asiatischer Herkunft; bei 43 % bzw. 56 % lag ein ECOG‑Performance‑Status von 0 bzw. 1 vor; 31 % waren PD‑L1‑Nicht‑Exprimierer (TPS < 1 %); und 18 % hatten zu Studienbeginn behandelte oder unbehandelte Hirnmetastasen.
Die primären Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) (mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens, die mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurden. Tabelle 16 enthält eine Zusammenfassung der wichtigsten Wirksamkeitsendpunkte und in den Abbildungen 14 und 15 sind die Kaplan-Meier-Kurven für OS und PFS basierend auf der finalen Analyse nach einer medianen Nachbeobachtungszeit von 18,8 Monaten dargestellt.
Tabelle 16: Wirksamkeitsergebnisse in KEYNOTE‑189
Endpunkt | Pembrolizumab + | Placebo + |
Gesamtüberleben (OS)* | ||
Anzahl (%) Patienten mit Ereignis | 258 (63 %) | 163 (79 %) |
Hazard-Ratio† (95-%-KI) | 0,56 (0,46; 0,69) | |
p-Wert‡ | < 0,00001 | |
Median in Monaten (95-%-KI) | 22,0 | 10,6 |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 337 (82 %) | 197 (96 %) |
Hazard-Ratio† (95-%-KI) | 0,49 (0,41; 0,59) | |
p-Wert‡ | < 0,00001 | |
Median in Monaten (95-%-KI) | 9,0 | 4,9 |
Objektive Ansprechrate | ||
ORR§ % (95-%-KI) | 48 % (43; 53) | 20 % (15; 26) |
Vollständiges Ansprechen | 1,2 % | 0,5 % |
Partielles Ansprechen | 47 % | 19 % |
p-Wert¶ | < 0,0001 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 12,5 | 7,1 |
% mit einer Dauer ≥ 12 Monaten# | 53 % | 27 % |
* Insgesamt wechselten 113 Patienten (57 %) des Placebo-plus-Chemotherapie-Arms nach Abbruch der Studienmedikation zu einer Pembrolizumab-Monotherapie oder erhielten einen Checkpoint-Inhibitor als Folgetherapie | ||
Abbildung 14: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑189 (Intent-to-Treat-Population)
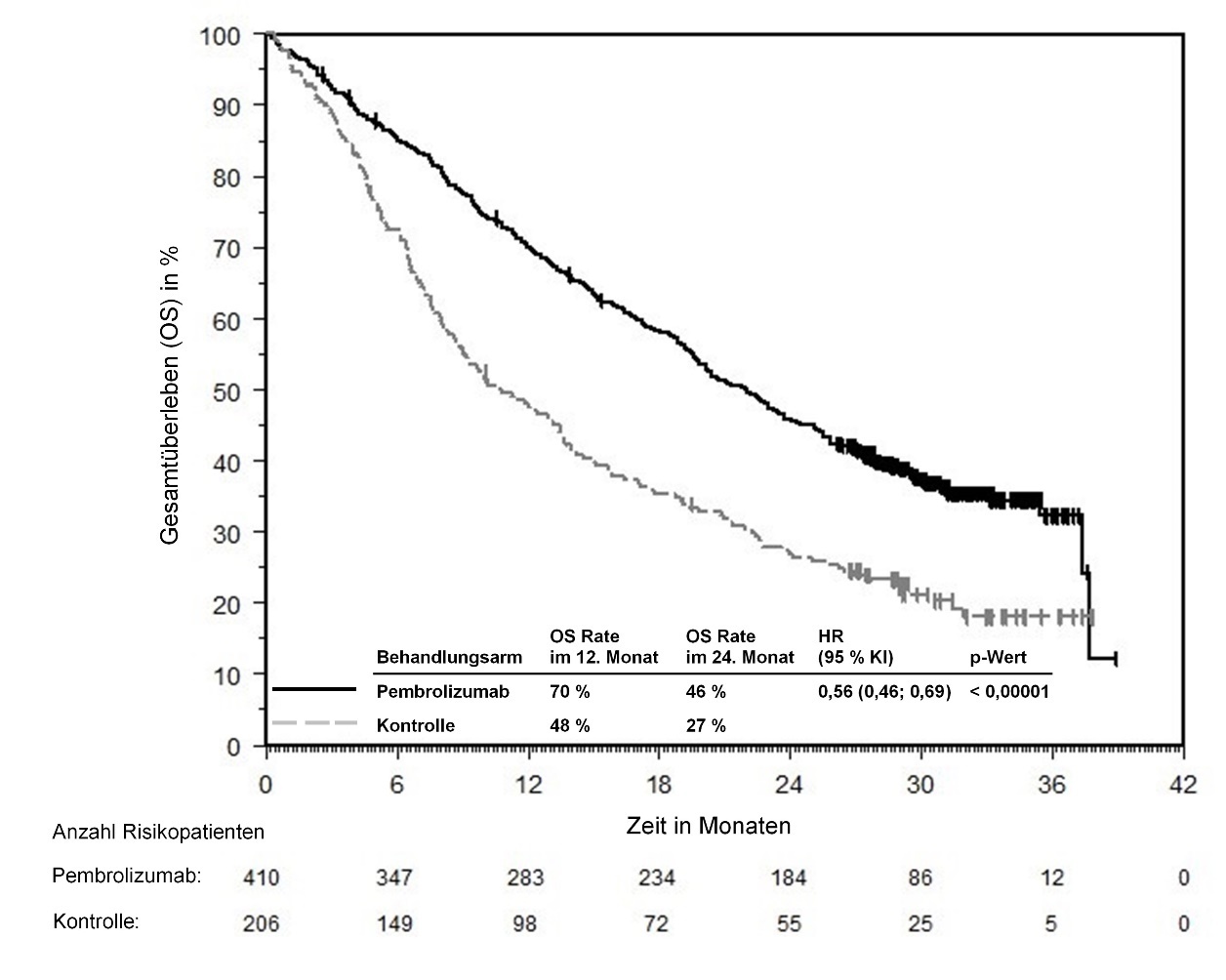
Abbildung 15: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑189 (Intent-to-Treat-Population)
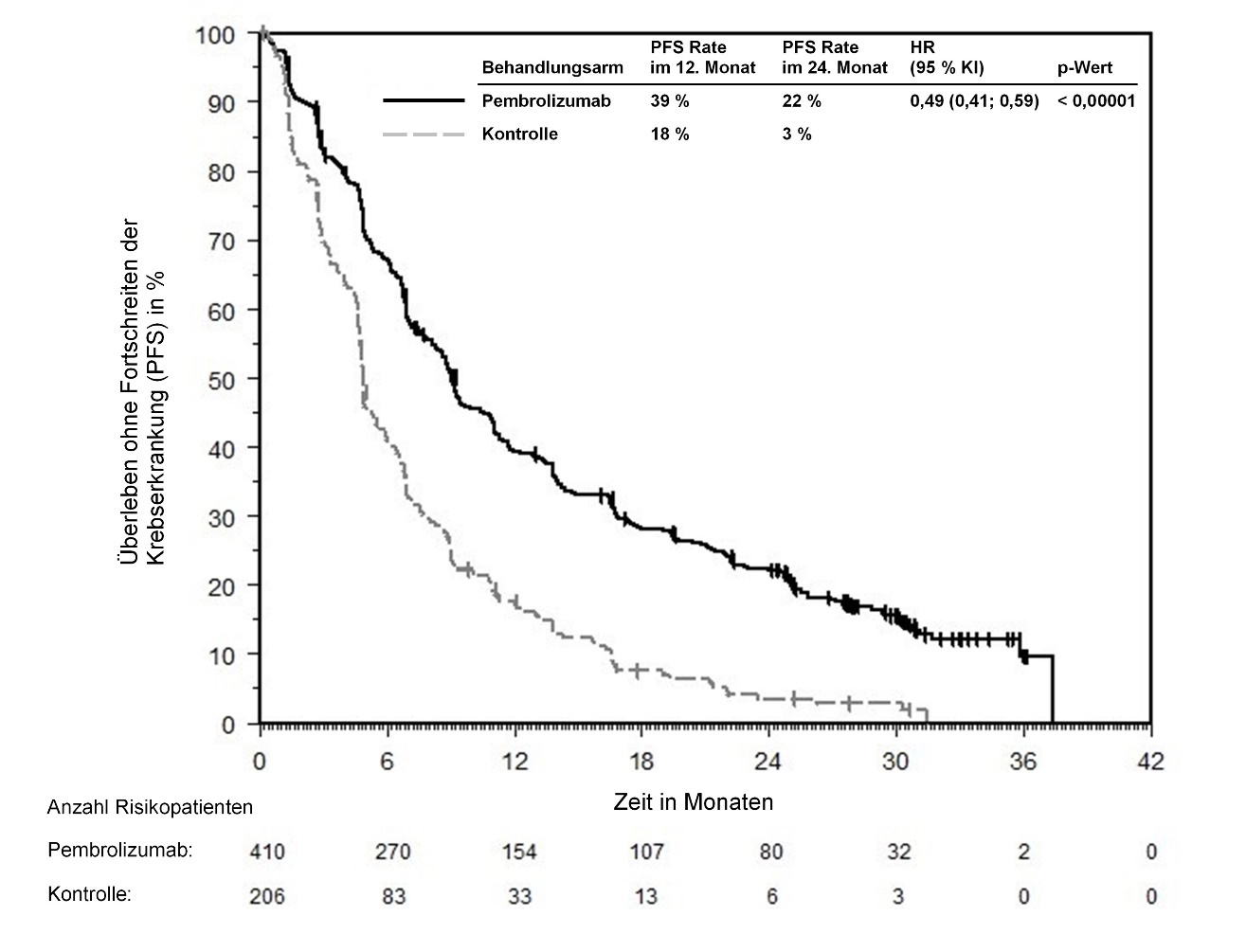
In KEYNOTE‑189 wurde eine Analyse der Patienten nach PD‑L1-Status mit TPS < 1 % [Pembrolizumab-Kombination: n = 127 (31 %) vs. Chemotherapie: n = 63 (31 %)], mit TPS 1 – 49 % [Pembrolizumab-Kombination: n = 128 (31 %) vs. Chemotherapie: n = 58 (28 %)] oder mit TPS ≥ 50 % [Pembrolizumab-Kombination: n = 132 (32 %) vs. Chemotherapie: n = 70 (34 %)] durchgeführt (siehe Tabelle 17).
Tabelle 17: Wirksamkeitsergebnisse entsprechend PD‑L1-Expression in KEYNOTE‑189*
Endpunkt | Pembrolizumab-Kombinationstherapie | Chemotherapie | Pembrolizumab-Kombinationstherapie | Chemotherapie | Pembrolizumab-Kombinationstherapie | Chemotherapie |
TPS < 1 % | TPS 1 – 49 % | TPS ≥ 50 % | ||||
Gesamtüberleben (OS) Hazard-Ratio† (95-%-KI) | 0,51 (0,36; 0,71) | 0,66 (0,46; 0,96) | 0,59 (0,40; 0,86) | |||
Überleben ohne Fortschreiten der Krebserkrankung (PFS) Hazard-Ratio† (95-%-KI) | 0,67 (0,49; 0,93) | 0,53 (0,38; 0,74) | 0,35 (0,25; 0,49) | |||
ORR % | 33 % | 14 % | 50 % | 21 % | 62 % | 26 % |
* Basierend auf der finalen Analyse | ||||||
Zum Zeitpunkt der finalen Analyse waren insgesamt 57 Patienten mit NSCLC im Alter von ≥ 75 Jahren in die Studie KEYNOTE‑189 eingeschlossen (35 Patienten im Pembrolizumab-Kombinations-Arm und 22 Patienten im Kontroll-Arm). In dieser Studiensubgruppe wurde für das Gesamtüberleben (OS) eine Hazard-Ratio = 1,54 [95-%-KI: 0,76; 3,14] und für das Überleben ohne Fortschreiten der Krebserkrankung (PFS) eine Hazard-Ratio = 1,12 [95-%-KI: 0,56; 2,22] unter Pembrolizumab-Kombinationstherapie vs. Chemotherapie berichtet. Die Daten hinsichtlich Wirksamkeit von Pembrolizumab in Kombination mit einer Platin-Chemotherapie sind bei dieser Patientenpopulation begrenzt.
KEYNOTE‑407: Kontrollierte Studie einer Kombinationstherapie bei nicht-vorbehandelten Patienten mit plattenepithelialem NSCLC
Die Wirksamkeit von Pembrolizumab in Kombination mit Carboplatin und entweder Paclitaxel oder nab-Paclitaxel wurde im Rahmen der randomisierten, doppelblinden, multizentrischen, placebokontrollierten Studie KEYNOTE‑407 untersucht. Die wichtigsten Einschlusskriterien der Studie waren metastasierendes plattenepitheliales NSCLC ungeachtet des PD‑L1-Expressions-Status der Tumoren sowie keine vorhergehende systemische Therapie der metastasierenden Erkrankung. Patienten mit einer Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, deren thorakale Strahlendosis 30 Gy innerhalb der vorangegangenen 26 Wochen überschritten hatte, waren von der Studie ausgeschlossen. Die Randomisierung wurde stratifiziert nach Tumor PD‑L1-Expression (TPS < 1 % [negativ] vs. TPS ≥ 1 %), Paclitaxel oder nab-Paclitaxel nach Maßgabe des Prüfarztes und geografischer Region (Ostasien vs. Nicht-Ostasien). Die Patienten wurden randomisiert (1:1) einem der folgenden Studienarme zur Behandlung mittels intravenöser Infusion zugeteilt:
Pembrolizumab 200 mg und Carboplatin AUC 6 mg/ml/min an Tag 1 jedes 21‑Tage-Zyklus für 4 Zyklen sowie Paclitaxel 200 mg/m2 an Tag 1 jedes 21‑Tage-Zyklus für 4 Zyklen oder nab-Paclitaxel 100 mg/m2 an Tag 1, Tag 8 und Tag 15 jedes 21‑Tage-Zyklus für 4 Zyklen, gefolgt von Pembrolizumab 200 mg alle 3 Wochen. Pembrolizumab wurde vor der Chemotherapie an Tag 1 gegeben.
Placebo und Carboplatin AUC 6 mg/ml/min an Tag 1 jedes 21‑Tage-Zyklus für 4 Zyklen sowie Paclitaxel 200 mg/m2 an Tag 1 jedes 21‑Tage-Zyklus für 4 Zyklen oder nab-Paclitaxel 100 mg/m2 an Tag 1, Tag 8 und Tag 15 jedes 21‑Tage-Zyklus für 4 Zyklen, gefolgt von Placebo alle 3 Wochen.
Die Behandlung mit Pembrolizumab oder Placebo wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten und mittels BICR ermittelten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Gabe von Pembrolizumab konnte bei gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte.
Patienten mit einem Fortschreiten ihrer Krebserkrankung im Placeboarm erhielten optional Pembrolizumab als Monotherapie.
Eine Bewertung des Tumorstatus erfolgte alle 6 Wochen bis Woche 18, alle 9 Wochen bis Woche 45 und im Anschluss daran alle 12 Wochen.
Insgesamt wurden 559 Patienten randomisiert. Die Studienpopulation war wie folgt charakterisiert: medianes Alter 65 Jahre (Spanne: 29 bis 88 Jahre); 55 % waren 65 Jahre oder älter; 81 % waren Männer; 77 % waren kaukasischer Herkunft; bei 29 % bzw. 71 % lag ein ECOG‑Performance‑Status von 0 bzw. 1 vor; und 8 % hatten zu Studienbeginn behandelte Hirnmetastasen. 35 % waren PD‑L1‑Nicht‑Exprimierer (TPS < 1 % [negativ]); 19 % waren ostasiatischer Herkunft; und 60 % erhielten Paclitaxel.
Die primären Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) (mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens, die mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurden. Tabelle 18 enthält eine Zusammenfassung der wichtigsten Wirksamkeitsendpunkte und in den Abbildungen 16 und 17 sind die Kaplan-Meier-Kurven für das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) basierend auf der finalen Analyse nach einer medianen Nachbeobachtungszeit von 14,3 Monaten dargestellt.
Tabelle 18: Wirksamkeitsergebnisse in KEYNOTE‑407
Endpunkt | Pembrolizumab | Placebo |
Gesamtüberleben (OS)* | ||
Anzahl (%) Patienten mit Ereignis | 168 (60 %) | 197 (70 %) |
Median in Monaten (95-%-KI) | 17,1 | 11,6 |
Hazard-Ratio† (95-%-KI) | 0,71 (0,58; 0,88) | |
p-Wert‡ | 0,0006 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 217 (78 %) | 252 (90 %) |
Median in Monaten (95-%-KI) | 8,0 | 5,1 |
Hazard-Ratio† (95-%-KI) | 0,57 (0,47; 0,69) | |
p-Wert‡ | < 0,0001 | |
Objektive Ansprechrate | ||
ORR % (95-%-KI) | 63 % (57; 68) | 38 % (33; 44) |
Vollständiges Ansprechen | 2,2 % | 3,2 % |
Partielles Ansprechen | 60 % | 35 % |
p-Wert§ | < 0,0001 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 8,8 | 4,9 |
% mit einer Dauer ≥ 12 Monaten¶ | 38 % | 25 % |
* Insgesamt wechselten 138 Patienten (51 %) des Placebo-plus-Chemotherapie-Arms nach Abbruch der Studienmedikation zu einer Pembrolizumab-Monotherapie oder erhielten einen Checkpoint-Inhibitor als Folgetherapie | ||
Abbildung 16: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) in KEYNOTE-407
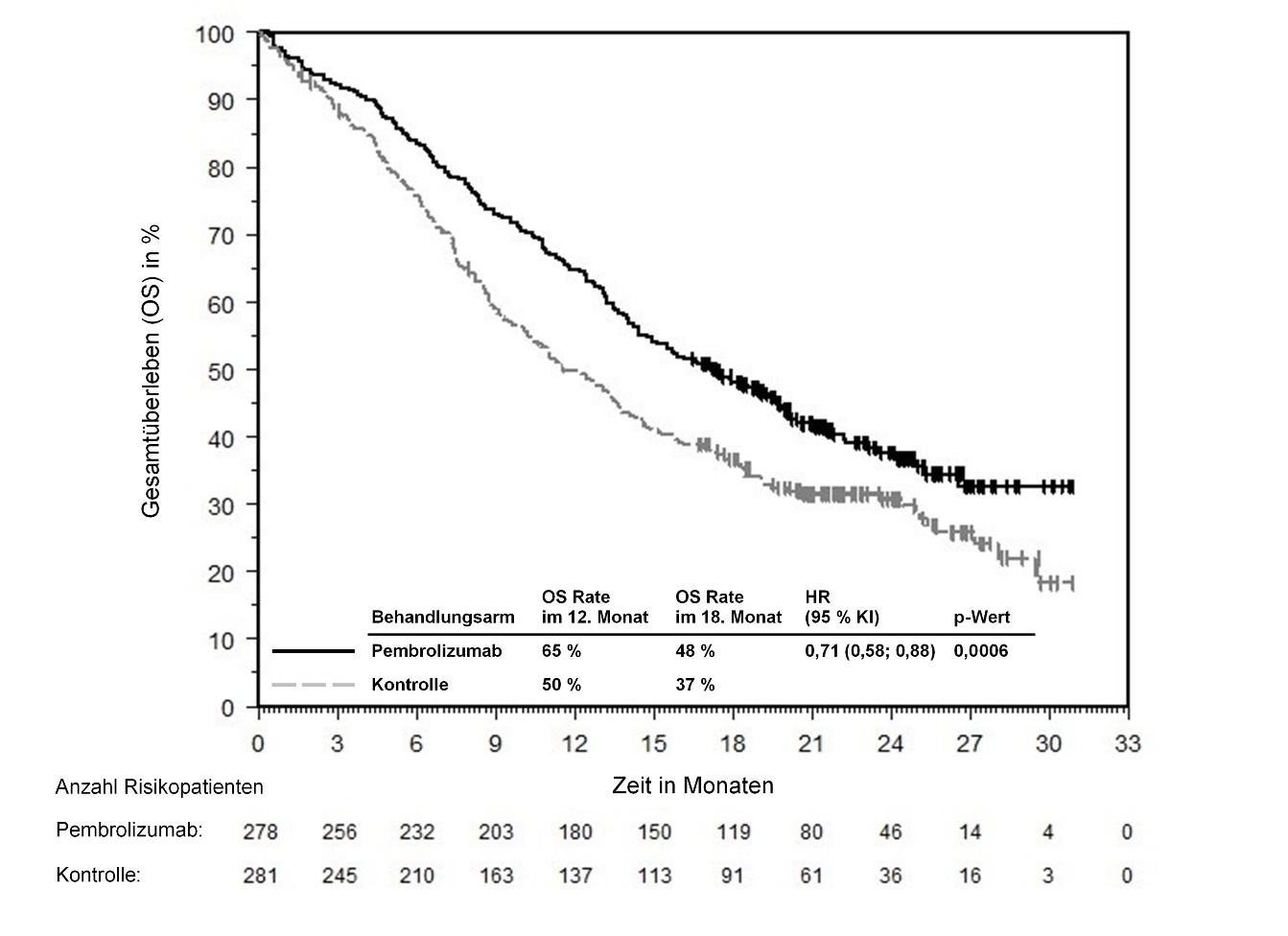
Abbildung 17: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) in KEYNOTE‑407
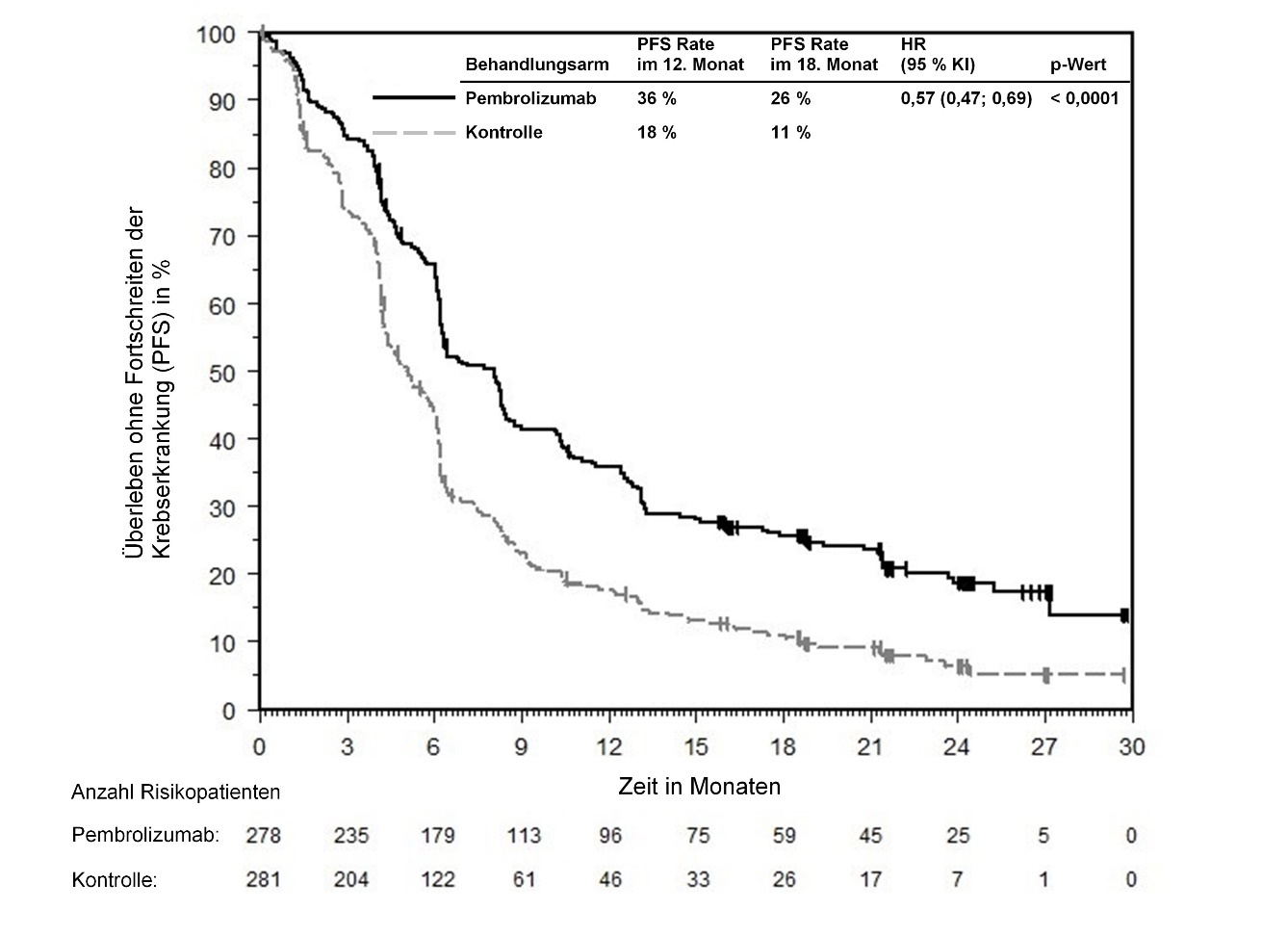
In KEYNOTE‑407 wurde eine Analyse der Patienten nach PD‑L1-Status mit TPS < 1 % [Pembrolizumab-Kombinationstherapie-Arm: n = 95 (34 %) vs. Chemotherapie-Arm: n = 99 (35 %)], mit TPS 1 – 49 % [Pembrolizumab-Kombinationstherapie-Arm: n = 103 (37 %) vs. Chemotherapie-Arm: n = 104 (37 %)] oder mit TPS ≥ 50 % [Pembrolizumab-Kombinationstherapie-Arm: n = 73 (26 %) vs. Chemotherapie-Arm: n = 73 (26 %)] durchgeführt (siehe Tabelle 19).
Tabelle 19: Wirksamkeitsergebnisse entsprechend PD‑L1-Expression in KEYNOTE‑407*
Endpunkt | Pembrolizumab-Kombinationstherapie | Chemotherapie | Pembrolizumab-Kombinationstherapie | Chemotherapie | Pembrolizumab-Kombinationstherapie | Chemotherapie |
TPS < 1 % | TPS 1 – 49 % | TPS ≥ 50 % | ||||
Gesamtüberleben (OS) Hazard-Ratio† (95-%-KI) | 0,79 (0,56; 1,11) | 0,59 (0,42; 0,84) | 0,79 (0,52; 1,21) | |||
Überleben ohne Fortschreiten der Krebserkrankung (PFS) Hazard-Ratio† (95-%-KI) | 0,67 (0,49; 0,91) | 0,52 (0,38; 0,71) | 0,43 (0,29; 0,63) | |||
ORR % | 67 % | 41 % | 55 % | 42 % | 64 % | 30 % |
* Basierend auf der finalen Analyse | ||||||
Zum Zeitpunkt der finalen Analyse waren insgesamt 65 Patienten mit NSCLC im Alter von ≥ 75 Jahren in die Studie KEYNOTE‑407 eingeschlossen (34 Patienten im Pembrolizumab-Kombinationstherapie-Arm und 31 Patienten im Kontroll-Arm). In dieser Studiensubgruppe wurde für das Gesamtüberleben (OS) eine Hazard-Ratio von HR = 0,81 [95-%-KI: 0,43; 1,55], und für das Überleben ohne Fortschreiten der Krebserkrankung (PFS) eine Hazard-Ratio von HR = 0,61 [95-%-KI: 0,34; 1,09], und eine Objektive Ansprechrate (ORR) von 62 % bzw. 45 % unter Pembrolizumab-Kombinationstherapie vs. Chemotherapie berichtet. Die Daten hinsichtlich Wirksamkeit von Pembrolizumab in Kombination mit einer Platin-Chemotherapie sind bei dieser Patientenpopulation begrenzt.
KEYNOTE‑010: Kontrollierte Studie mit NSCLC Patienten nach Vorbehandlung mit Chemotherapie
Die Sicherheit und Wirksamkeit von Pembrolizumab wurden in KEYNOTE‑010, einer multizentrischen, offenen, kontrollierten Studie zur Behandlung des fortgeschrittenen NSCLC bei Patienten, die mit einer Platin-haltigen Chemotherapie vorbehandelt waren, untersucht. Bei den Patienten lag eine PD‑L1-Expression von ≥ 1 % TPS basierend auf dem PD‑L1 IHC 22C3 pharmDxTM Kit vor. Patienten mit Tumoren mit aktivierender EGFR-Mutation oder ALK-Translokation erhielten erst Pembrolizumab, wenn deren Erkrankung unter einer für diese Mutationen zugelassenen Vortherapie fortgeschritten war. Die Patienten erhielten randomisiert (1:1:1) entweder Pembrolizumab in einer Dosis von 2 mg/kg KG (n = 344) oder 10 mg/kg KG (n = 346) alle 3 Wochen oder Docetaxel in einer Dosis von 75 mg/m2 alle 3 Wochen (n = 343) und wurden bis zum Fortschreiten der Krebserkrankung oder dem Auftreten unzumutbarer Toxizität behandelt. Die Studie schloss Patienten mit einer Autoimmunerkrankung, einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, deren thorakale Strahlendosis 30 Gy innerhalb der vorangegangenen 26 Wochen überschritten hatte, aus. Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen.
Zu Studienbeginn war diese Patientenpopulation wie folgt charakterisiert: medianes Alter 63 Jahre (42 % waren 65 Jahre oder älter); 61 % waren Männer; 72 % waren kaukasischer und 21 % waren asiatischer Herkunft; bei 34 % bzw. 66 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. Krankheitsmerkmale waren: NSCLC mit Plattenepithelhistologie (21 %) und Nicht-Plattenepithelhistologie (70 %); Stadium IIIA (2 %); Stadium IIIB (7 %); Stadium IV (91 %); das Vorhandensein von stabilen Hirnmetastasen (15 %). Die Inzidenz von EGFR-Mutationen betrug 8 % und von ALK-Translokationen 1 %. Alle Patienten (100 %) waren mit einer Platin-haltigen Chemotherapie vorbehandelt; dabei hatten die Patienten eine (69 %) oder zwei oder mehrere (29 %) Therapielinien erhalten.
Primäre Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS), bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien. Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens. Tabelle 20 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte für die Gesamtpopulation (TPS ≥ 1 %) und für die Patienten mit TPS ≥ 50 % und Abbildung 18 zeigt die Kaplan-Meier-Kurve für das Gesamtüberleben (TPS ≥ 1 %) basierend auf der finalen Analyse bei einer medianen Nachbeobachtungszeit von 42,6 Monaten.
Tabelle 20: Ansprechen auf Pembrolizumab 2 mg/kg KG oder 10 mg/kg KG alle 3 Wochen bei vorbehandelten Patienten mit NSCLC in KEYNOTE‑010
Endpunkt | Pembrolizumab | Pembrolizumab | Docetaxel |
TPS ≥ 1 % | |||
Anzahl Patienten | 344 | 346 | 343 |
Gesamtüberleben (OS) | |||
Anzahl (%) Patienten mit Ereignis | 284 (83 %) | 264 (76 %) | 295 (86 %) |
Hazard-Ratio* (95-%-KI) | 0,77 (0,66; 0,91) | 0,61 (0,52; 0,73) | --- |
p-Wert† | 0,00128 | < 0,001 | --- |
Median in Monaten (95-%-KI) | 10,4 (9,5; 11,9) | 13,2 (11,2; 16,7) | 8,4 (7,6; 9,5) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)‡ | |||
Anzahl (%) Patienten mit Ereignis | 305 (89 %) | 292 (84 %) | 314 (92 %) |
Hazard-Ratio* (95-%-KI) | 0,88 (0,75; 1,04) | 0,75 (0,63; 0,89) | --- |
p-Wert† | 0,065 | < 0,001 | --- |
Median in Monaten (95-%-KI) | 3,9 (3,1; 4,1) | 4,0 (2,7; 4,5) | 4,1 (3,8; 4,5) |
Objektive Ansprechrate‡ | |||
ORR % (95-%-KI) | 20 % (16; 25) | 21 % (17; 26) | 9 % (6; 13) |
Vollständiges Ansprechen | 2 % | 3 % | 0 % |
Partielles Ansprechen | 18 % | 18 % | 9 % |
Dauer des Ansprechens‡, § | |||
Median in Monaten | Nicht erreicht | 37,8 | 7,1 |
% mit andauerndem Ansprechen¶ | 42 % | 43 % | 6 % |
TPS ≥ 50 % | |||
Anzahl Patienten | 139 | 151 | 152 |
Gesamtüberleben (OS) | |||
Anzahl (%) Patienten mit Ereignis | 97 (70 %) | 102 (68 %) | 127 (84 %) |
Hazard-Ratio* (95-%-KI) | 0,56 (0,43; 0,74) | 0,50 (0,38; 0,65) | --- |
p-Wert† | < 0,001 | < 0,001 | --- |
Median in Monaten (95-%-KI) | 15,8 (10,8; 22,5) | 18,7 (12,1; 25,3) | 8,2 (6,4; 9,8) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)‡ | |||
Anzahl (%) Patienten mit Ereignis | 107 (77 %) | 115 (76 %) | 138 (91 %) |
Hazard-Ratio* (95-%-KI) | 0,59 (0,45; 0,77) | 0,53 (0,41; 0,70) | --- |
p-Wert† | < 0,001 | < 0,001 | --- |
Median in Monaten (95-%-KI) | 5,3 (4,1; 7,9) | 5,2 (4,1; 8,1) | 4,2 (3,8; 4,7) |
Objektive Ansprechrate‡ | |||
ORR % (95-%-KI) | 32 % (24; 40) | 32 % (25; 41) | 9 % (5; 14) |
Vollständiges Ansprechen | 4 % | 4 % | 0 % |
Partielles Ansprechen | 27 % | 28 % | 9 % |
Dauer des Ansprechens‡, § | |||
Median in Monaten | Nicht erreicht | 37,5 | 8,1 |
% mit andauerndem Ansprechen¶ | 55 % | 47 % | 8 % |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Docetaxel) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | |||
Abbildung 18: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑010 (Patienten mit PD‑L1-Expression TPS ≥ 1 %, Intent-to-Treat-Population)
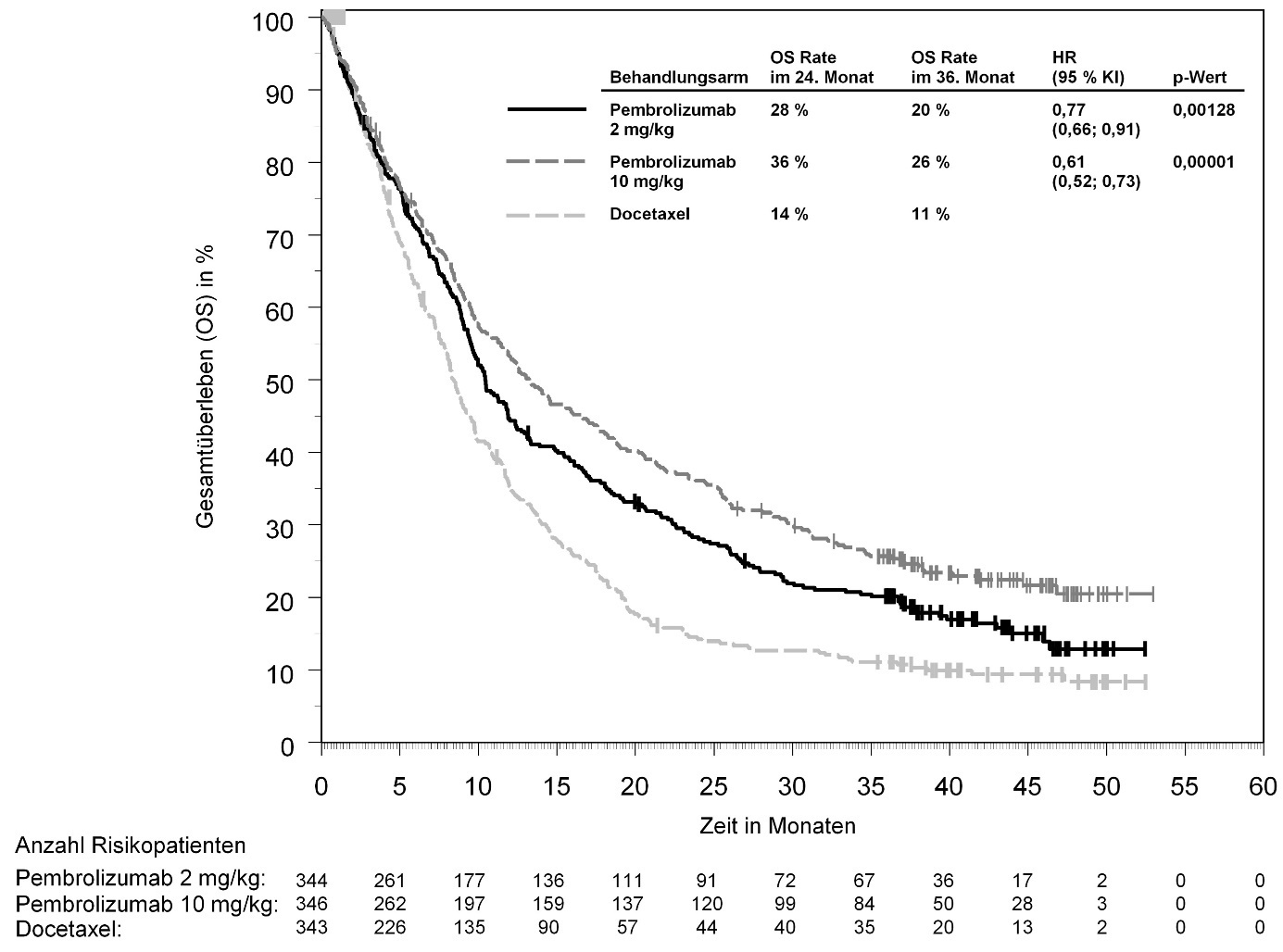
Die Wirksamkeitsergebnisse waren im 2 mg/kg KG und 10 mg/kg KG Pembrolizumab-Arm ähnlich. Die Wirksamkeitsergebnisse für Gesamtüberleben (OS) waren entsprechend eines Zwischengruppenvergleichs unabhängig vom Alter der Gewebeproben (neue Probe vs. archivierte Probe) konsistent.
In einer Subgruppenanalyse wurde ein geringerer Überlebensvorteil von Pembrolizumab im Vergleich zu Docetaxel bei Patienten beobachtet, die niemals geraucht hatten, sowie bei Patienten, deren Tumoren EGFR-aktivierende Mutationen aufwiesen und die mindestens eine Platin-basierte Chemotherapie und einen Tyrosinkinase-Inhibitor erhalten hatten. Aufgrund der geringen Anzahl der Patienten können jedoch keine endgültigen Schlussfolgerungen aus diesen Daten gezogen werden.
Die Wirksamkeit und Sicherheit von Pembrolizumab bei Patienten, deren Tumoren kein PD‑L1 exprimieren, sind nicht erwiesen.
Malignes Pleuramesotheliom
KEYNOTE-483: Kontrollierte Studie einer Kombinationstherapie bei Patienten mit unbehandeltem, nicht resezierbarem fortgeschrittenem oder metastasierendem malignen Pleuramesotheliom (MPM)
Die Wirksamkeit von Pembrolizumab in Kombination mit Pemetrexed und Platin-Chemotherapie wurde in KEYNOTE‑483, einer multizentrischen, randomisierten, offenen, aktiv-kontrollierten Studie, untersucht. Die wichtigsten Einschlusskriterien waren ein nicht resezierbares fortgeschrittenes oder metastasierendes MPM mit keiner vorhergehenden systemischen Therapie für die fortgeschrittene/metastasierende Erkrankung. Die Patienten wurden ungeachtet des PD-L1-Tumor-Expressions-Status eingeschlossen. Patienten mit einer Autoimmunerkrankung, die innerhalb der letzten drei Behandlungsjahre eine systemische Therapie erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung erfolgte stratifiziert nach histologischem Subtyp (epitheloid vs. nicht-epitheloid). Die Patienten wurden randomisiert (1:1) einem der folgenden Studienarme zugeteilt; die Gabe der Studienmedikation erfolgte jeweils als intravenöse Infusion:
Pembrolizumab 200 mg mit Pemetrexed 500 mg/m2 und Cisplatin 75 mg/m2 oder Carboplatin AUC 5 − 6 mg/ml/min an Tag 1 jedes 21‑Tage-Zyklus für bis zu 6 Zyklen, gefolgt von Pembrolizumab 200 mg alle 3 Wochen (n = 222). Pembrolizumab wurde vor der Chemotherapie an Tag 1 gegeben.
Pemetrexed 500 mg/m2 und Cisplatin 75 mg/m2 oder Carboplatin AUC 5 − 6 mg/ml/min an Tag 1 jedes 21‑Tage-Zyklus für bis zu 6 Zyklen (n = 218).
Die Behandlung mit Pembrolizumab wurde bis zu einem gemäß den modifizierten RECIST‑v1.1-Kriterien für Mesotheliom (mRECIST) definierten, vom Prüfarzt ermittelten Fortschreiten der Krebserkrankung, Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Eine Bewertung des Tumorstatus erfolgte alle 6 Wochen für 18 Wochen und im Anschluss daran alle 12 Wochen.
Die 95 Patienten mit nicht-epitheloider Histologie in KEYNOTE‑483 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 71 Jahre (Spanne: 48 bis 85 Jahre), 76 % waren 65 Jahre oder älter; 83 % waren Männer; 85 % waren kaukasischer Herkunft und bei 15 % wurde die Herkunft nicht spezifiziert oder war unbekannt; 1 % waren hispanischer oder lateinamerikanischer Herkunft; ein ECOG-Performance-Status von 0 bzw. 1 lag bei 44 % bzw. 56 % vor.
Der primäre Wirksamkeitsendpunkt war das Gesamtüberleben (OS). Zu den weiteren Wirksamkeitsendpunkten gehörten das Überleben ohne Fortschreiten der Krebserkrankung (PFS), die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens (DoR), bewertet mittels BICR gemäß mRECIST-Kriterien. Die Studie zeigte eine statistisch signifikante Verbesserung in der Gesamtpopulation hinsichtlich OS (0,79 [95-%-KI 0,64; 0,98; p-Wert 0,0162]) und PFS (0,80 [95‑%‑KI 0,65; 0,99; p-Wert 0,0194]) bei finaler Analyse und ORR (52 % [95-%-KI 45; 59]) im Vergleich zu (29 % [95-%-KI 23; 35] p-Wert < 0,00001) in der Interimsanalyse bei in den Pembrolizumab-Kombinationstherapie-Arm randomisierten Patienten im Vergleich zu Patienten mit alleiniger Chemotherapie. Tabelle 21 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte und in den Abbildungen 19 und 20 sind die Kaplan-Meier-Kurven für OS und PFS basierend auf der finalen Analyse mit einer medianen Nachbeobachtungszeit von 9,8 Monaten (Spanne: 0,9 bis 60,3 Monate) bei Patienten mit nicht-epitheloidem malignen Pleuramesotheliom dargestellt.
Tabelle 21: Wirksamkeitsergebnisse in KEYNOTE-483 für Patienten mit nicht-epitheloidem malignen Pleuramesotheliom
Endpunkt | Pembrolizumab | Pemetrexed + Platin‑Chemotherapie |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 37 (80 %) | 44 (90 %) |
Hazard-Ratio* (95-%-KI) | 0,57 (0,36; 0,89) | |
Median in Monaten† (95-%-KI) | 12,3 (8,7; 21,2) | 8,2 (5,8; 9,8) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 36 (78 %) | 38 (78 %) |
Hazard-Ratio* (95-%-KI) | 0,47 (0,29; 0,77) | |
Median in Monaten† (95-%-KI) | 7,1 (4,5; 9,8) | 4,5 (4,0; 6,4) |
Objektive Ansprechrate | ||
ORR % (95-%-KI)‡ | 41 % (27; 57) | 6 % (1; 17) |
Dauer des Ansprechens† | ||
Median in Monaten (Spanne) | 11,1 (1,3+; 38,9+) | 4,0 (2,4+; 5,2) |
* Basierend auf dem Cox-Regressionsmodell mit der Efron-Methode des „Tie-Handling“ mit der Behandlung als Kovariate | ||
Abbildung 19: Kaplan‑Meier-Kurve des Gesamtüberlebens (OS) in Patienten mit nicht-epitheloidem MPM in KEYNOTE-483
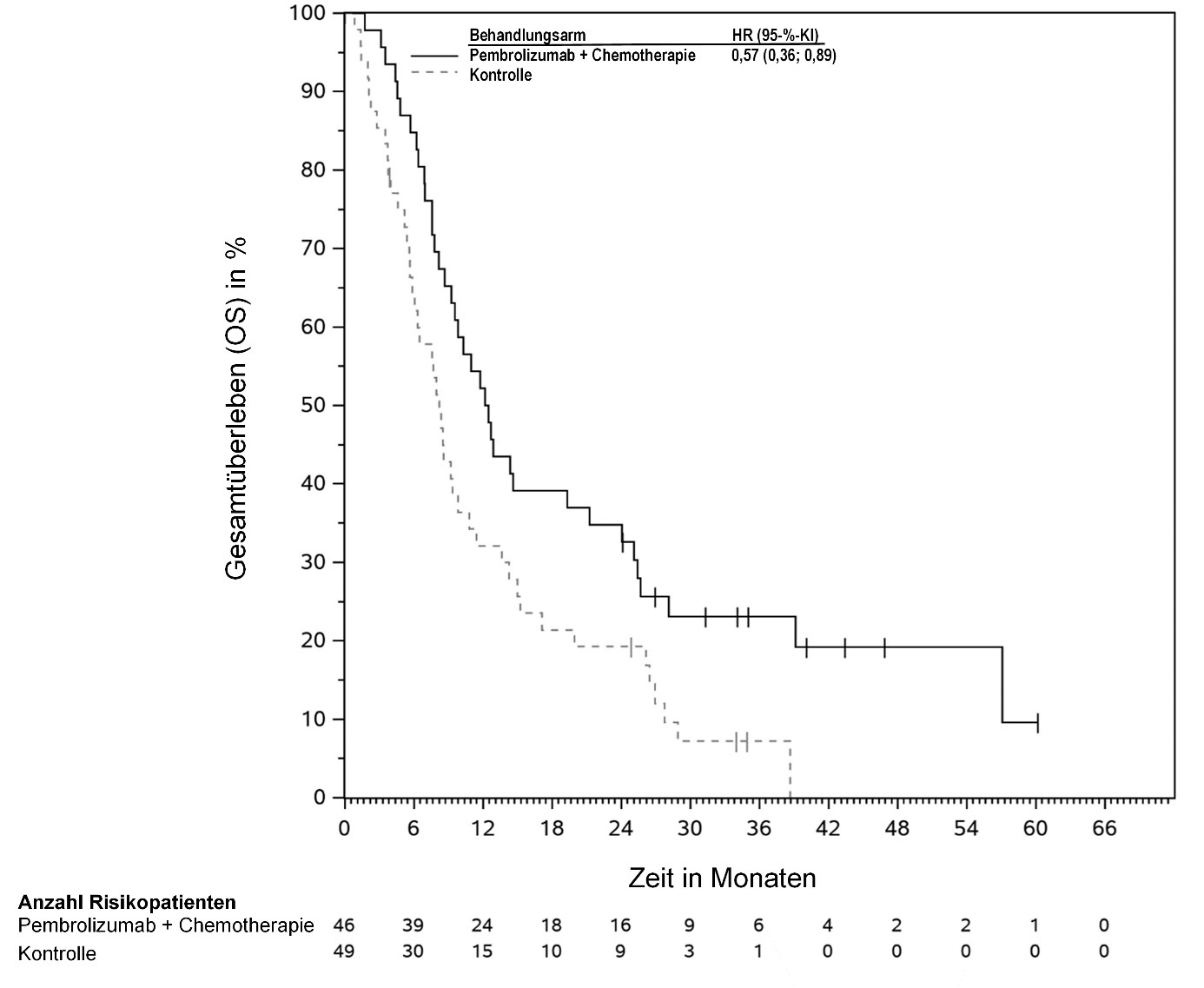
Abbildung 20: Kaplan‑Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) in Patienten mit nicht-epitheloidem MPM in KEYNOTE-483
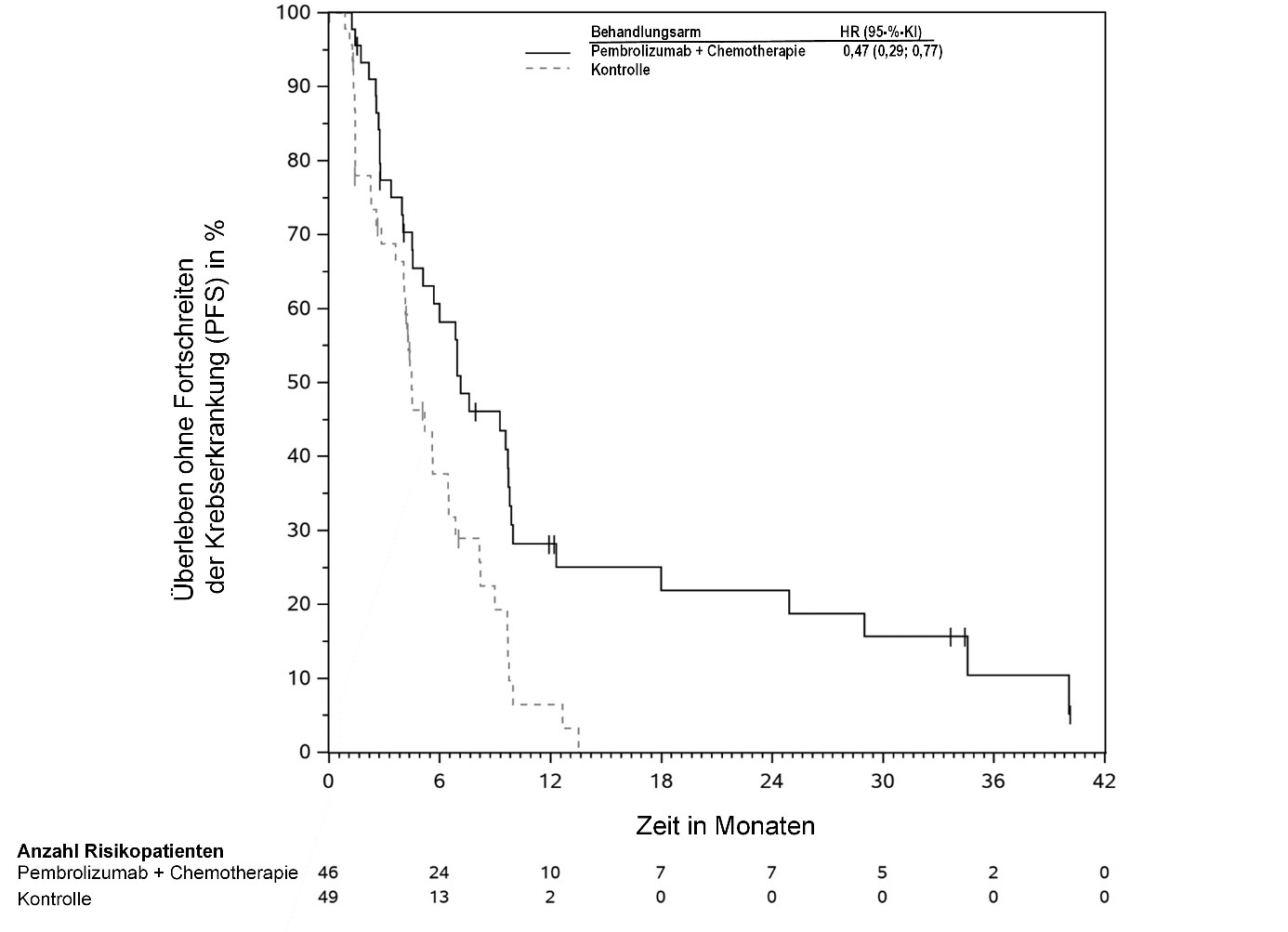
Klassisches Hodgkin-Lymphom
KEYNOTE‑204: Kontrollierte Studie bei Patienten mit rezidivierendem oder refraktärem klassischen Hodgkin-Lymphom (HL)
Die Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑204, einer randomisierten, offenen, aktiv-kontrollierten Studie zur Behandlung von 304 Patienten mit rezidivierendem oder refraktärem klassischen HL untersucht. Patienten mit aktiver, nicht-infektiöser Pneumonitis, einer allogenen HSZT innerhalb der letzten 5 Jahre (oder > 5 Jahre, aber mit Symptomen einer GVHD), aktiver Autoimmunerkrankung, einer Erkrankung, die eine Immunsuppression erforderte, oder einer aktiven Infektion, die eine systemische Therapie erforderte, waren für die Studie nicht geeignet. Die Randomisierung erfolgte stratifiziert nach vorhergehender auto-SZT („ja“ vs. „nein“) und Erkrankungsstatus nach Erstlinientherapie („primär refraktär“ vs. „rezidivierend“ nach weniger als 12 Monaten vs. „rezidivierend“ nach 12 oder mehr Monaten nach Abschluss der Therapie). Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt:
Pembrolizumab in einer Dosierung von 200 mg intravenös alle 3 Wochen
Brentuximab vedotin (BV) in einer Dosierung von 1,8 mg/kg KG intravenös alle 3 Wochen
Die Patienten erhielten Pembrolizumab intravenös in einer Dosierung von 200 mg alle 3 Wochen bis zum Auftreten unzumutbarer Toxizität oder bis zum bestätigten Fortschreiten der Krebserkrankung oder bis zu einem Maximum von 35 Zyklen. Zur Dauer des Ansprechens nach Absetzen von Pembrolizumab nach Zyklus 35 liegen derzeit nur begrenzte Daten vor. Das Ansprechen wurde alle 12 Wochen beurteilt, die erste Beurteilung nach Studienbeginn erfolgte planmäßig in Woche 12.
Unter den 304 Patienten in KEYNOTE-204 gibt es eine Subpopulation mit 112 Patienten nach Versagen einer Stammzelltransplantation vor Studienaufnahme sowie 137 Patienten nach Versagen von zwei oder mehr vorhergehenden Therapien, die zum Zeitpunkt der Studienaufnahme für eine auto-SZT nicht geeignet waren. Diese 249 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 34 Jahre (11 % waren 65 Jahre oder älter); 56 % waren Männer; 80 % waren kaukasischer und 7 % asiatischer Herkunft und bei 58 % bzw. 41 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. Ungefähr 30 % der Patienten waren gegenüber einer Erstlinien-Chemotherapie refraktär und ~ 45 % der Patienten hatten eine vorhergehende auto-SZT erhalten. Der nodulär-sklerosierende Typ war der am häufigsten vorkommende histologische Subtyp bei klassischem HL (~ 81 %) und eine größere Tumormasse („Bulky-Disease“), eine B-Symptomatik und eine Knochenmarksbeteiligung waren bei ca. 21 %, 28 % bzw. 4 % der Patienten vorhanden.
Der primäre Wirksamkeitsendpunkt war das Überleben ohne Fortschreiten der Krebserkrankung (PFS) und der sekundäre Wirksamkeitsendpunkt die Objektive Ansprechrate (ORR), beide wurden mittels BICR entsprechend der 2007 überarbeiteten „International Working Group (IWG)“-Kriterien bewertet. Der zusätzliche primäre Wirksamkeitsendpunkt Gesamtüberleben (OS) wurde zum Zeitpunkt der Analyse nicht formal bewertet. In der ITT-Population betrug die mediane Nachbeobachtungszeit bei den 151 Patienten unter Pembrolizumab 24,9 Monate (Spanne: 1,8 bis 42,0 Monate). Die initiale Analyse ergab für PFS eine Hazard-Ratio (HR) von 0,65 (95-%-KI: 0,48; 0,88) mit einem einseitigen p‑Wert von 0,0027. Die ORR lag unter Pembrolizumab bei 66 % im Vergleich zu 54 % unter Standardtherapie mit einem p‑Wert von 0,0225. Tabelle 22 enthält eine Zusammenfassung der Wirksamkeitsergebnisse der Subpopulation. Die Wirksamkeitsergebnisse bei dieser Subpopulation waren konsistent mit denen der ITT-Population. Die Kaplan-Meier-Kurve für PFS dieser Subpopulation ist in Abbildung 21 dargestellt.
Tabelle 22: Wirksamkeitsergebnisse bei Patienten mit klassischem HL nach Versagen einer Stammzelltransplantation vor Studienaufnahme oder nach Versagen von 2 oder mehr vorhergehenden Therapien und bei Nichteignung für eine auto-SZT in KEYNOTE‑204
Endpunkt | Pembrolizumab 200 mg alle 3 Wochen | Brentuximab |
n = 124 | n = 125 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 68 (55 %) | 75 (60 %) |
Hazard-Ratio* (95-%-KI) | 0,66 (0,47; 0,92) | |
Median in Monaten (95-%-KI) | 12,6 (8,7; 19,4) | 8,2 (5,6; 8,8) |
Objektive Ansprechrate (ORR) | ||
ORR‡ % (95-%-KI) | 65 % (56,3; 73,6) | 54 % (45,3; 63,3) |
Vollständiges Ansprechen | 27 % | 22 % |
Partielles Ansprechen | 39 % | 33 % |
Stabile Erkrankung | 12 % | 23 % |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 20,5 (0,0+; 33,2+) | 11,2 (0,0+; 33,9+) |
Anzahl (%¶) Patienten mit einer Dauer ≥ 6 Monaten | 53 (80,8 %) | 28 (61,2 %) |
Anzahl (%¶) Patienten mit einer Dauer ≥ 12 Monaten | 37 (61,7 %) | 17 (49,0 %) |
* Basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 21: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm bei Patienten mit klassischem HL nach Versagen einer Stammzelltransplantation vor Studienaufnahme oder nach Versagen von 2 oder mehr vorhergehenden Therapien und bei Nichteignung für eine auto-SZT in KEYNOTE-204
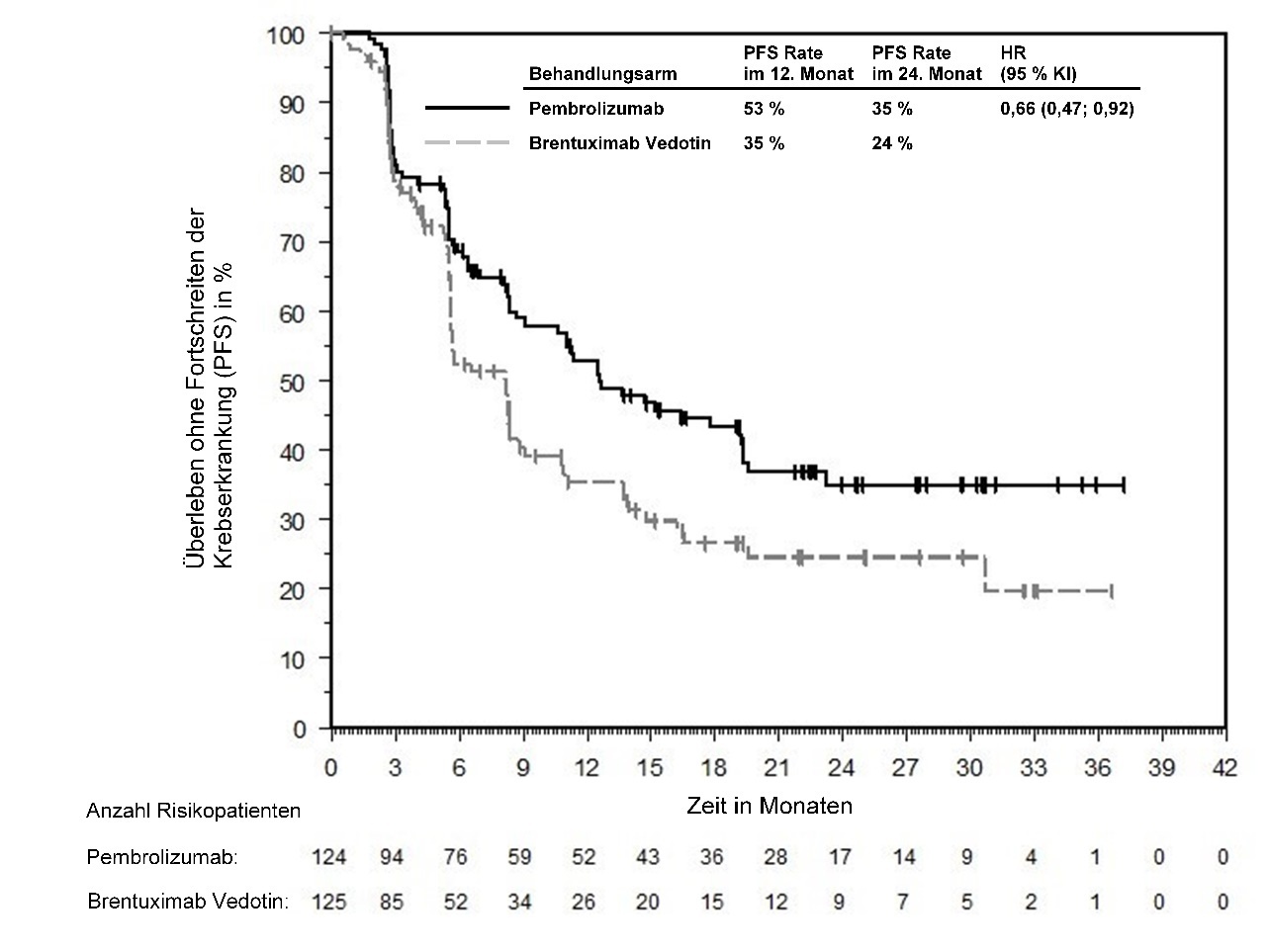
KEYNOTE‑087 und KEYNOTE‑013: Offene Studien bei Patienten mit rezidivierendem oder refraktärem klassischen HL
Die Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑087 und KEYNOTE‑013, zwei multizentrischen, offenen Studien zur Behandlung von 241 Patienten mit klassischem HL, untersucht. In diese Studien wurden Patienten nach Versagen einer auto-SZT und einer Behandlung mit BV oder Patienten nach Versagen einer Behandlung mit BV, für die vorher eine auto-SZT nicht in Frage kam, da sie keine vollständige oder partielle Remission nach einer Salvage-Chemotherapie erreicht hatten, oder Patienten, die nach Versagen einer auto-SZT kein BV erhielten, aufgenommen. Fünf Studienteilnehmer waren aus anderen Gründen als einem Versagen einer Salvage-Chemotherapie für eine auto-SZT nicht geeignet. Beide Studien schlossen Patienten ungeachtet einer PD‑L1-Expression ein. Patienten mit aktiver, nicht infektiöser Pneumonitis, einer allogenen Transplantation innerhalb der letzten 5 Jahre (oder > 5 Jahre, aber mit GVHD), aktiver Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, waren für keine der Studien geeignet. Die Patienten erhielten Pembrolizumab in einer Dosierung von 200 mg alle 3 Wochen (n = 210; KEYNOTE‑087) oder von 10 mg/kg KG alle 2 Wochen (n = 31; KEYNOTE‑013) bis zum Auftreten einer nicht zumutbaren Toxizität oder bis zum bestätigten Fortschreiten der Krebserkrankung.
Die Patienten in KEYNOTE‑087 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 35 Jahre (9 % waren 65 Jahre oder älter); 54 % waren Männer; 88 % waren kaukasischer Herkunft; bei 49 % bzw. 51 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. Die Patienten erhielten vorher im Median 4 (Spanne: 1 bis 12) Therapielinien zur Behandlung des klassischen HL. 81 % der Patienten waren gegenüber mindestens einer vorhergehenden Therapie refraktär, einschließlich 34 %, die gegenüber einer Erstlinientherapie refraktär waren. 61 % der Patienten hatten eine auto-SZT erhalten, 38 % waren für eine Transplantation nicht geeignet; 17 % hatten vorher keine Behandlung mit Brentuximab vedotin erhalten und 37 % der Patienten hatten vorher eine Strahlentherapie erhalten. Als Erkrankungssubtypen lagen bei 81 % der Patienten der nodulär-sklerosierende Typ, bei 11 % der gemischtzellige Typ, bei 4 % der lymphozytenreiche Typ und bei 2 % der lymphozytenarme Typ vor.
Die Patienten in KEYNOTE‑013 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 32 Jahre (7 % waren 65 Jahre oder älter), 58 % waren Männer, 94 % waren kaukasischer Herkunft, bei 45 % bzw. 55 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. Die Patienten erhielten vorher im Median 5 (Spanne: 2 bis 15) Therapielinien zur Behandlung des klassischen HL. 84 % der Patienten waren gegenüber mindestens einer vorhergehenden Therapie refraktär, einschließlich 35 %, die gegenüber Erstlinientherapie refraktär waren. 74 % der Patienten hatten eine auto-SZT erhalten, 26 % waren für eine Transplantation ungeeignet und 45 % der Patienten hatten vorher eine Strahlentherapie erhalten. Als Erkrankungssubtypen lagen bei 97 % der Patienten die nodulär-sklerosierende Form und bei 3 % der gemischtzellige Typ vor.
Die primären Wirksamkeitsendpunkte, d. h. die Objektive Ansprechrate (ORR) und die vollständige Remissionsrate („complete response rate“ [CRR]), wurden mittels BICR entsprechend den IWG-2007-Kriterien bewertet. Die sekundären Wirksamkeitsendpunkte waren die Dauer des Ansprechens, das Überleben ohne Fortschreiten der Krebserkrankung (PFS) und das Gesamtüberleben (OS). Das Ansprechen wurde in KEYNOTE‑087 und KEYNOTE‑013 alle 12 bzw. 8 Wochen beurteilt, die erste Beurteilung nach Studienbeginn erfolgte planmäßig in Woche 12. Tabelle 23 enthält eine Zusammenfassung der wichtigsten Wirksamkeitsergebnisse.
Tabelle 23: Wirksamkeitsergebnisse in KEYNOTE‑087 und KEYNOTE‑013
KEYNOTE‑087* | KEYNOTE‑013† | |
Endpunkt | Pembrolizumab | Pembrolizumab |
Objektive Ansprechrate‡ | ||
ORR % (95-%-KI) | 71 % (64,8; 77,4) | 58 % (39,1; 75,5) |
Vollständige Remission | 28 % | 19 % |
Partielle Remission | 44 % | 39 % |
Dauer des Ansprechens‡ | ||
Median in Monaten (Spanne) | 16,6 (0,0+; 62,1+)§ | Nicht erreicht (0,0+; 45,6+)¶ |
% mit einer Dauer ≥ 12 Monaten | 59 %# | 70 %Þ |
% mit einer Dauer ≥ 24 Monaten | 45 %ß | --- |
% mit einer Dauer ≥ 60 Monaten | 25 %à | --- |
Zeit bis zum Ansprechen | ||
Median in Monaten (Spanne) | 2,8 (2,1; 16,5)§ | 2,8 (2,4; 8,6)¶ |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 59 (28 %) | 6 (19 %) |
12-Monats-OS-Rate | 96 % | 87 % |
24-Monats-OS-Rate | 91 % | 87 % |
60-Monats-OS-Rate | 71 % | --- |
* Mediane Nachbeobachtungszeit von 62,9 Monaten | ||
Wirksamkeit bei älteren Patienten
Insgesamt wurden 46 Patienten ≥ 65 Jahre mit klassischem HL in KEYNOTE‑087, KEYNOTE‑013 und KEYNOTE‑204 mit Pembrolizumab behandelt. Die Daten dieser Patienten sind zu begrenzt, um daraus irgendwelche Rückschlüsse auf die Wirksamkeit bei dieser Population zu ziehen.
Urothelkarzinom
KEYNOTE-A39: Kontrollierte Studie einer Kombinationstherapie mit Enfortumab vedotin zur Erstlinienbehandlung des nicht resezierbaren oder metastasierenden Urothelkarzinoms
Die Wirksamkeit von Pembrolizumab in Kombination mit Enfortumab vedotin wurde in KEYNOTE-A39, einer offenen, multizentrischen, randomisierten, aktiv-kontrollierten Studie bei 886 Patienten mit nicht resezierbarem oder metastasierendem Urothelkarzinom untersucht. Von der Studie ausgeschlossen waren Patienten mit einer Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, aktiven ZNS-Metastasen, anhaltender sensorischer oder motorischer Neuropathie ≥ Grad 2 oder unkontrolliertem Diabetes, definiert als Hämoglobin A1C (HbA1c) ≥ 8 % oder HbA1c ≥ 7 % und damit verbundenen Diabetessymptomen, Pneumonitis oder anderen Arten interstitieller Lungenkrankheit. Patienten, die eine neoadjuvante Chemotherapie erhielten oder Patienten, die nach einer Zystektomie eine adjuvante Chemotherapie erhielten, wurden in die Studie aufgenommen, wenn das Rezidiv mehr als 12 Monate nach Abschluss der Therapie auftrat. Patienten galten als nicht für Cisplatin geeignet, wenn sie mindestens eines der folgenden Kriterien erfüllten: glomeruläre Filtrationsrate 30 – 59 ml/min, ECOG-Performance-Status ≥ 2, Hörverlust Grad ≥ 2 oder NYHA-Klasse-III-Herzinsuffizienz. Patienten, die in den Behandlungsarm mit Gemcitabin und Platin-basierter Chemotherapie randomisiert wurden, konnten eine Immuntherapie als Erhaltungstherapie bekommen. Die Randomisierung wurde stratifiziert nach Cisplatin-Eignung (geeignet oder nicht geeignet), PD-L1-Expression (CPS ≥ 10 oder CPS < 10 basierend auf dem PD‑L1 IHC 22C3 pharmDxTM Kit) und Lebermetastasen (vorhanden oder nicht vorhanden). Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt; die Gabe jeglicher Studienmedikation erfolgte jeweils als intravenöse Infusion:
Pembrolizumab 200 mg über 30 Minuten an Tag 1 und Enfortumab vedotin 1,25 mg/kg an den Tagen 1 und 8 jedes 21-Tage-Zyklus.
Gemcitabin 1 000 mg/m2 an den Tagen 1 und 8 und nach Maßgabe des Prüfarztes entweder Cisplatin 70 mg/m2 oder Carboplatin (AUC 4,5 oder 5 mg/ml/min gemäß lokalen Richtlinien) an Tag 1 jedes 21-Tage-Zyklus.
Die Behandlung mit Pembrolizumab und Enfortumab vedotin wurde bis zum gemäß RECIST-v1.1-Kriterien definierten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität, oder bei Pembrolizumab bis zu einem Maximum von 35 Zyklen (bis zu ca. 2 Jahren) fortgeführt. Die Beurteilung des Tumorstatus erfolgte 18 Monate lang alle 9 Wochen und danach alle 12 Wochen.
Die 886 Patienten mit Urothelkarzinom waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 69 Jahre; 77 % waren Männer und 67 % waren kaukasischer Herkunft. Bei 95 % lagen Metastasen im M1-Stadium vor und bei 5 % lagen keine Metastasen vor (M0). Bei 73 % der Patienten lag der Primärtumor im unteren Harntrakt und bei 27 % lag er im oberen Harntrakt. 54 % waren Cisplatin-geeignet, 58 % wiesen eine PD-L1-Expression (CPS ≥ 10) auf und bei 72 % lagen viszerale Metastasen vor, einschließlich 22 % mit Lebermetastasen. 20 % hatten eine normale Nierenfunktion und 37 %, 41 % bzw. 2 % wiesen eine leichte, moderate bzw. schwere Nierenfunktionsstörung auf. 97 % hatten einen ECOG-Performance-Status von 0 – 1 und 3 % hatten einen ECOG-Performance-Status von 2. 85 % hatten histologisch ein Übergangszellkarzinom (Transitional Cell Carcinoma, TCC), 2 % hatten ein TCC mit anderer Histologie und 6 % hatten ein TCC mit Plattenepitheldifferenzierung. 32 % der Patienten im Behandlungsarm mit Gemcitabin und Platin-basierter Chemotherapie erhielten eine Immuntherapie als Erhaltungstherapie.
Die primären Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Krebserkrankung (PFS), bewertet mittels BICR gemäß RECIST-v1.1-Kriterien und das Gesamtüberleben (OS). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens, bewertet mittels BICR gemäß RECIST-v1.1-Kriterien sowie die Zeit bis zur Schmerzprogression (Time To Pain Progression, TTPP).
Die Studie zeigte eine statistisch signifikante Verbesserung von OS, PFS und ORR bei Patienten, die randomisiert Pembrolizumab in Kombination mit Enfortumab vedotin erhielten, im Vergleich zu Patienten, die randomisiert Gemcitabin und eine Platin-basierte Chemotherapie erhielten.
Die mediane Nachbeobachtungszeit bei 442 mit Pembrolizumab und Enfortumab vedotin behandelten Patienten betrug 17,3 Monate (Spanne: 0,3 bis 37,2 Monate). Die wichtigsten Wirksamkeitsergebnisse sind in Tabelle 24 und den Abbildungen 22 und 23 zusammengefasst.
Tabelle 24: Wirksamkeitsergebnisse in KEYNOTE‑A39
Endpunkt | Pembrolizumab | Gemcitabin + Platin-Chemotherapie mit oder ohne Erhaltungs-Immuntherapie |
n = 442 | n = 444 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 133 (30 %) | 226 (51 %) |
Median in Monaten (95-%-KI) | 31,5 (25,4; N.e.) | 16,1 (13,9; 18,3) |
Hazard-Ratio* (95-%-KI) | 0,47 (0,38; 0,58) | |
p-Wert† | < 0,00001 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 223 (50 %) | 307 (69 %) |
Median in Monaten (95-%-KI) | 12,5 (10,4; 16,6) | 6,3 (6,2; 6,5) |
Hazard-Ratio* (95-%-KI) | 0,45 (0,38; 0,54) | |
p-Wert† | < 0,00001 | |
Objektive Ansprechrate‡ | ||
ORR§ % (95-%-KI) | 68 % (63,1; 72,1) | 44 % (39,7; 49,2) |
p-Wert¶ | < 0,00001 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | N.e. | 7,0 |
* Basierend auf dem stratifizierten Cox-Proportional-Hazard-Regressions-Modell | ||
Abbildung 22: Kaplan‑Meier-Kurve des Gesamtüberlebens (OS) in KEYNOTE-A39
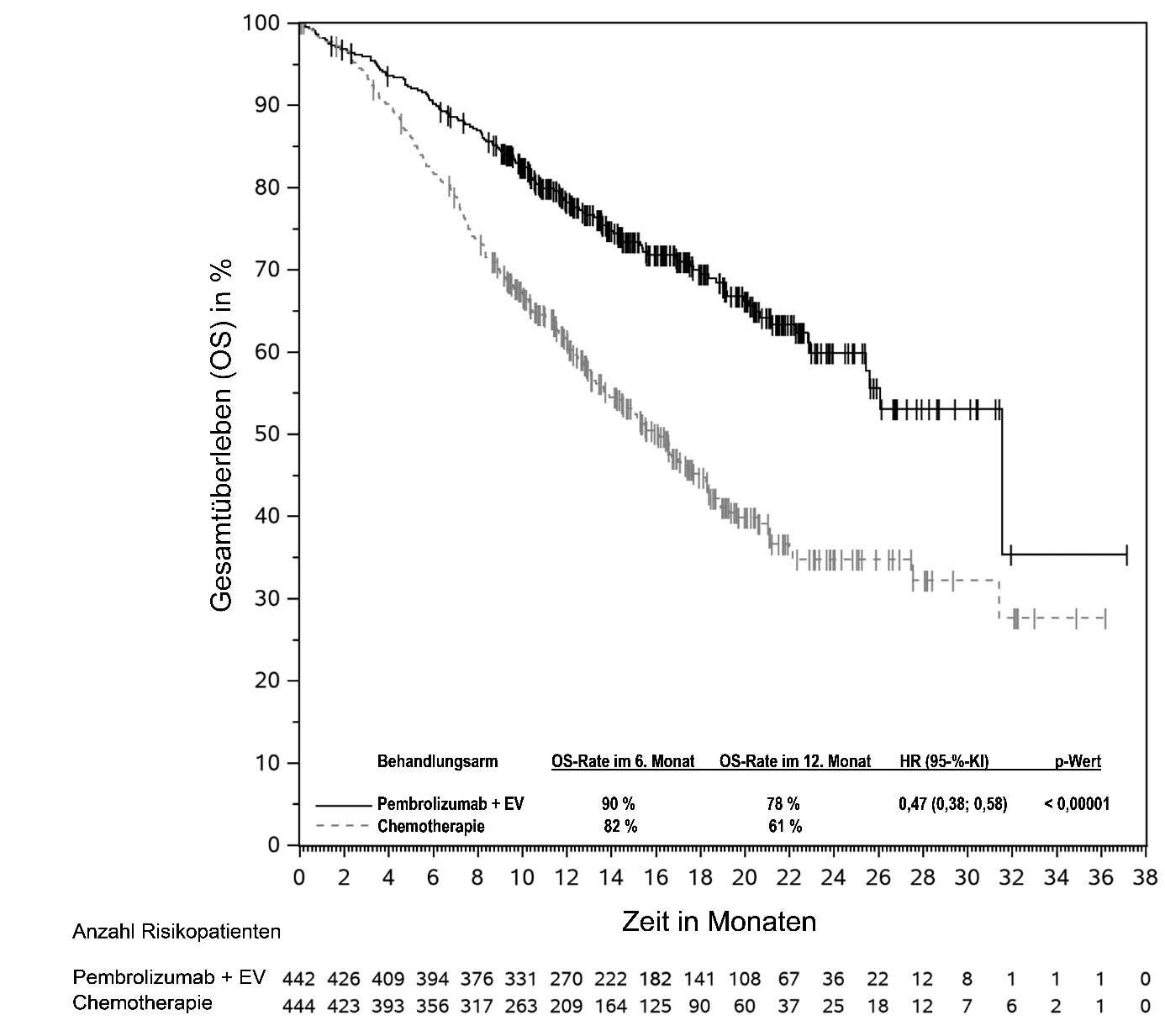
Abbildung 23: Kaplan‑Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) in KEYNOTE‑A39
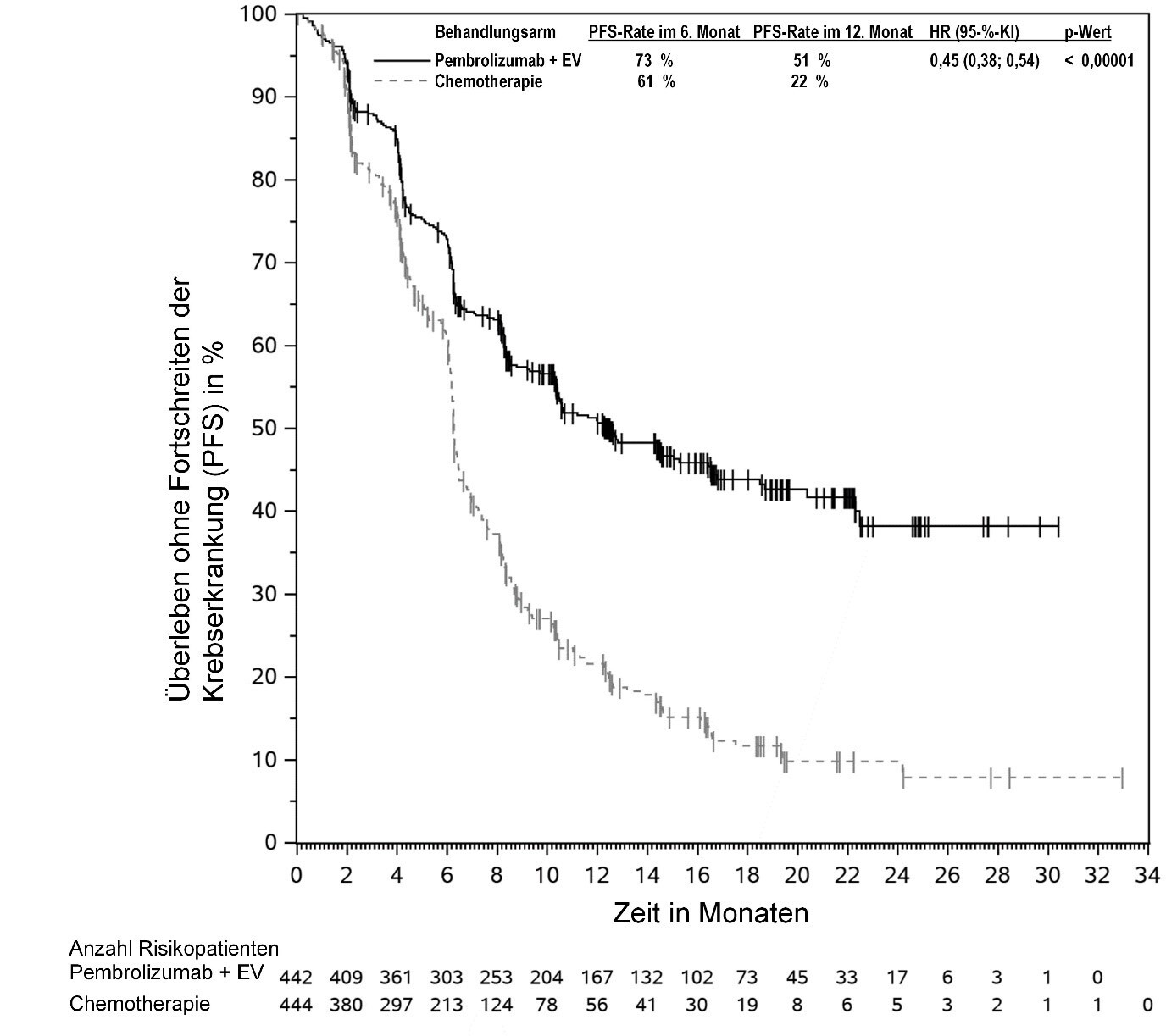
KEYNOTE‑045: Kontrollierte Studie bei Patienten mit Urothelkarzinom nach vorheriger Platin-basierter Therapie
Die Sicherheit und Wirksamkeit von Pembrolizumab wurden in KEYNOTE‑045, einer multizentrischen, offenen, randomisierten (1:1), kontrollierten Studie zur Behandlung des lokal fortgeschrittenen oder metastasierenden Urothelkarzinoms bei Patienten mit Fortschreiten der Krebserkrankung unter oder nach einer Platin-basierten Therapie untersucht. Voraussetzung war, dass die Patienten eine Platin-basierte Erstlinientherapie für die lokal fortgeschrittene/metastasierende Erkrankung oder eine Platin-basierte neoadjuvante/adjuvante Therapie bei Rezidiv/Progression nach ≤ 12 Monaten nach Abschluss der Therapie erhalten hatten.
Die Patienten erhielten randomisiert (1:1) entweder Pembrolizumab 200 mg alle 3 Wochen (n = 270) oder intravenös alle 3 Wochen eine der folgenden Therapien nach Maßgabe des Prüfarztes (n = 272): Paclitaxel 175 mg/m2 (n = 84), Docetaxel 75 mg/m2 (n = 84) oder Vinflunin 320 mg/m2 (n = 87). Die Patienten wurden bis zum Auftreten unzumutbarer Toxizität oder bis zum Fortschreiten der Krebserkrankung mit Pembrolizumab behandelt. Die Behandlung konnte bei Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Patienten ohne Fortschreiten der Krebserkrankung konnten bis zu 24 Monaten behandelt werden. Von der Studie ausgeschlossen waren Patienten mit einer Autoimmunerkrankung, einer Erkrankung, die eine Immunsuppression erforderte, und Patienten, die vorher mehr als zwei systemische Chemotherapielinien zur Behandlung des metastasierenden Urothelkarzinoms erhalten hatten. Patienten mit einem ECOG-Performance-Status von 2 mussten einen Hämoglobinwert von ≥ 10 g/dl haben, durften keine Lebermetastasen aufweisen und mussten die letzte Dosis ihres letzten vorhergehenden Chemotherapieregimes ≥ 3 Monate vor Studieneinschluss erhalten haben. Eine Bewertung des Tumorstatus erfolgte 9 Wochen nach der ersten Dosis, danach alle 6 Wochen innerhalb des ersten Jahres, im Anschluss daran alle 12 Wochen.
Die 542 randomisierten Patienten in KEYNOTE‑045 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 66 Jahre (Spanne: 26 bis 88), 58 % waren 65 Jahre oder älter; 74 % waren Männer; 72 % waren kaukasischer und 23 % asiatischer Herkunft; bei 56 % lag ein ECOG-Performance-Status von 1 vor und bei 1 % lag ein ECOG-Performance-Status von 2 vor; bei 96 % lagen Metastasen im M1-Stadium vor, bei 4 % lagen keine Metastasen vor (M0). Bei 87 % der Patienten lagen viszerale Metastasen vor, einschließlich 34 % mit Lebermetastasen. Bei 86 % der Patienten lag der Primärtumor im unteren Harntrakt und bei 14 % lag der Primärtumor im oberen Harntrakt. Bei 15 % der Patienten war die Krebserkrankung im Anschluss an eine neoadjuvante oder adjuvante Platin-basierte Therapie fortgeschritten. 21 % hatten im metastasierenden Stadium vorher zwei systemische Therapien erhalten. 76 % der Patienten hatten vorher Cisplatin erhalten, 23 % hatten vorher Carboplatin erhalten und 1 % wurde mit einem anderen Platin-basierten Regime behandelt.
Primäre Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS), das mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurde. Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) (mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet) und die Dauer des Ansprechens. Tabelle 25 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte für die ITT-Population nach finaler Analyse. Die Kaplan-Meier-Kurve basierend auf der finalen Analyse für OS ist in Abbildung 24 dargestellt. Die Studie ergab statistisch signifikante Verbesserungen hinsichtlich OS und ORR bei den Patienten unter Pembrolizumab im Vergleich zu Chemotherapie. Im Hinblick auf PFS zeigte sich zwischen Pembrolizumab und Chemotherapie kein statistisch signifikanter Unterschied.
Tabelle 25: Ansprechen auf Pembrolizumab 200 mg alle 3 Wochen bei Patienten mit Urothelkarzinom nach vorheriger Chemotherapie in KEYNOTE‑045
Endpunkt | Pembrolizumab | Chemotherapie |
n = 270 | n = 272 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 200 (74 %) | 219 (81 %) |
Hazard-Ratio* (95-%-KI) | 0,70 (0,57; 0,85) | |
p-Wert† | < 0,001 | |
Median in Monaten (95-%-KI) | 10,1 (8,0; 12,3) | 7,3 (6,1; 8,1) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)‡ | ||
Anzahl (%) Patienten mit Ereignis | 233 (86 %) | 237 (87 %) |
Hazard-Ratio* (95-%-KI) | 0,96 (0,79; 1,16) | |
p-Wert† | 0,313 | |
Median in Monaten (95-%-KI) | 2,1 (2,0; 2,2) | 3,3 (2,4; 3,6) |
Objektive Ansprechrate‡ | ||
ORR % (95-%-KI) | 21 % (16; 27) | 11 % (8; 15) |
p-Wert§ | < 0,001 | |
Vollständiges Ansprechen | 9 % | 3 % |
Partielles Ansprechen | 12 % | 8 % |
Stabile Erkrankung | 17 % | 34 % |
Dauer des Ansprechens‡, ¶ | ||
Median in Monaten (Spanne) | Nicht erreicht | 4,4 |
Anzahl (%#) Patienten mit einer Dauer ≥ 6 Monaten | 46 (84 %) | 8 (47 %) |
Anzahl (%#) Patienten mit einer Dauer ≥ 12 Monaten | 35 (68 %) | 5 (35 %) |
* Hazard-Ratio (Pembrolizumab im Vergleich zu Chemotherapie) basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 24: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑045 (Intent-to-Treat-Population)
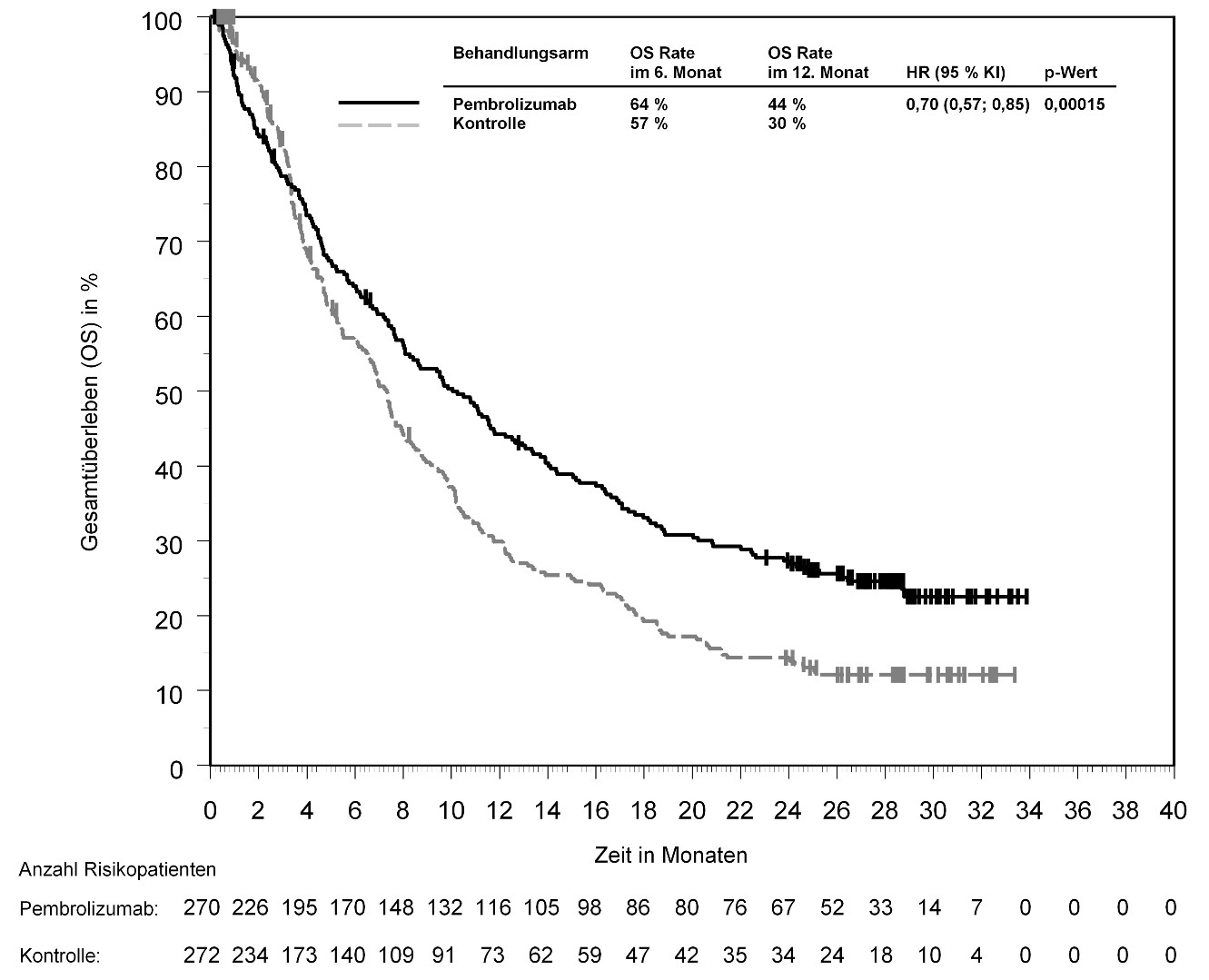
In KEYNOTE‑045 wurde sowohl im Pembrolizumab- als auch im Chemotherapie-Arm eine Analyse bei Patienten mit einem PD‑L1 CPS von < 10 [Pembrolizumab: n = 186 (69 %) versus Chemotherapie: n = 176 (65 %)] beziehungsweise mit einem CPS von ≥ 10 [Pembrolizumab: n = 74 (27 %) versus Chemotherapie: n = 90 (33 %)] durchgeführt (siehe Tabelle 26).
Tabelle 26: Gesamtüberleben (OS) entsprechend PD‑L1-Expression
PD-L1-Expression | Pembrolizumab | Chemotherapie | ||
OS entsprechend PD‑L1-Expression | Hazard-Ratio† | |||
CPS < 10 | 140 (75 %) | 144 (82 %) | 0,75 (0,59; 0,95) | |
CPS ≥ 10 | 53 (72 %) | 72 (80 %) | 0,55 (0,37; 0,81) | |
* Basierend auf der finalen Analyse | ||||
Die von Patienten berichteten Ergebnisse („Patient-reported outcomes“ [PROs]) wurden mittels des „European Organization for Research and Treatment of Cancer“ Quality of Life Questionnaire (EORTC QLQ-C30) ausgewertet. Bei Patienten unter Pembrolizumab wurde im Vergleich zu einer Chemotherapie nach Maßgabe des Prüfarztes eine verlängerte Zeitspanne bis zu einer Verschlechterung des allgemeinen Gesundheitsstatus/QoL (EORTC QLQ-C30 global health status/QoL) beobachtet (HR 0,70; 95-%-KI: 0,55 – 0,90). Über 15 Wochen Nachbeobachtungszeit hatten Patienten unter Pembrolizumab einen stabilen allgemeinen Gesundheitsstatus/QoL, während diejenigen unter Chemotherapie nach Maßgabe des Prüfarztes eine Verschlechterung des allgemeinen Gesundheitsstatus/QoL berichteten. Diese Ergebnisse sollten im Kontext des offenen Studiendesigns interpretiert werden und daher mit Vorbehalt gesehen werden.
KEYNOTE‑052: Offene Studie bei Patienten mit Urothelkarzinom, die nicht für eine Cisplatin-basierte Therapie geeignet sind
Die Sicherheit und Wirksamkeit von Pembrolizumab wurden in KEYNOTE‑052, einer multizentrischen, offenen Studie zur Behandlung des lokal fortgeschrittenen oder metastasierenden Urothelkarzinoms bei Patienten, die nicht für eine Cisplatin-basierte Chemotherapie geeignet waren, untersucht. Die Patienten erhielten Pembrolizumab in einer Dosierung von 200 mg alle 3 Wochen bis zum Auftreten unzumutbarer Toxizität oder bis zum Fortschreiten der Krebserkrankung. Die Behandlung konnte bei Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Patienten ohne Fortschreiten der Krebserkrankung konnten bis zu 24 Monaten behandelt werden. Von der Studie ausgeschlossen waren Patienten mit einer Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte. Eine Bewertung des Tumorstatus erfolgte 9 Wochen nach der ersten Dosis, danach alle 6 Wochen innerhalb des ersten Jahres, im Anschluss daran alle 12 Wochen.
Die 370 Patienten mit Urothelkarzinom, die nicht für eine Cisplatin-basierte Therapie geeignet waren, waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 74 Jahre (82 % waren 65 Jahre oder älter); 77 % waren Männer; 89 % waren kaukasischer und 7 % asiatischer Herkunft. Bei 88 % lagen Metastasen im M1-Stadium vor und bei 12 % lagen keine Metastasen vor (M0). Bei 85 % der Patienten lagen viszerale Metastasen vor, einschließlich 21 % mit Lebermetastasen. Die Gründe für eine fehlende Eignung für Cisplatin umfassten: eine Kreatinin-Clearance von < 60 ml/min (50 %) zu Studienbeginn, ein ECOG-Performance-Status von 2 (32 %), ein ECOG-Performance-Status von 2 mit einer Kreatinin-Clearance von < 60 ml/min (9 %) zu Studienbeginn sowie andere Gründe (Klasse-III-Herzinsuffizienz, periphere Neuropathie ≥ Grad 2 sowie Hörverlust ≥ Grad 2; 9 %). 90 % der Patienten waren behandlungsnaiv und 10 % hatten eine vorhergehende adjuvante oder neoadjuvante Platin-basierte Therapie erhalten. Bei 81 % der Patienten lag der Primärtumor im unteren Harntrakt und bei 19 % lag der Primärtumor im oberen Harntrakt.
Der primäre Wirksamkeitsendpunkt war die Objektive Ansprechrate (ORR), die mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurde. Sekundäre Wirksamkeitsendpunkte waren die Dauer des Ansprechens, das Überleben ohne Fortschreiten der Krebserkrankung (PFS) und das Gesamtüberleben (OS). Tabelle 27 zeigt eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte der Studienpopulation nach finaler Analyse basierend auf einer medianen Nachbeobachtungszeit von 11,4 Monaten (Spanne: 0,1; 41,2 Monate) bei allen Patienten.
Tabelle 27: Ansprechen auf Pembrolizumab 200 mg alle 3 Wochen bei Patienten mit Urothelkarzinom, die nicht für eine Cisplatin-basierte Chemotherapie geeignet waren, in KEYNOTE‑052
Endpunkt | n = 370 |
Objektive Ansprechrate* | |
ORR % (95-%-KI) | 29 % (24; 34) |
Krankheitskontrollrate† | 47 % |
Vollständiges Ansprechen | 9 % |
Partielles Ansprechen | 20 % |
Stabile Erkrankung | 18 % |
Dauer des Ansprechens | |
Median in Monaten (Spanne) | 30,1 |
% mit einer Dauer ≥ 6 Monaten | 81 %‡ |
Zeit bis zum Ansprechen | |
Median in Monaten (Spanne) | 2,1 (1,3; 9,0) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)* | |
Median in Monaten (95-%-KI) | 2,2 (2,1; 3,4) |
6-Monats-PFS-Rate | 33 % |
12-Monats-PFS-Rate | 22 % |
Gesamtüberleben (OS) | |
Median in Monaten (95-%-KI) | 11,3 (9,7; 13,1) |
6-Monats-OS-Rate | 67 % |
12-Monats-OS-Rate | 47 % |
* Bewertet mittels BICR gemäß RECIST‑v1.1 | |
In KEYNOTE‑052 wurde eine Analyse bei Patienten mit PD‑L1-exprimierenden Tumoren mit CPS < 10 (n = 251; 68 %) bzw. ≥ 10 (n = 110; 30 %) basierend auf dem PD‑L1 IHC 22C3 pharmDxTM Kit durchgeführt (siehe Tabelle 28).
Tabelle 28: Objektive Ansprechrate (ORR) und Gesamtüberleben (OS) entsprechend PD‑L1-Expression
Endpunkt | CPS < 10 | CPS ≥ 10 |
Objektive Ansprechrate* | ||
ORR % (95-%-KI) | 20 % (16; 26) | 47 % (38; 57) |
Gesamtüberleben (OS) | ||
Median in Monaten (95-%-KI) | 10 (8; 12) | 19 (12; 29) |
12-Monats-OS-Rate | 41 % | 61 % |
* BICR mittels RECIST‑v1.1 | ||
KEYNOTE‑361 ist eine randomisierte, kontrollierte, offene klinische Phase-III-Studie mit Pembrolizumab mit oder ohne Platin-basierte Kombinationstherapie (d. h. entweder Cisplatin oder Carboplatin mit Gemcitabin) versus Chemotherapie als Erstlinienbehandlung bei Patienten mit fortgeschrittenem oder metastasierendem Urothelkarzinom. Die Ergebnisse von KEYNOTE-361 zeigten keine statistisch signifikante Verbesserung des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien (HR 0,78; 95-%-KI: 0,65; 0,93; p = 0,0033) und des Gesamtüberlebens (OS) (HR 0,86; 95-%-KI: 0,72; 1,02; p = 0,0407) unter Pembrolizumab in Kombination mit Chemotherapie im Vergleich zu Chemotherapie allein. Entsprechend der präspezifizierten hierarchischen Testreihenfolge konnten keine formalen Überprüfungen der statistischen Signifikanz einer Pembrolizumab-Therapie versus Chemotherapie durchgeführt werden. Die primären Wirksamkeitsergebnisse einer Pembrolizumab-Monotherapie bei Patienten, für die nach Ermessen des Prüfarztes Carboplatin anstatt Cisplatin die besser geeignete Chemotherapie war, waren konsistent mit den Ergebnissen von KEYNOTE‑052. Die Wirksamkeitsergebnisse bei Patienten mit PD‑L1-exprimierenden Tumoren (CPS ≥ 10) entsprachen der Gesamtpopulation, für die Carboplatin als Chemotherapie gewählt wurde. Siehe Tabelle 29 sowie die Abbildungen 25 und 26.
Tabelle 29: Ansprechen auf Pembrolizumab 200 mg alle 3 Wochen oder Chemotherapie bei Patienten mit zuvor unbehandeltem Urothelkarzinom in KEYNOTE‑361, für die nach Ermessen des Prüfarztes Carboplatin anstatt Cisplatin die besser geeignete Chemotherapie war
Endpunkt | Pembrolizumab | Chemotherapie | Pembrolizumab | Chemotherapie |
n = 170 | n = 196 | n = 84 | n = 89 | |
Objektive Ansprechrate (ORR)* | ||||
ORR % (95-%-KI) | 28 % (21,1; 35,0) | 42 % (34,8; 49,1) | 30 % (20,3; 40,7) | 46 % (35,4; 57,0) |
Vollständiges Ansprechen | 10 % | 11 % | 12 % | 18 % |
Partielles Ansprechen | 18 % | 31 % | 18 % | 28 % |
Dauer des Ansprechens* | ||||
Median in Monaten (Spanne) | Nicht erreicht (3,2+; 36,1+) | 6,3 (1,8+; 33,8+) | Nicht erreicht (4,2; 36,1+) | 8,3 (2,1+; 33,8+) |
% mit einer Dauer ≥ 12 Monaten† | 57 % | 30 % | 63 % | 38 % |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)* | ||||
Median in Monaten (95-%-KI) | 3,2 (2,2; 5,5) | 6,7 (6,2; 8,1) | 3,9 (2,2; 6,8) | 7,9 (6,1; 9,3) |
12‑Monats-PFS-Rate | 25 % | 24 % | 26 % | 31 % |
Gesamtüberleben (OS) | ||||
Median in Monaten (95-%-KI) | 14,6 (10,2; 17,9) | 12,3 (10,0; 15,5) | 15,6 (8,6; 19,7) | 13,5 (9,5; 21,0) |
12‑Monats-OS-Rate | 54 % | 51 % | 57 % | 54 % |
* Bewertet mittels BICR gemäß RECIST‑v1.1 | ||||
Abbildung 25: Kaplan‑Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑361 (Intent-to-Treat-Population bei Wahl von Carboplatin)
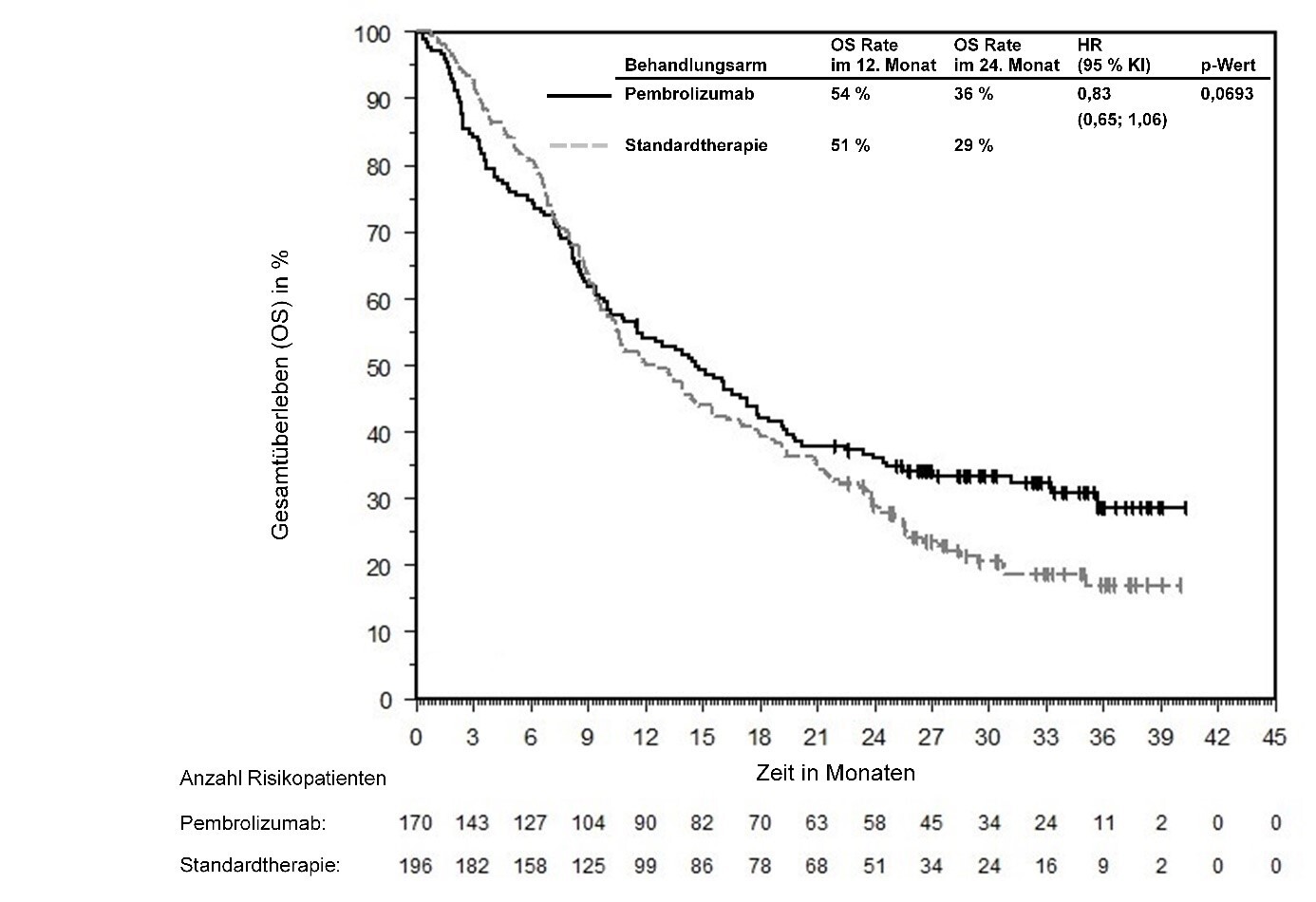
Abbildung 26: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑361 (Patienten mit PD-L1 Expression CPS ≥ 10, Intent-to-Treat-Population bei Wahl von Carboplatin)
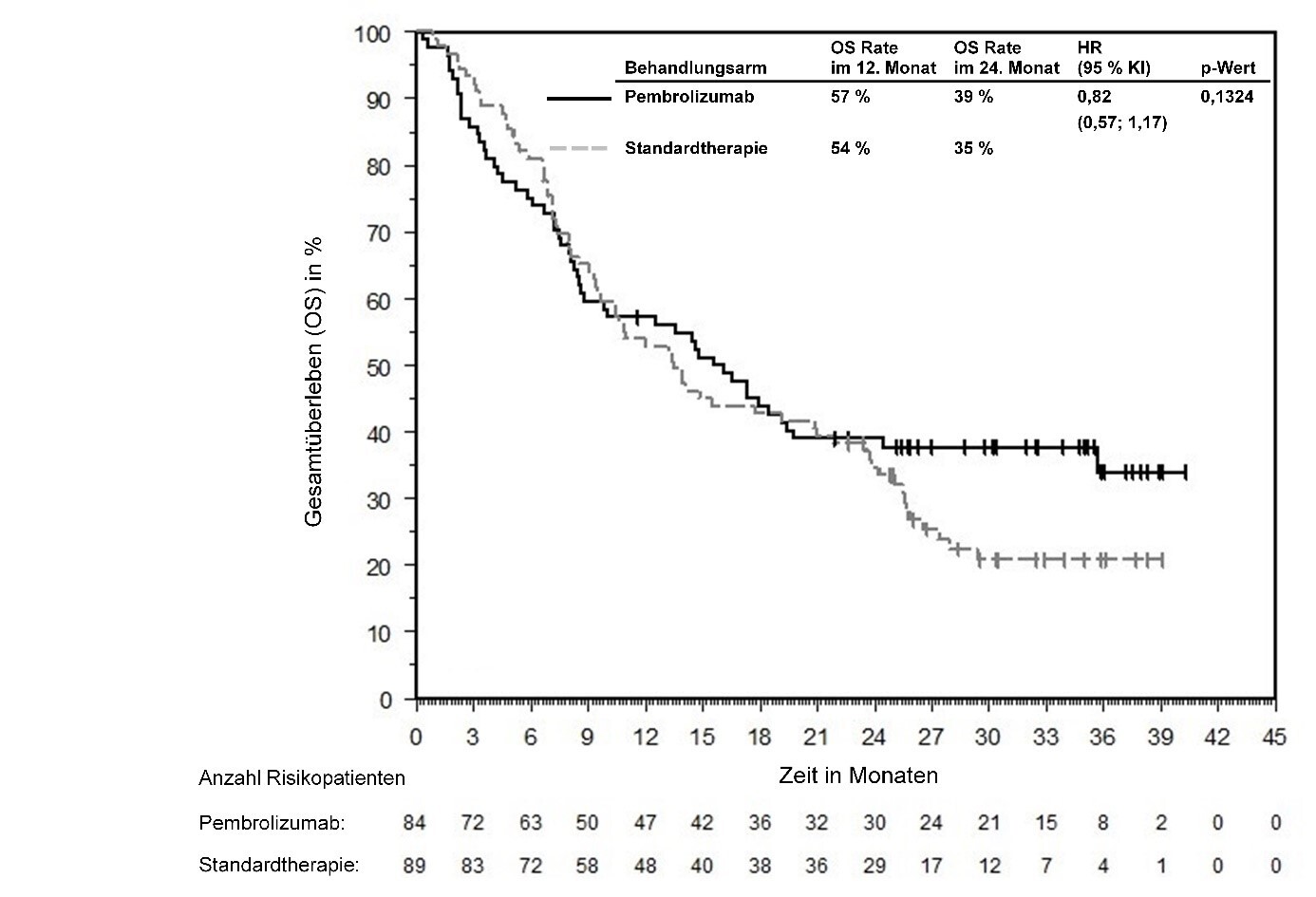
Plattenepithelkarzinom der Kopf-Hals-Region (HNSCC)
KEYNOTE‑048: Kontrollierte Studie einer Mono- und Kombinationstherapie bei nicht-vorbehandelten Patienten mit rezidivierendem oder metastasierendem HNSCC
Die Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑048, einer multizentrischen, randomisierten, offenen, aktiv-kontrollierten Studie zur Behandlung des histologisch bestätigten metastasierenden oder rezidivierenden HNSCC der Mundhöhle, des Larynx oder Pharynx bei Patienten untersucht, die keine vorhergehende systemische Therapie ihrer rezidivierenden oder metastasierenden Krebserkrankung erhalten hatten und die als nicht heilbar durch lokale Therapien galten. Patienten mit nasopharyngealem Karzinom, einer aktiven Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach PD‑L1-Expression des Tumors (TPS ≥ 50 % oder TPS < 50 %), HPV-Status (positiv oder negativ) sowie ECOG-Performance-Status (0 vs. 1) stratifiziert. Die Patienten wurden im Verhältnis 1:1:1 in einen der folgenden Behandlungsarme randomisiert:
Pembrolizumab 200 mg alle 3 Wochen (Pembrolizumab-Monotherapie)
Pembrolizumab 200 mg alle 3 Wochen, Carboplatin AUC 5 mg/ml/min alle 3 Wochen oder Cisplatin 100 mg/m2 alle 3 Wochen und 5‑FU 1 000 mg/m2/Tag über 4 aufeinander folgende Tage alle 3 Wochen (maximal 6 Zyklen Platin und 5‑FU) (Pembrolizumab-Kombinationstherapie)
Cetuximab 400 mg/m2 zu Beginn und im Anschluss 250 mg/m2 einmal wöchentlich, Carboplatin AUC 5 mg/ml/min alle 3 Wochen oder Cisplatin 100 mg/m2 alle 3 Wochen und 5‑FU 1 000 mg/m2/Tag über 4 aufeinander folgende Tage alle 3 Wochen (maximal 6 Zyklen Platin und 5‑FU) (Standardtherapie)
Die Behandlung mit Pembrolizumab wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten und durch einen Prüfarzt bestätigten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Gabe von Pembrolizumab konnte nach gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Eine Bewertung des Tumorstatus erfolgte nach 9 Wochen, danach alle 6 Wochen im ersten Jahr, im Anschluss daran alle 9 Wochen bis zu 24 Monaten.
In KEYNOTE‑048 wiesen 754 Patienten (85 %) von 882 Patienten PD‑L1-exprimierende Tumoren (CPS ≥ 1; basierend auf dem PD‑L1 IHC 22C3 pharmDx™ Kit) auf. Diese 754 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 61 Jahre (Spanne: 20 bis 94 Jahre); 36 % waren 65 Jahre oder älter; 82 % waren Männer; 74 % waren kaukasischer und 19 % asiatischer Herkunft; bei 61 % lag ein ECOG-Performance-Status von 1 vor und 77 % waren ehemalige oder aktive Raucher. Die Krebserkrankung war wie folgt charakterisiert: bei 21 % lagen HPV-positive Tumoren vor und bei 95 % der Patienten lag ein Erkrankungsstadium von IV vor (Stadium IVa 21 %; Stadium IVb 6 % und Stadium IVc 69 %).
Die primären Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) (bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien). Die Studie ergab eine statistisch signifikante Verbesserung für das Gesamtüberleben aller Patienten im Pembrolizumab-Kombinationstherapie-Arm im Vergleich zur Standardtherapie (HR 0,72; 95-%-KI: 0,60 – 0,87) sowie bei Patienten mit PD‑L1-exprimierenden Tumoren (CPS ≥ 1) im Pembrolizumab-Monotherapie-Arm im Vergleich zur Standardtherapie. Tabelle 30 und Tabelle 31 enthalten eine Zusammenfassung der primären Wirksamkeitsendpunkte für Pembrolizumab bei Patienten mit PD‑L1-exprimierenden Tumoren (CPS ≥ 1) in KEYNOTE‑048 nach finaler Analyse und einer Nachbeobachtungszeit von im Median 13 Monaten im Pembrolizumab-Kombinationstherapie-Arm sowie von im Median 11,5 Monaten im Pembrolizumab-Monotherapie-Arm. Die Kaplan-Meier-Kurven für das Gesamtüberleben (OS) basierend auf den finalen Analysen sind in den Abbildungen 27 und 28 dargestellt.
Tabelle 30: Wirksamkeitsergebnisse für die Pembrolizumab-Kombinationstherapie (Pembrolizumab + Platin + 5‑FU) in KEYNOTE‑048 mit PD‑L1-Expression (CPS ≥ 1)
Endpunkt | Pembrolizumab + | Standardtherapie* |
n = 242 | n = 235 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 177 (73 %) | 213 (91 %) |
Median in Monaten (95-%-KI) | 13,6 (10,7; 15,5) | 10,4 (9,1; 11,7) |
Hazard-Ratio† (95-%-KI) | 0,65 (0,53; 0,80) | |
p-Wert‡ | 0,00002 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 212 (88 %) | 221 (94 %) |
Median in Monaten (95-%-KI) | 5,1 (4,7; 6,2) | 5,0 (4,8; 6,0) |
Hazard-Ratio† (95-%-KI) | 0,84 (0,69; 1,02) | |
p-Wert‡ | 0,03697 | |
Objektive Ansprechrate | ||
ORR§ % (95-%-KI) | 36 % (30,3; 42,8) | 36 % (29,6; 42,2) |
Vollständiges Ansprechen | 7 % | 3 % |
Partielles Ansprechen | 30 % | 33 % |
p-Wert¶ | 0,4586 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 6,7 (1,6+; 39,0+) | 4,3 (1,2+; 31,5+) |
% mit einer Dauer ≥ 6 Monaten | 54 % | 34 % |
* Cetuximab, Platin und 5‑FU | ||
Abbildung 27: Kaplan-Meier-Kurve für Gesamtüberleben (OS) für die Pembrolizumab-Kombinationstherapie (Pembrolizumab + Platin + 5‑FU) in KEYNOTE‑048 (PD‑L1-Expression CPS ≥ 1)
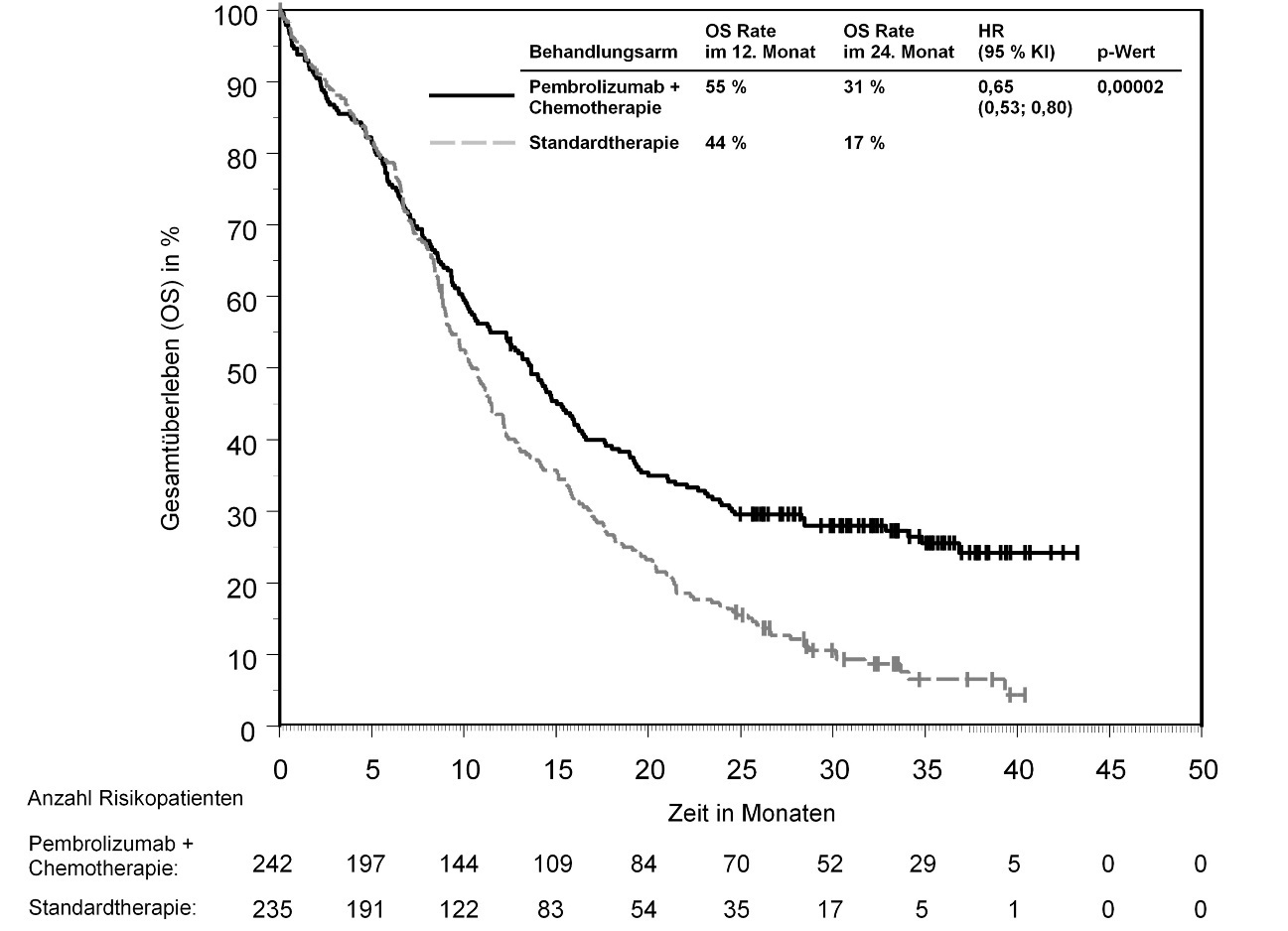
Tabelle 31: Wirksamkeitsergebnisse für die Pembrolizumab-Monotherapie in KEYNOTE‑048 mit PD‑L1-Expression (CPS ≥ 1)
Endpunkt | Pembrolizumab | Standardtherapie* |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 197 (77 %) | 229 (90 %) |
Median in Monaten (95-%-KI) | 12,3 (10,8; 14,3) | 10,3 (9,0; 11,5) |
Hazard-Ratio† (95-%-KI) | 0,74 (0,61; 0,90) | |
p-Wert‡ | 0,00133 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 228 (89 %) | 237 (93 %) |
Median in Monaten (95-%-KI) | 3,2 (2,2; 3,4) | 5,0 (4,8; 6,0) |
Hazard-Ratio† (95-%-KI) | 1,13 (0,94; 1,36) | |
p-Wert‡ | 0,89580 | |
Objektive Ansprechrate (ORR) | ||
ORR§ % (95-%-KI) | 19,1 % (14,5; 24,4) | 35 % (29,1; 41,1) |
Vollständiges Ansprechen | 5 % | 3 % |
Partielles Ansprechen | 14 % | 32 % |
p-Wert¶ | 1,0000 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 23,4 (1,5+; 43,0+) | 4,5 (1,2+; 38,7+) |
% mit einer Dauer ≥ 6 Monaten | 81 % | 36 % |
* Cetuximab, Platin und 5‑FU | ||
Abbildung 28: Kaplan-Meier-Kurve für Gesamtüberleben (OS) für die Pembrolizumab-Monotherapie in KEYNOTE‑048 (PD‑L1-Expression CPS ≥ 1)
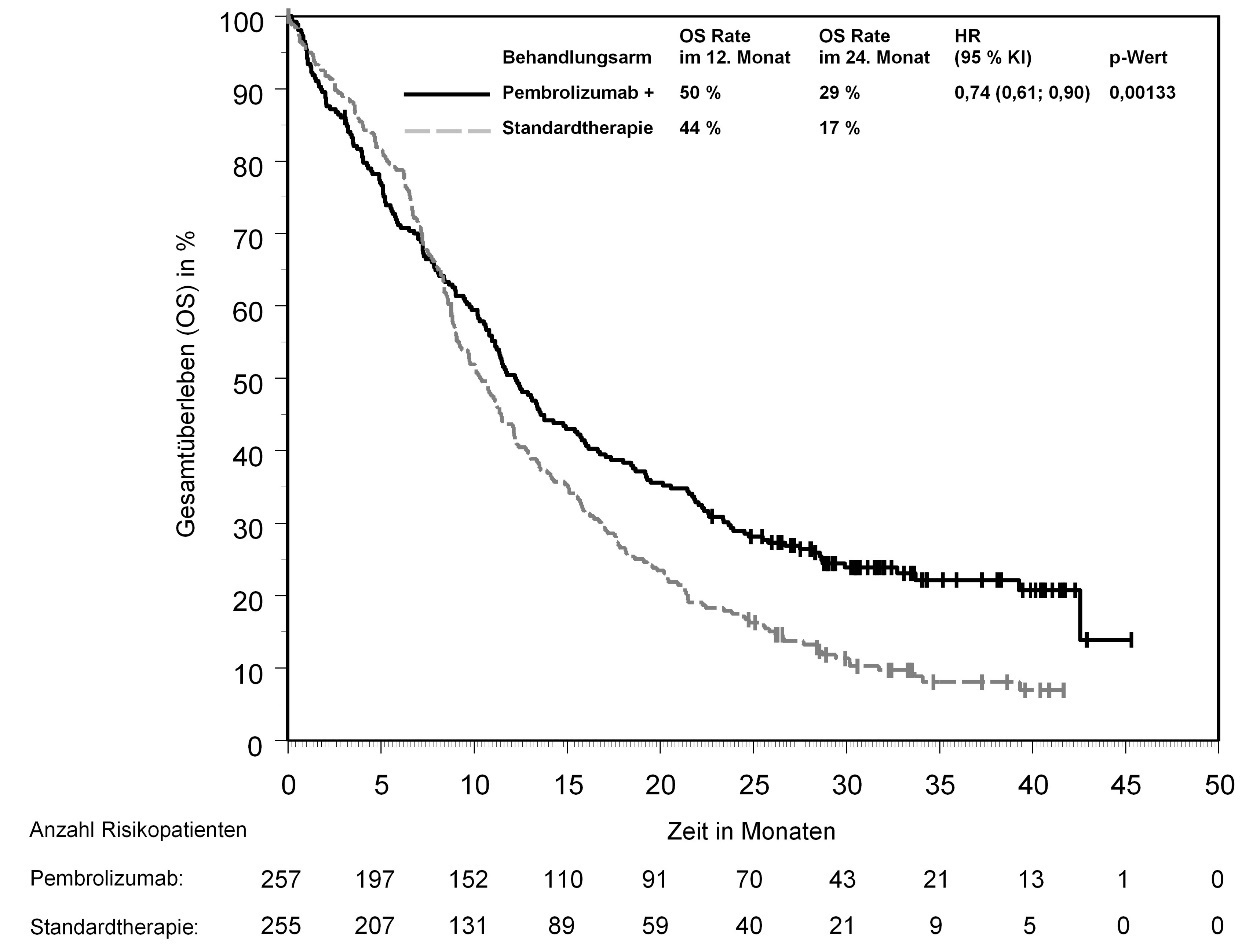
KEYNOTE‑048 wurde hinsichtlich der Patientenpopulation, deren Tumoren PD‑L1 (CPS ≥ 20) exprimierten [Pembrolizumab-Kombinationstherapie: n = 126 (49 %) vs. Standardtherapie: n = 110 (43 %) und Pembrolizumab-Monotherapie: n = 133 (52 %) vs. Standardtherapie: n = 122 (48 %)], ausgewertet (siehe Tabelle 32).
Tabelle 32: Wirksamkeitsergebnisse für die Pembrolizumab-Kombinationstherapie (Pembrolizumab + Platin + 5‑FU) und für die Pembrolizumab-Monotherapie nach PD‑L1-Expression in KEYNOTE‑048 (CPS ≥ 20)
Endpunkt | Pembrolizumab + | Standardtherapie* | Pembrolizumab-Monotherapie | Standardtherapie* |
n = 126 | n = 110 | n = 133 | n = 122 | |
Gesamtüberleben (OS) | ||||
Anzahl (%) Patienten mit Ereignis | 84 (66,7 %) | 98 (89,1 %) | 94 (70,7 %) | 108 (88,5 %) |
Median in Monaten (95-%-KI) | 14,7 (10,3; 19,3) | 11,0 (9,2; 13,0) | 14,8 (11,5; 20,6) | 10,7 (8,8; 12,8) |
Hazard-Ratio† (95-%-KI) | 0,60 (0,45; 0,82) | 0,58 (0,44; 0,78) | ||
p-Wert‡ | 0,00044 | 0,00010 | ||
OS-Rate nach 6 Monaten (95-%-KI) | 74,6 (66,0; 81,3) | 80,0 (71,2; 86,3) | 74,4 (66,1; 81,0) | 79,5 (71,2; 85,7) |
OS-Rate nach 12 Monaten (95-%-KI) | 57,1 (48,0; 65,2) | 46,1 (36,6; 55,1) | 56,4 (47,5; 64,3) | 44,9 (35,9; 53,4) |
OS-Rate nach 24 Monaten (95-%-KI) | 35,4 (27,2; 43,8) | 19,4 (12,6; 27,3) | 35,3 (27,3; 43,4) | 19,1 (12,7; 26,6) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||||
Anzahl (%) Patienten mit Ereignis | 106 (84,1 %) | 104 (94,5 %) | 115 (86,5 %) | 114 (93,4 %) |
Median in Monaten (95-%-KI) | 5,8 (4,7; 7,6) | 5,3 (4,9; 6,3) | 3,4 (3,2; 3,8) | 5,3 (4,8; 6,3) |
Hazard-Ratio† (95-%-KI) | 0,76 (0,58; 1,01) | 0,99 (0,76; 1,29) | ||
p-Wert‡ | 0,02951 | 0,46791 | ||
PFS-Rate nach 6 Monaten (95-%-KI) | 49,4 (40,3; 57,9) | 47,2 (37,5; 56,2) | 33,0 (25,2; 41,0) | 46,6 (37,5; 55,2) |
PFS-Rate nach 12 Monaten (95-%-KI) | 23,9 (16,7; 31,7) | 14,0 (8,2; 21,3) | 23,5 (16,6; 31,1) | 15,1 (9,3; 22,2) |
PFS-Rate nach 24 Monaten (95-%-KI) | 14,6 (8,9; 21,5) | 5,0 (1,9; 10,5) | 16,8 (10,9; 23,8) | 6,1 (2,7; 11,6) |
Objektive Ansprechrate (ORR) | ||||
ORR§ % (95-%-KI) | 42,9 (34,1; 52,0) | 38,2 (29,1; 47,9) | 23,3 (16,4; 31,4) | 36,1 (27,6; 45,3) |
Dauer des Ansprechens | ||||
Anzahl Patienten mit Ansprechen | 54 | 42 | 31 | 44 |
Median in Monaten (Spanne) | 7,1 (2,1+; 39,0+) | 4,2 (1,2+; 31,5+) | 22,6 (2,7+; 43,0+) | 4,2 (1,2+; 31,5+) |
* Cetuximab, Platin und 5‑FU | ||||
KEYNOTE‑048 wurde hinsichtlich der Patientensubpopulation, deren Tumoren PD‑L1 (CPS ≥ 1 bis < 20) exprimierten [Pembrolizumab-Kombinationstherapie: n = 116 (45 %) vs. Standardtherapie: n = 125 (49 %) und Pembrolizumab-Monotherapie: n = 124 (48 %) vs. Standardtherapie: n = 133 (52 %)], explorativ ausgewertet (siehe Tabelle 33).
Tabelle 33: Wirksamkeitsergebnisse für die Pembrolizumab-Kombinationstherapie (Pembrolizumab + Platin + 5‑FU) und die Pembrolizumab-Monotherapie nach PD‑L1-Expression in KEYNOTE‑048 (CPS ≥ 1 bis < 20)
Endpunkt | Pembrolizumab + | Standardtherapie* | Pembrolizumab-Monotherapie | Standardtherapie* |
Gesamtüberleben (OS) | ||||
Anzahl (%) Patienten mit Ereignis | 93 (80,2 %) | 115 (92,0 %) | 103 (83,1 %) | 121 (91,0 %) |
Median in Monaten (95-%-KI) | 12,7 (9,4; 15,3) | 9,9 (8,6; 11,5) | 10,8 (9,0; 12,6) | 10,1 (8,7; 12,1) |
Hazard-Ratio† (95-%-KI) | 0,71 (0,54; 0,94) | 0,86 (0,66; 1,12) | ||
OS-Rate nach 6 Monaten (95-%-KI) | 76,7 (67,9; 83,4) | 77,4 (69,0; 83,8) | 67,6 (58,6; 75,1) | 78,0 (70,0; 84,2) |
OS-Rate nach 12 Monaten (95-%-KI) | 52,6 (43,1; 61,2) | 41,1 (32,4; 49,6) | 44,0 (35,1; 52,5) | 42,4 (33,9; 50,7) |
OS-Rate nach 24 Monaten (95-%-KI) | 25,9 (18,3; 34,1) | 14,5 (9,0; 21,3) | 22,0 (15,1; 29,6) | 15,9 (10,3; 22,6) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||||
Anzahl (%) Patienten mit Ereignis | 106 (91,4 %) | 117 (93,6 %) | 113 (91,1 %) | 123 (92,5 %) |
Median in Monaten (95-%-KI) | 4,9 (4,2; 5,3) | 4,9 (3,7; 6,0) | 2,2 (2,1; 2,9) | 4,9 (3,8; 6,0) |
Hazard-Ratio† (95-%-KI) | 0,93 (0,71; 1,21) | 1,25 (0,96; 1,61) | ||
PFS-Rate nach 6 Monaten (95-%-KI) | 40,1 (31,0; 49,0) | 40,0 (31,2; 48,5) | 24,2 (17,1; 32,0) | 41,4 (32,8; 49,7) |
PFS-Rate nach 12 Monaten (95-%-KI) | 15,1 (9,1; 22,4) | 11,3 (6,4; 17,7) | 17,5 (11,4; 24,7) | 12,1 (7,2; 18,5) |
PFS-Rate nach 24 Monaten (95-%-KI) | 8,5 (4,2; 14,7) | 5,0 (1,9; 10,1) | 8,3 (4,3; 14,1) | 6,3 (2,9; 11,5) |
Objektive Ansprechrate (ORR) | ||||
ORR‡ % (95-%-KI) | 29,3 (21,2; 38,5) | 33,6 (25,4; 42,6) | 14,5 (8,8; 22,0) | 33,8 (25,9; 42,5) |
Dauer des Ansprechens | ||||
Anzahl Patienten mit Ansprechen | 34 | 42 | 18 | 45 |
Median in Monaten (Spanne) | 5,6 (1,6+; 25,6+) | 4,6 (1,4+; 31,4+) | Nicht erreicht (1,5+; 38,9+) | 5,0 (1,4+; 38,7+) |
* Cetuximab, Platin und 5‑FU | ||||
KEYNOTE‑040: Kontrollierte Studie bei Patienten mit HNSCC nach Vorbehandlung mit einer Platin-basierten Therapie
Die Sicherheit und Wirksamkeit von Pembrolizumab wurde in KEYNOTE‑040, einer multizentrischen, offenen, randomisierten, kontrollierten Studie zur Behandlung des histologisch bestätigten rezidivierenden oder metastasierenden HNSCC der Mundhöhle, des Pharynx oder Larynx bei Patienten mit Fortschreiten der Krebserkrankung während oder nach vorheriger Platin-basierter Therapie als Teil einer Induktions-, Begleit- oder adjuvanten Therapie und für die eine lokale Therapie mit kurativer Intention nicht in Frage kam, untersucht. Die Patienten wurden nach PD‑L1-Expression (TPS ≥ 50 %), HPV-Status sowie ECOG-Performance-Status stratifiziert und anschließend randomisiert (1:1) Pembrolizumab 200 mg alle 3 Wochen (n = 247) oder einer der drei Standardtherapien (n = 248) zugeteilt: Methotrexat 40 mg/m2 einmal wöchentlich (n = 64), Docetaxel 75 mg/m2 einmal alle 3 Wochen (n = 99) oder Cetuximab 400 mg/m2 als Anfangsdosis und anschließend 250 mg/m2 einmal wöchentlich (n = 71). Die Behandlung konnte bei Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Patienten mit nasopharyngealem Karzinom, einer aktiven Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, sowie Patienten, die zuvor drei oder mehr systemische Therapieregime zur Behandlung des rezidivierenden und/oder metastasierenden HNSCC erhalten hatten, waren von der Studie ausgeschlossen. Eine Bewertung des Tumorstatus erfolgte nach 9 Wochen, danach alle 6 Wochen bis Woche 52, im Anschluss daran alle 9 Wochen bis zu 24 Monaten.
Unter den 495 Patienten in KEYNOTE‑040 waren 129 (26 %) Patienten mit PD‑L1-exprimierenden Tumoren mit einem TPS ≥ 50 % (basierend auf dem PD‑L1 IHC 22C3 pharmDxTM Kit). Zu Studienbeginn waren diese 129 Patienten wie folgt charakterisiert: medianes Alter 62 Jahre (40 % waren 65 Jahre oder älter); 81 % waren Männer; 78 % waren kaukasischer, 11 % waren asiatischer und 2 % waren afrikanischer Herkunft; ein ECOG-Performance-Status von 0 bzw. 1 lag bei 23 % bzw. 77 % vor; bei 19 % lagen HPV-positive Tumoren vor. Bei 67 % der Patienten lagen Metastasen im M1-Stadium vor, bei der Mehrheit der Patienten lag ein Erkrankungsstadium von IV vor (Stadium IV 32 %; Stadium IVa 14 %; Stadium IVb 4 % und Stadium IVc 44 %). Bei 16 % der Patienten war die Krebserkrankung im Anschluss an eine neoadjuvante oder adjuvante Platin-basierte Therapie fortgeschritten und 84 % der Patienten hatten ein bis zwei vorherige systemische Therapieregime für ihre metastasierende Erkrankung erhalten.
Der primäre Wirksamkeitsendpunkt war das Gesamtüberleben (OS) in der ITT-Population. Die initiale Analyse ergab für das Gesamtüberleben (OS) eine Hazard-Ratio von 0,82 (95-%-KI: 0,67; 1,01) mit einem einseitigen p‑Wert von 0,0316. Das mediane Gesamtüberleben (OS) betrug 8,4 Monate unter Pembrolizumab im Vergleich zu 7,1 Monaten unter Standardtherapie. Tabelle 34 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte für die Population mit TPS ≥ 50 %. Die Kaplan-Meier-Kurve für das Gesamtüberleben (OS) für die Population mit TPS ≥ 50 % ist in Abbildung 29 dargestellt.
Tabelle 34: Wirksamkeit von Pembrolizumab 200 mg alle 3 Wochen bei Patienten mit HNSCC mit TPS ≥ 50 % mit vorheriger Platin-basierter Therapie in KEYNOTE‑040
Endpunkt | Pembrolizumab | Standardtherapie* |
n = 64 | n = 65 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 41 (64 %) | 56 (86 %) |
Hazard-Ratio† (95-%-KI) | 0,53 (0,35; 0,81) | |
p-Wert‡ | 0,001 | |
Median in Monaten (95-%-KI) | 11,6 (8,3; 19,5) | 6,6 (4,8; 9,2) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)§ | ||
Anzahl (%) Patienten mit Ereignis | 52 (81 %) | 58 (89 %) |
Hazard-Ratio† (95-%-KI) | 0,58 (0,39; 0,86) | |
p-Wert‡ | 0,003 | |
Median in Monaten (95-%-KI) | 3,5 (2,1; 6,3) | 2,1 (2,0; 2,4) |
6-Monats-PFS-Rate (%) (95-%-KI) | 40,1 (28,1; 51,9) | 17,1 (8,8; 27,7) |
Objektive Ansprechrate (ORR)§ | ||
ORR % (95-%-KI) | 26,6 (16,3; 39,1) | 9,2 (3,5; 19,0) |
p-Wert¶ | 0,0009 | |
Vollständiges Ansprechen | 5 % | 2 % |
Partielles Ansprechen | 22 % | 8 % |
Stabile Erkrankung | 23 % | 23 % |
Dauer des Ansprechens§, # | ||
Median in Monaten (Spanne) | Nicht erreicht (2,7; 13,8+) | 6,9 (4,2; 18,8) |
Anzahl (%Þ) Patienten mit einer Dauer ≥ 6 Monaten | 9 (66 %) | 2 (50 %) |
* Methotrexat, Docetaxel oder Cetuximab | ||
Abbildung 29: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑040 für Patienten mit einer PD‑L1-Expression (TPS ≥ 50 %)
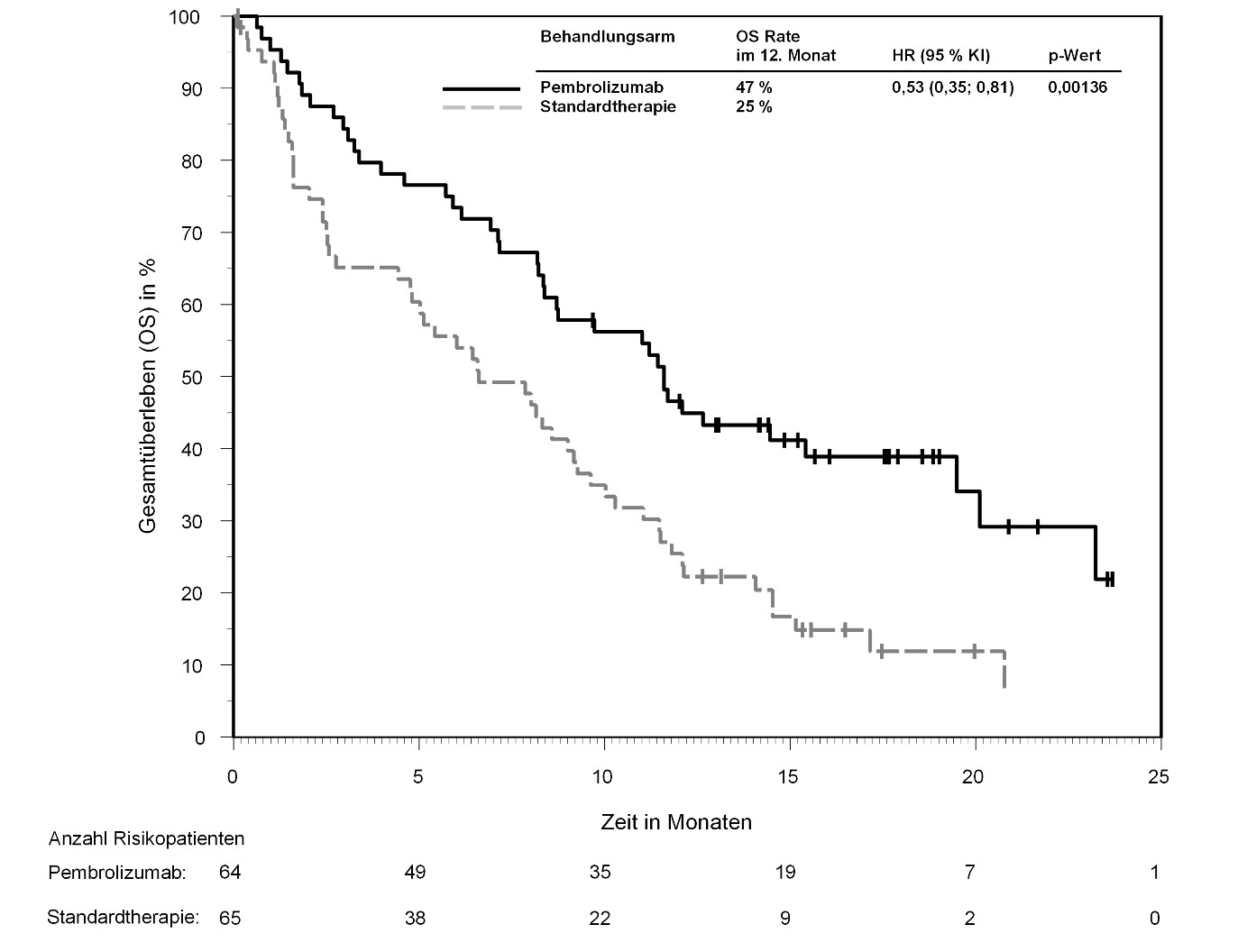
Nierenzellkarzinom
KEYNOTE‑426: Kontrollierte Studie einer Kombinationstherapie mit Axitinib bei nicht-vorbehandelten Patienten mit Nierenzellkarzinom (RCC)
Die Wirksamkeit von Pembrolizumab in Kombination mit Axitinib wurde im Rahmen der Studie KEYNOTE‑426, einer randomisierten, multizentrischen, offenen, aktiv-kontrollierten Studie, untersucht, die mit Patienten mit fortgeschrittenem RCC mit Klarzellkomponente, ungeachtet des PD‑L1-Tumor-Expressions-Status und eingeteilt nach Risikogruppenkategorien des „International Metastatic RCC Database Consortium“ (IMDC), durchgeführt wurde. Patienten mit einer Autoimmunerkrankung oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach Risikokategorien (günstig versus intermediär versus ungünstig) sowie nach geografischer Region (Nordamerika versus Westeuropa versus „Rest der Welt“) stratifiziert. Die Patienten wurden randomisiert (1:1) einem der folgenden Studienarme zugeteilt:
Pembrolizumab 200 mg intravenös alle 3 Wochen in Kombination mit Axitinib 5 mg zum Einnehmen, zweimal/Tag. Patienten, die Axitinib 5 mg zweimal/Tag in zwei aufeinanderfolgenden Behandlungszyklen (d. h. 6 Wochen) vertrugen und keine > Grad 2 behandlungsbedingten Nebenwirkungen auf Axitinib sowie einen gut-kontrollierten Blutdruck ≤ 150/90 mmHg hatten, durften die Dosis von Axitinib auf 7 mg zweimal/Tag steigern. Eine Dosissteigerung von Axitinib auf 10 mg zweimal/Tag war nach den gleichen Kriterien gestattet. Zur Steuerung der Toxizität konnte die Behandlung mit Axitinib unterbrochen oder auf 3 mg zweimal/Tag und anschließend auf 2 mg zweimal/Tag reduziert werden.
Sunitinib 50 mg zum Einnehmen, einmal/Tag für 4 Wochen mit anschließender 2-wöchiger Behandlungspause.
Die Behandlung mit Pembrolizumab und Axitinib wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten und entweder von einem verblindeten unabhängigen zentralen Review (BICR) oder vom Prüfarzt bestätigten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität, oder im Fall von Pembrolizumab, bis zu maximal 24 Monaten fortgeführt. Die Gabe von Pembrolizumab und Axitinib konnte bei gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Eine Bewertung des Tumorstatus erfolgte zu Studienbeginn, nach Randomisierung in Woche 12, dann alle 6 Wochen bis Woche 54 und im Anschluss daran alle 12 Wochen.
Insgesamt wurden 861 Patienten randomisiert. Die Studienpopulation war wie folgt charakterisiert: medianes Alter 62 Jahre (Spanne: 26 bis 90 Jahre); 38 % waren 65 Jahre oder älter; 73 % waren männlich; 79 % waren kaukasischer und 16 % asiatischer Herkunft; 80 % hatten einen Karnofsky-Index (KPS) von 90 – 100 und 20 % hatten einen KPS von 70 – 80; die Patienten waren nach IMDC-Risikokategorien wie folgt verteilt: 31 % günstig, 56 % intermediär und 13 % ungünstig.
Die primären Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) (bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien). Sekundäre Wirksamkeitsendpunkte waren Objektive Ansprechrate (ORR) und Dauer des Ansprechens, bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien. Die Studie zeigte in ihrer präspezifizierten Interimsanalyse eine statistisch signifikante Verbesserung des Gesamtüberlebens (OS) (HR 0,53; 95‑%-KI: 0,38; 0,74; p‑Wert = 0,00005) und des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) (HR 0,69; 95-%-KI: 0,56; 0,84; p‑Wert = 0,00012) für die in den Pembrolizumab-Kombinationstherapie-Arm randomisierten Patienten im Vergleich zu Sunitinib. Tabelle 35 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte. In den Abbildungen 30 und 31 sind die Kaplan-Meier-Kurven für das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) basierend auf der finalen Analyse nach einer medianen Nachbeobachtungszeit von 37,7 Monaten dargestellt.
Tabelle 35: Wirksamkeitsergebnisse in KEYNOTE‑426
Endpunkt | Pembrolizumab | Sunitinib |
n = 432 | n = 429 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 193 (45 %) | 225 (52 %) |
Median in Monaten (95-%-KI) | 45,7 (43,6; N.v.) | 40,1 (34,3; 44,2) |
Hazard-Ratio* (95-%-KI) | 0,73 (0,60; 0,88) | |
p-Wert† | 0,00062 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)‡ | ||
Anzahl (%) Patienten mit Ereignis | 286 (66 %) | 301 (70 %) |
Median in Monaten (95-%-KI) | 15,7 (13,6; 20,2) | 11,1 (8,9; 12,5) |
Hazard-Ratio* (95-%-KI) | 0,68 (0,58; 0,80) | |
p-Wert† | < 0,00001 | |
Objektive Ansprechrate (ORR) | ||
ORR§ % (95-%-KI) | 60 (56; 65) | 40 (35; 44) |
Vollständiges Ansprechen | 10 % | 3 % |
Partielles Ansprechen | 50 % | 36 % |
p-Wert¶ | < 0,0001 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 23,6 (1,4+; 43,4+) | 15,3 (2,3; 42,8+) |
Anzahl (%#) Patienten mit einer Dauer ≥ 30 Monaten | 87 (45 %) | 29 (32 %) |
* Basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 30: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑426 (Intent-to-Treat-Population)
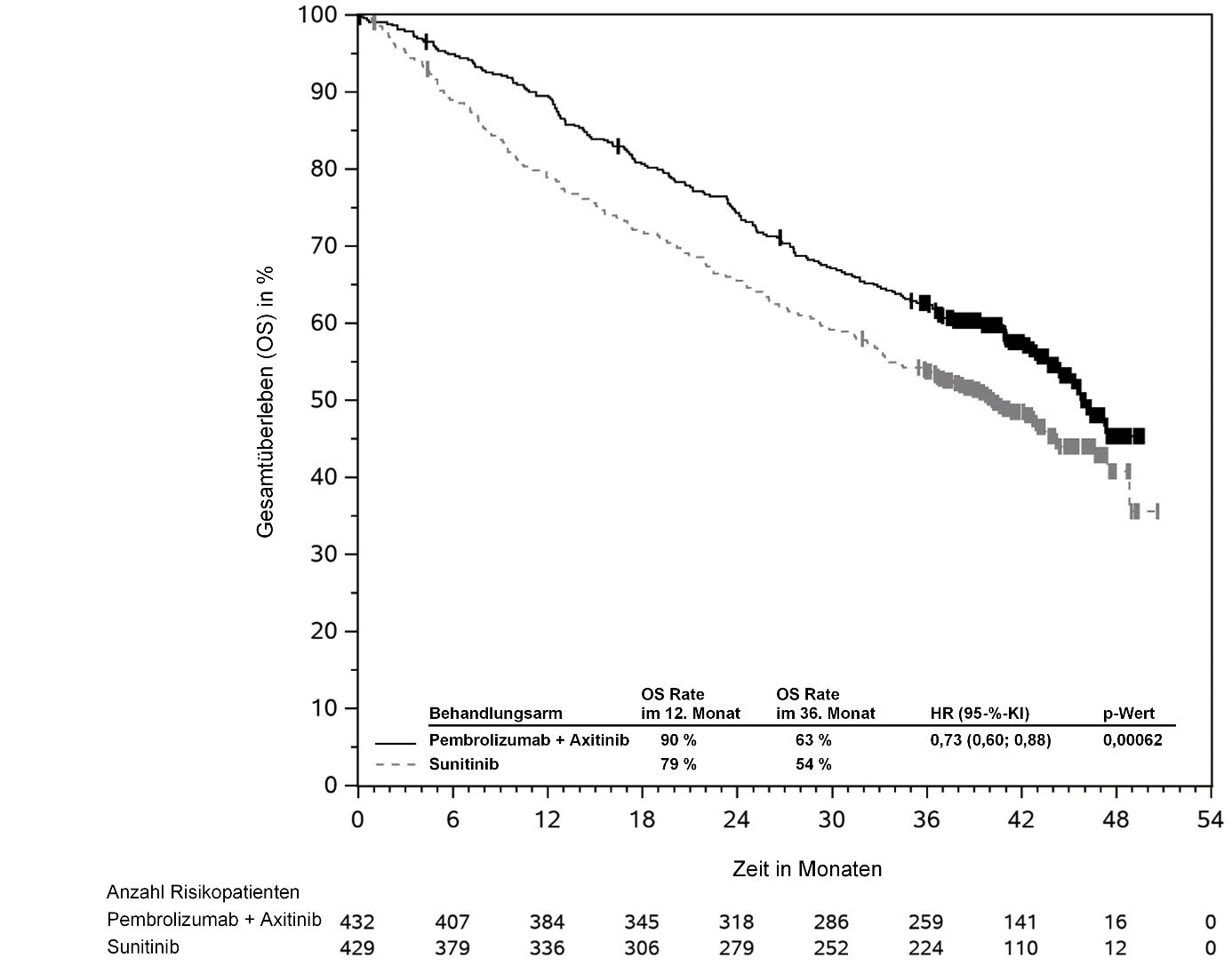
Abbildung 31: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑426 (Intent-to-Treat-Population)
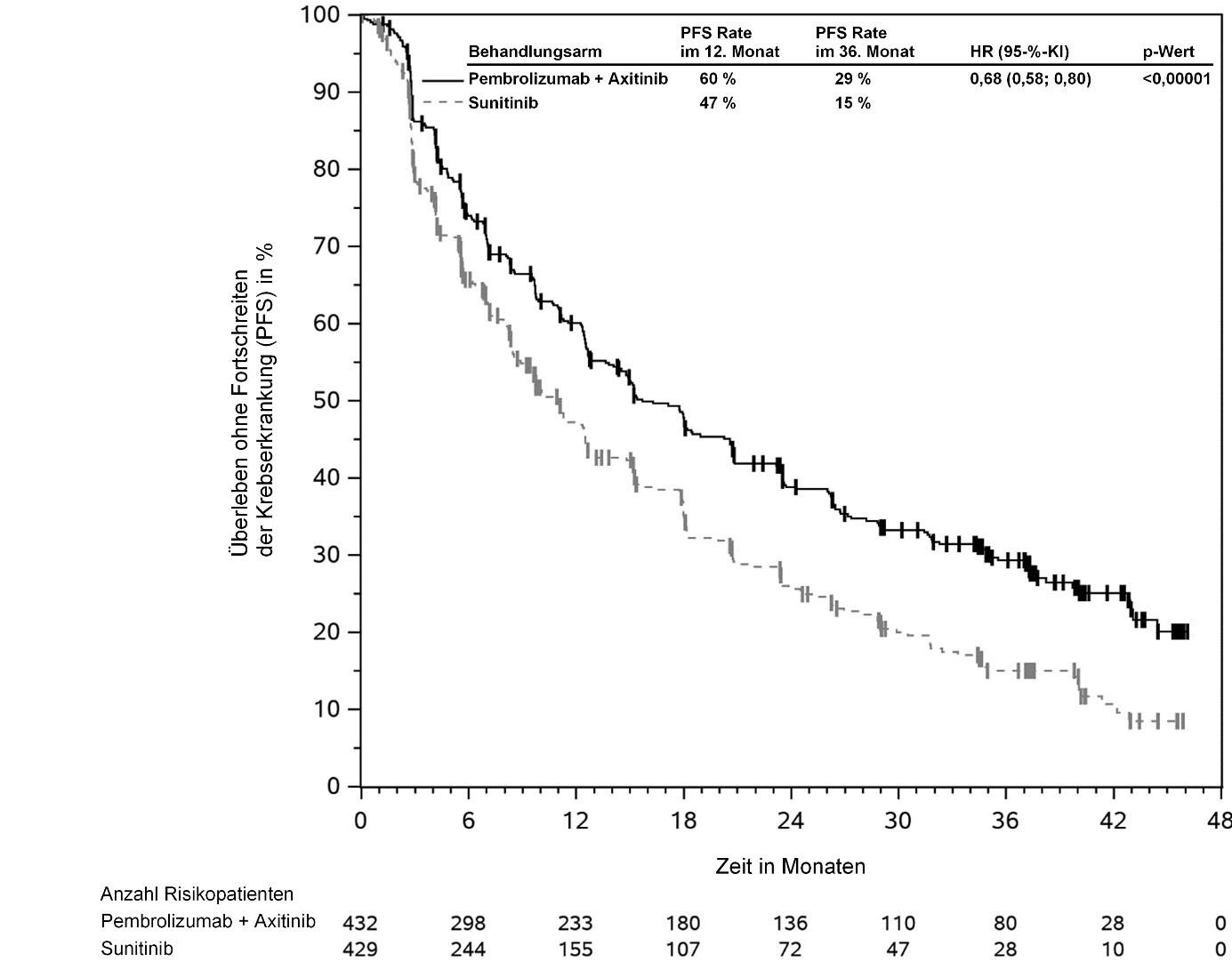
In KEYNOTE‑426 wurden Subgruppenanalysen der Patienten nach PD‑L1 CPS ≥ 1 [Pembrolizumab/Axitinib-Kombination: n = 243 (56 %) vs. Sunitinib: n = 254 (59 %)] und CPS < 1 [Pembrolizumab/Axitinib-Kombination: n = 167 (39 %) vs. Sunitinib: n = 158 (37 %)] durchgeführt. Vorteile hinsichtlich OS und PFS wurden ungeachtet des PD‑L1-Expressions-Status beobachtet.
KEYNOTE‑426 war nicht darauf ausgerichtet, die Wirksamkeit der individuellen Subgruppen zu bewerten.
Tabelle 36 enthält eine Zusammenfassung der Wirksamkeitsendpunkte nach IMDC-Risikokategorien basierend auf der finalen OS‑Analyse nach einer medianen Nachbeobachtungszeit von 37,7 Monaten.
Tabelle 36: Wirksamkeitsergebnisse in KEYNOTE‑426 nach IMDC-Risikokategorien
Endpunkt* | Pembrolizumab + Axitinib | Sunitinib | Pembrolizumab + Axitinib vs. Sunitinib |
Gesamtüberleben (OS) | OS‑Rate im 12. Monat % (95-%-KI) | OS HR (95-%-KI) | |
Günstig | 95,6 (90,5; 98,0) | 94,6 (89,0; 97,4) | 1,17 (0,76; 1,80) |
Intermediär | 90,7 (86,2; 93,8) | 77,6 (71,8; 82,3) | 0,67 (0,52; 0,86) |
Ungünstig | 69,6 (55,8; 79,9) | 45,1 (31,2; 58,0) | 0,51 (0,32; 0,81) |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | Median (95-%-KI) in Monaten | PFS HR (95-%-KI) | |
Günstig | 20,7 (15,2; 28,9) | 17,8 (12,5; 20,7) | 0,76 (0,56; 1,03) |
Intermediär | 15,3 (12,5; 20,8) | 9,7 (8,0; 12,4) | 0,69 (0,55; 0,86) |
Ungünstig | 4,9 (2,8; 12,4) | 2,9 (2,7; 4,2) | 0,53 (0,33; 0,84) |
Bestätigte Objektive Ansprechrate (ORR) | % (95-%-KI) | ORR-Differenz % (95-%-KI) | |
Günstig | 68,8 (60,4; 76,4) | 50,4 (41,5; 59,2) | 18,5 (6,7; 29,7) |
Intermediär | 60,5 (54,0; 66,8) | 39,8 (33,7; 46,3) | 20,7 (11,8; 29,2) |
Ungünstig | 39,3 (26,5; 53,2) | 11,5 (4,4; 23,4) | 27,7 (11,7; 42,8) |
* n (%) für die günstige, intermediäre bzw. ungünstige Risikokategorie für Pembrolizumab/Axitinib vs. Sunitinib betrugen 138 (32 %) vs. 131 (31 %), 238 (55 %) vs. 246 (57 %) bzw. 56 (13 %) vs. 52 (12 %) | |||
KEYNOTE-581 (CLEAR): Kontrollierte Studie einer Kombinationstherapie mit Lenvatinib bei nicht-vorbehandelten Patienten mit RCC
Die Wirksamkeit von Pembrolizumab in Kombination mit Lenvatinib wurde im Rahmen der Studie KEYNOTE‑581 (CLEAR), einer multizentrischen, offenen, randomisierten Studie mit 1 069 Patienten mit fortgeschrittenem RCC mit Klarzellkomponente einschließlich anderer Merkmale wie sarkomatöser und papillärer Histologie in der Erstlinienbehandlung untersucht. Die Patienten wurden ungeachtet des PD‑L1-Tumor-Expressions-Status eingeschlossen. Patienten mit einer aktiven Autoimmunerkrankung oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach geografischer Region (Nordamerika versus Westeuropa versus „Rest der Welt“) sowie den Prognosegruppen des „Memorial Sloan Kettering Cancer Center“ (MSKCC) (günstig versus intermediär versus ungünstig) stratifiziert.
Die Patienten wurden randomisiert (1:1:1) einem der folgenden Studienarme zugeteilt:
Pembrolizumab 200 mg intravenös alle 3 Wochen bis zu 24 Monate in Kombination mit Lenvatinib 20 mg zum Einnehmen einmal/Tag.
Lenvatinib 18 mg zum Einnehmen einmal/Tag in Kombination mit Everolimus 5 mg zum Einnehmen einmal/Tag.
Sunitinib 50 mg zum Einnehmen einmal/Tag für 4 Wochen, mit anschließender 2‑wöchiger Behandlungspause.
Die Behandlung wurde bis zum Auftreten unzumutbarer Toxizität oder bis zu einem vom Prüfarzt festgestellten und mittels BICR gemäß RECIST‑v1.1-Kriterien bestätigten Fortschreiten der Krebserkrankung fortgeführt. Die Behandlung mit Pembrolizumab und Lenvatinib konnte, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte, bei gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden. Die Behandlung mit Pembrolizumab wurde bis zu einem Maximum von 24 Monaten durchgeführt, die Behandlung mit Lenvatinib konnte jedoch über 24 Monate hinaus fortgesetzt werden. Die Bewertung des Tumorstatus erfolgte zu Studienbeginn und danach alle 8 Wochen.
In der Studienpopulation befanden sich 355 Patienten im Kombinations-Arm Pembrolizumab mit Lenvatinib und 357 Patienten im Sunitinib-Arm, die zu Studienbeginn wie folgt charakterisiert waren: medianes Alter 62 Jahre (Spanne: 29 bis 88 Jahre), 41 % waren 65 Jahre oder älter; 74 % waren Männer; 75 % waren kaukasischer, 21 % asiatischer, 1 % afrikanischer und 2 % anderer Herkunft; 17 % bzw. 83 % der Patienten hatten zu Studienbeginn einen KPS von 70 – 80 bzw. 90 – 100; die Patienten waren nach IMDC-Risikokategorien wie folgt verteilt: 33 % günstig, 56 % intermediär und 10 % ungünstig, nach MSKCC-Prognosegruppen folgendermaßen: 27 % günstig, 64 % intermediär und 9 % ungünstig. Bei 99 % der Patienten lagen Metastasen vor und bei 1 % der Patienten lag eine lokal fortgeschrittene Erkrankung vor. Metastasen bei Patienten fanden sich häufig in Lunge (69 %), Lymphknoten (46 %) und Knochen (26 %).
Der primäre Wirksamkeitsendpunkt war das Überleben ohne Fortschreiten der Krebserkrankung (PFS), bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien. Zu den wichtigsten sekundären Wirksamkeitsendpunkten zählten das Gesamtüberleben (OS) und die Objektive Ansprechrate (ORR). Die Studie zeigte bei Patienten, die zu Pembrolizumab in Kombination mit Lenvatinib randomisiert wurden, statistisch signifikante Verbesserungen von PFS (HR 0,39; 95-%-KI: 0,32; 0,49; p‑Wert < 0,0001), OS (HR 0,66; 95-%-KI: 0,49; 0,88; p‑Wert 0,0049) und ORR (71 %; [95-%-KI: 66; 76] vs. 36 %; [95-%-KI: 31; 41]; p‑Wert < 0,0001) im Vergleich zu Sunitinib zum Zeitpunkt der präspezifizierten Interimsanalyse mit einer medianen Nachbeobachtungszeit von 26,5 Monaten und einer medianen Behandlungsdauer von Pembrolizumab in Kombination mit Lenvatinib von 17,0 Monaten. Die primäre OS-Analyse wurde nicht hinsichtlich nachfolgender Therapien angepasst.
Tabelle 37 und die Abbildungen 32 und 33 enthalten eine Zusammenfassung der Wirksamkeitsergebnisse für KEYNOTE-581 (CLEAR) zum Zeitpunkt der im Protokoll spezifizierten finalen Analyse mit einer medianen Nachbeobachtungzeit von 49,4 Monaten. Die Ergebnisse für PFS waren in den präspezifizierten Subgruppen, den MSKCC-Prognosegruppen und nach PD-L1-Tumor-Expressions-Status konsistent. Die Wirksamkeitsergebnisse nach MSKCC-Prognosegruppe sind in Tabelle 38 zusammengefasst.
Tabelle 37: Wirksamkeitsergebnisse in KEYNOTE‑581 (CLEAR)
Endpunkt | Pembrolizumab | Sunitinib |
n = 355 | n = 357 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)* | ||
Anzahl (%) Patienten mit Ereignis | 207 (58 %) | 214 (60 %) |
Median in Monaten (95-%-KI) | 23,9 (20,8; 27,7) | 9,2 (6,0; 11,0) |
Hazard-Ratio† (95-%-KI) | 0,47 (0,38; 0,57) | |
p-Wert‡ | < 0,0001 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 149 (42 %) | 159 (45 %) |
Median in Monaten (95-%-KI) | 53,7 (48,7; N. e.) | 54,3 (40,9; N. e.) |
Hazard-Ratio† (95-%-KI) | 0,79 (0,63; 0,99) | |
p-Wert‡ | 0,0424 | |
Objektive Ansprechrate (ORR) | ||
ORR§ % (95-%-KI) | 71 % (66,6; 76,0) | 37 % (31,7; 41,7) |
Vollständiges Ansprechen | 18 % | 5 % |
Partielles Ansprechen | 53 % | 32 % |
p-Wert¶ | < 0,0001 | |
Dauer des Ansprechens# | ||
Median in Monaten (Spanne) | 26,7 (1,64+; 55,92+) | 14,7 (1,64+; 54,08+) |
* Die primäre Analyse des PFS umfasste die Zensur für eine neue Krebsbehandlung. Die Ergebnisse für PFS mit und ohne Zensur für eine neue Krebsbehandlung waren konsistent. | ||
Die finale OS-Analyse wurde nicht hinsichtlich nachfolgender Therapien angepasst, wobei 195/357 (54,6 %) Patienten im Sunitinib-Arm und 56/355 (15,8 %) Patienten im Pembrolizumab-plus-Lenvatinib-Arm eine nachfolgende Anti-PD-1/PD-L1-Therapie erhielten.
Abbildung 32: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑581 (CLEAR)
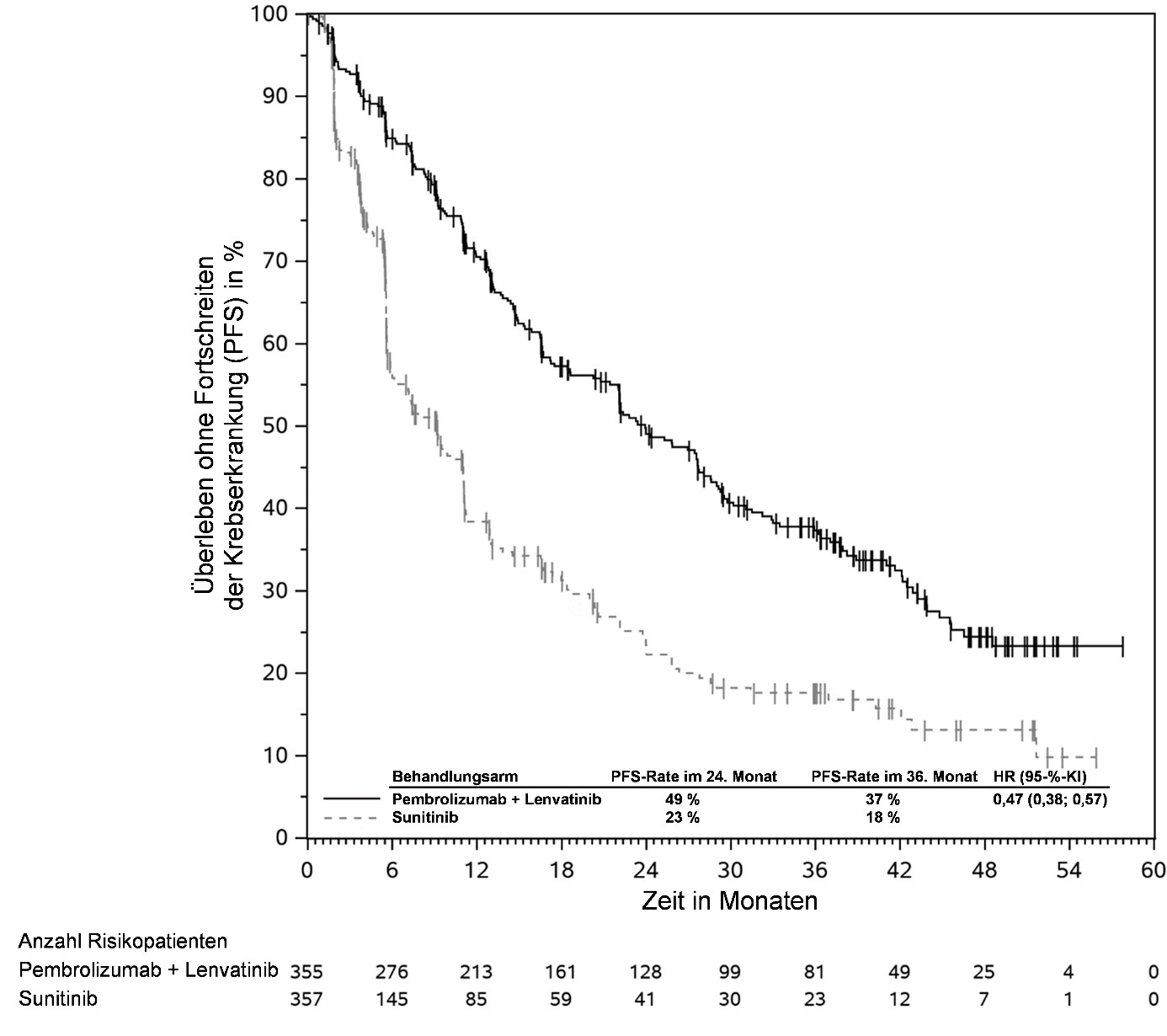
Abbildung 33: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑581 (CLEAR)
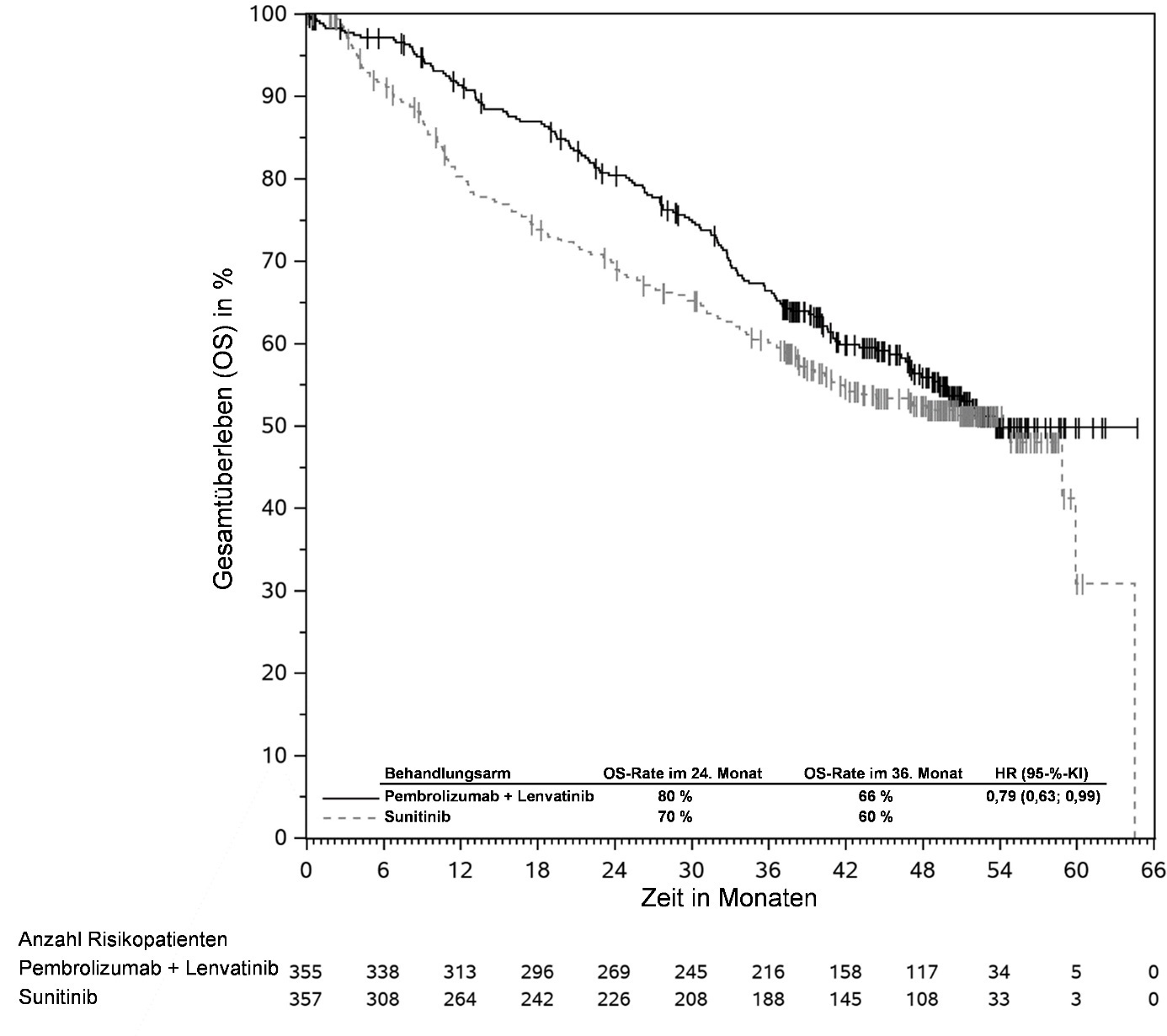
Die Studie KEYNOTE-581 (CLEAR) war nicht „gepowert“, um die Wirksamkeit bei den individuellen Subgruppen zu bewerten.
Subgruppenanalysen wurden nach MSKCC-Prognosegruppe durchgeführt.
Tabelle 38 fasst die Wirksamkeitsergebnisse nach MSKCC-Prognosegruppe basierend auf der finalen OS‑Analyse mit einer medianen Nachbeobachtungszeit von 49,4 Monaten zusammen.
Tabelle 38: Wirksamkeitsergebnisse in KEYNOTE‑581 (CLEAR) nach MSKCC-Prognosegruppe
| Pembrolizumab + Lenvatinib | Sunitinib | Pembrolizumab + Lenvatinib vs. Sunitinib | ||
| Anzahl Patienten | Anzahl Ereignisse | Anzahl Patienten | Anzahl Ereignisse | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) nach BICR* | PFS-HR (95-%-KI) | ||||
Günstig | 96 | 56 | 97 | 65 | 0,46 (0,32; 0,67) |
Intermediär | 227 | 129 | 228 | 130 | 0,51 (0,40; 0,65) |
Ungünstig | 32 | 22 | 32 | 19 | 0,18 (0,08; 0,42) |
Gesamtüberleben (OS)* | OS-HR (95-%-KI) | ||||
Günstig | 96 | 27 | 97 | 31 | 0,89 (0,53; 1,50) |
Intermediär | 227 | 104 | 228 | 108 | 0,81 (0,62; 1,06) |
Ungünstig | 32 | 18 | 32 | 20 | 0,59 (0,31; 1,12) |
* Mediane Nachbeobachtung: 49,4 Monate (Datenschnitt – 31. Juli 2022) | |||||
KEYNOTE-B61: Offene, einarmige Phase-II-Studie
Zusätzliche Daten sind aus der offenen, einarmigen Phase-II-Studie KEYNOTE-B61 mit Pembrolizumab (400 mg alle 6 Wochen) in Kombination mit Lenvatinib (20 mg einmal/Tag) zur Erstlinienbehandlung von Patienten mit fortgeschrittenem oder metastasierendem RCC mit nicht-klarzelliger Histologie (n = 158) verfügbar; darunter befanden sich 59 % mit papillären und 18 % mit chromophoben Merkmalen, 4 % wiesen Translokationen auf, 1 % hatten medulläre, 13 % nicht klassifizierte und 6 % andere histologische Merkmale. Die ORR betrug 50,6 % (95-%-KI: 42,6; 58,7) und die mediane Dauer des Ansprechens 19,5 Monate (95-%-KI: 15,3; nicht erreicht).
KEYNOTE-564: Placebokontrollierte Studie zur adjuvanten Behandlung bei Patienten mit reseziertem RCC
Die Wirksamkeit von Pembrolizumab zur adjuvanten Behandlung des RCC wurde im Rahmen der Studie KEYNOTE-564, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie mit 994 Patienten mit erhöhtem Rezidivrisiko, definiert als intermediär-hohes oder hohes Rezidivrisiko, oder mit M1-Status ohne Anzeichen einer Erkrankung (No Evidence of Disease, NED), untersucht. Die intermediär-hohe Risikokategorie umfasste: pT2 mit Grad 4 oder sarkomatoiden Merkmalen; pT3 jeglichen Grades ohne Lymphknotenbeteiligung (N0) oder Fernmetastasen (M0). Die Hochrisikokategorie umfasste: pT4 jeglichen Grades N0 und M0; jedes pT jeglichen Grades mit Lymphknotenbeteiligung (N1) und M0. Der M1‑NED-Status umfasste Patienten mit metastasierter Erkrankung, die sich einer vollständigen Resektion primärer und metastasierter Läsionen unterzogen hatten. Die Patienten mussten sich einer partiellen nephroprotektiven oder radikalen vollständigen Nephrektomie (sowie einer vollständigen Resektion solider, isolierter, metastasierender Weichteilläsionen bei M1‑NED-Patienten) mit negativen Resektionsrändern ≥ 4 Wochen vor dem Zeitpunkt des Screenings unterzogen haben. Patienten mit einer aktiven Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Patienten mit RCC mit einer Klarzell-Komponente erhielten randomisiert (1:1) entweder Pembrolizumab 200 mg alle 3 Wochen (n = 496) oder Placebo (n = 498) bis zu einem Zeitraum von einem Jahr oder bis zum Auftreten eines Rezidivs oder unzumutbarer Toxizität. Die Randomisierung wurde nach Status der Metastasierung (M0; M1‑NED) und innerhalb der M0-Gruppe weiter nach ECOG-Performance-Status (0;1) und geografischer Region (USA; Nicht-USA) stratifiziert. Ausgehend vom Zeitpunkt der Randomisierung wurden die Patienten in den ersten 2 Jahren alle 12 Wochen, im 3. bis 5. Jahr alle 16 Wochen und im Anschluss daran jährlich alle 24 Wochen einem bildgebenden Verfahren unterzogen.
Die 994 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 60 Jahre (Spanne: 25 bis 84 Jahre), 33 % waren 65 Jahre oder älter, 71 % waren Männer und 85 % bzw. 15 % hatten einen ECOG-Performance-Status von 0 bzw. 1. 94 % der Patienten hatten einen Status von N0; 83 % wiesen keine sarkomatoiden Tumormerkmale auf; 86 % fielen unter pT2 mit Grad 4 oder sarkomatoiden Tumormerkmalen oder unter pT3; 8 % fielen unter pT4 oder wiesen eine Lymphnotenbeteiligung auf und 6 % wiesen einen M1‑NED-Status auf. Die Ausgangscharakteristika und die demografischen Daten der Patienten im Pembrolizumab- und im Placebo-Arm waren im Allgemeinen vergleichbar.
Der primäre Wirksamkeitsendpunkt war das vom Prüfarzt beurteilte Krankheitsfreie Überleben (DFS). Der wichtigste sekundäre Endpunkt war das Gesamtüberleben (OS). Die Studie zeigte im Vergleich zu Placebo statistisch signifikante Verbesserungen des DFS und OS bei Patienten, die in den Pembrolizumab-Arm randomisiert wurden. Bei der präspezifizierten Interimsanalyse mit einer medianen Nachbeobachtungszeit von 23,9 Monaten lag die DFS‑HR bei 0,68 (95-%-KI: 0,53; 0,87; p‑Wert = 0,0010). Die Wirksamkeitsergebnisse mit einer medianen Nachbeobachtungszeit von 55,8 Monaten sind in Tabelle 39 und den Abbildungen 34 und 35 zusammengefasst.
Tabelle 39: Wirksamkeitsergebnisse in KEYNOTE‑564
Endpunkt | Pembrolizumab | Placebo |
n = 496 | n = 498 | |
Krankheitsfreies Überleben (DFS) | ||
Anzahl (%) Patienten mit Ereignis | 174 (35 %) | 224 (45 %) |
Median in Monaten (95-%-KI) | N. e. (N. e.; N. e.) | N. e. (54,9; N. e.) |
Hazard-Ratio* (95-%-KI) | 0,72 (0,59; 0,87) | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 55 (11 %) | 86 (17 %) |
Median in Monaten (95-%-KI) | N. e. (N. e.; N. e.) | N. e. (N. e.; N. e.) |
Hazard-Ratio* (95-%-KI) | 0,62 (0,44; 0,87) | |
p-Wert† | 0,0024 | |
* Basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 34: Kaplan-Meier-Kurve des Krankheitsfreien Überlebens (DFS) nach Behandlungsarm in KEYNOTE‑564 (Intent-to-Treat-Population)
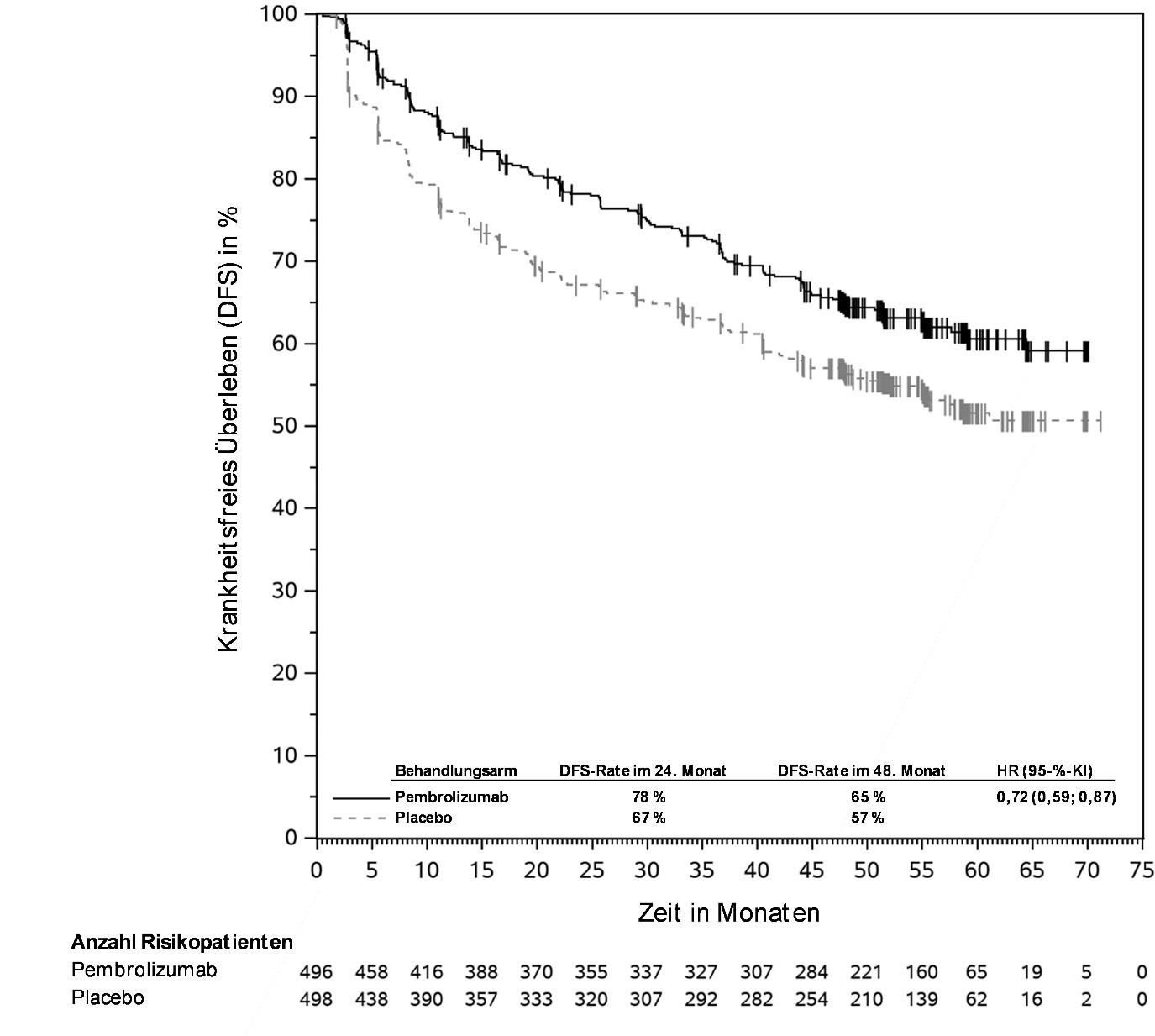
Abbildung 35: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑564 (Intent-to-Treat-Population)
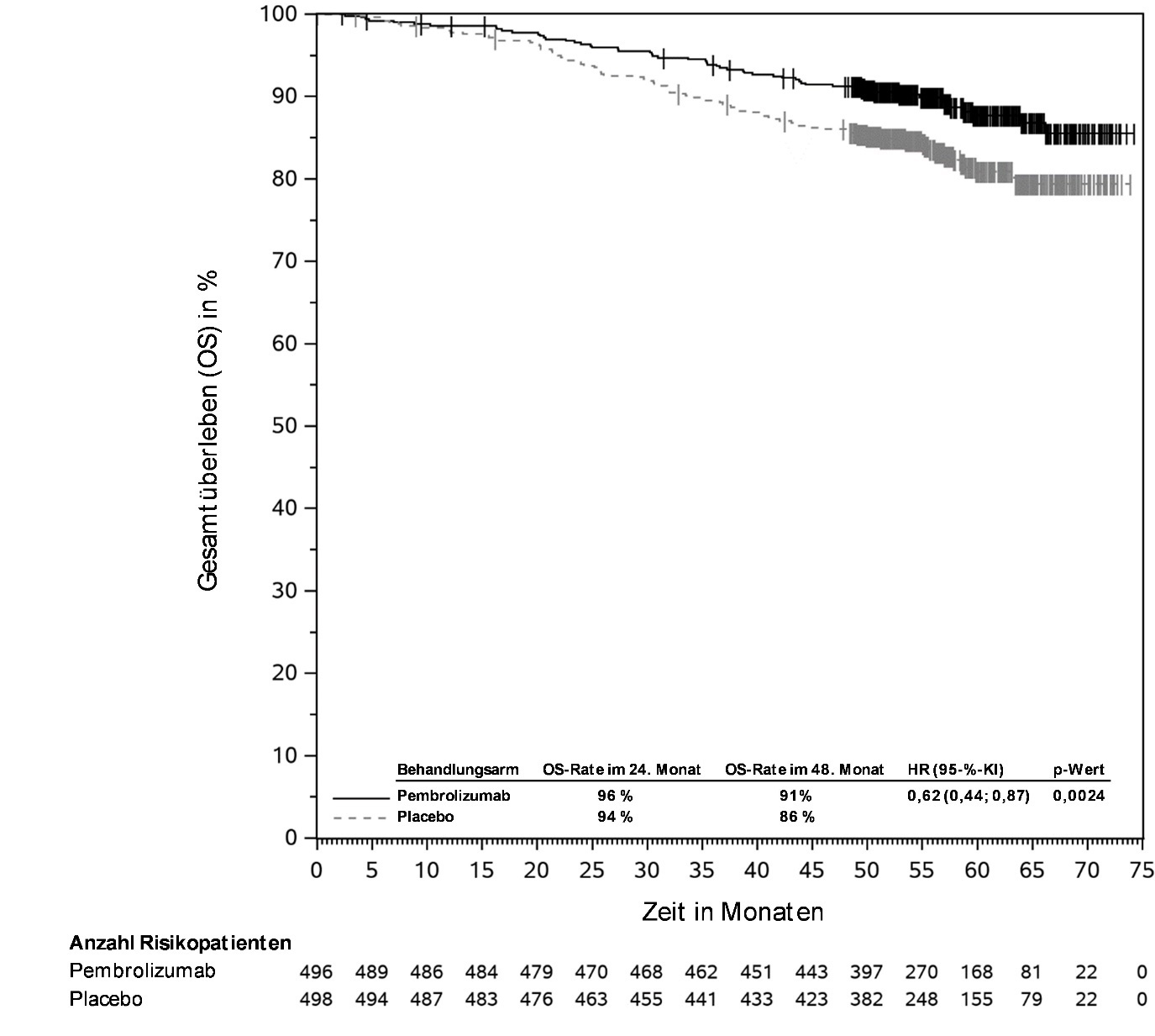
Tumoren mit hochfrequenter Mikrosatelliten-Instabilität (MSI‑H) oder mit einer Mismatch-Reparatur-Defizienz (dMMR)
Kolorektalkarzinom
KEYNOTE‑177: Kontrollierte Studie bei nicht-vorbehandelten Patienten mit metastasiertem MSI‑H‑ oder dMMR‑Kolorektalkarzinom (CRC)
Die Wirksamkeit von Pembrolizumab wurde im Rahmen der Studie KEYNOTE‑177, einer multizentrischen, randomisierten, offenen, aktiv-kontrollierten Studie untersucht, die Patienten mit bisher unbehandeltem metastasiertem MSI‑H- oder dMMR-CRC einschloss. Der MSI‑ oder MMR(mismatch repair)‑Tumorstatus wurde lokal mittels Polymerasekettenreaktion (PCR) oder IHC bestimmt. Patienten mit einer Autoimmunerkrankung oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen.
Die Patienten erhielten randomisiert (1:1) entweder Pembrolizumab 200 mg intravenös alle 3 Wochen oder eines der folgenden Chemotherapieregime nach Maßgabe des Prüfarztes intravenös alle 2 Wochen:
mFOLFOX6 (Oxaliplatin, Leucovorin und FU) oder mFOLFOX6 in Kombination mit entweder Bevacizumab oder Cetuximab: Oxaliplatin 85 mg/m2, Leucovorin 400 mg/m2 (oder Levoleucovorin 200 mg/m2) und FU 400 mg/m2 als Bolus an Tag 1, anschließend FU 2 400 mg/m2 über 46 – 48 Stunden. Bevacizumab 5 mg/kg KG an Tag 1 oder Cetuximab 400 mg/m2 als Erstinfusion, anschließend 250 mg/m2 wöchentlich.
FOLFIRI (Irinotecan, Leucovorin und FU) oder FOLFIRI in Kombination mit entweder Bevacizumab oder Cetuximab: Irinotecan 180 mg/m2; Leucovorin 400 mg/m2 (oder Levoleucovorin 200 mg/m2) und FU 400 mg/m2 als Bolus an Tag 1, anschließend FU 2 400 mg/m2 über 46 – 48 Stunden. Bevacizumab 5 mg/kg KG an Tag 1 oder Cetuximab 400 mg/m2 als Erstinfusion, anschließend 250 mg/m2 wöchentlich.
Die Behandlung mit Pembrolizumab wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten vom Prüfarzt bestätigten Fortschreiten der Krebserkrankung oder bis zum Auftreten unzumutbarer Toxizität fortgeführt. Patienten unter Pembrolizumab ohne Fortschreiten der Krebserkrankung konnten bis zu 24 Monaten behandelt werden. Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen. Patienten, die in einen Chemotherapiearm randomisiert wurden, konnten nach Fortschreiten der Krebserkrankung Pembrolizumab erhalten.
Insgesamt wurden 307 Patienten in die Studie eingeschlossen und erhielten randomisiert entweder Pembrolizumab (n = 153) oder Chemotherapie (n = 154). Zu Studienbeginn war die Patientenpopulation wie folgt charakterisiert: medianes Alter 63 Jahre (Spanne: 24 bis 93 Jahre); 47 % waren 65 Jahre oder älter; 50 % waren Männer; 75 % waren kaukasischer und 16 % waren asiatischer Herkunft; bei 52 % bzw. 48 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. Der Mutationsstatus stellte sich wie folgt dar: 25 % BRAF V600 E-Mutation-positiv, 24 % KRAS/NRAS-Mutation-positiv. Von den 143 Patienten unter Chemotherapie erhielten 56 % mFOLFOX6 mit oder ohne Bevacizumab oder Cetuximab und 44 % FOLFIRI mit oder ohne Bevacizumab oder Cetuximab.
Primäre Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Krebserkrankung (PFS), bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien, sowie das Gesamtüberleben (OS). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens. Die Studie zeigte in ihrer präspezifizierten finalen Analyse für PFS bei den in den Pembrolizumab-Arm randomisierten Patienten eine statistisch signifikante Verbesserung des PFS (HR 0,60; 95-%-KI: 0,45; 0,80; p‑Wert 0,0002) im Vergleich zu Chemotherapie. Es gab keinen statistisch signifikanten Unterschied zwischen Pembrolizumab und Chemotherapie in der finalen OS-Analyse, bei der 60 % der zu Chemotherapie randomisierten Patienten auf nachfolgende Anti-PD-1/PD-L1-Therapien einschließlich Pembrolizumab gewechselt hatten. Tabelle 40 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte und die Abbildungen 36 und 37 zeigen die Kaplan-Meier-Kurven für das aktualisierte PFS sowie das OS basierend auf der finalen Analyse mit einer medianen Nachbeobachtungszeit von 38,1 Monaten (Spanne: 0,2 bis 58,7 Monate).
Tabelle 40: Wirksamkeitsergebnisse in KEYNOTE‑177
Endpunkt | Pembrolizumab | Chemotherapie |
n = 153 | n = 154 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)* | ||
Anzahl (%) Patienten mit Ereignis | 86 (56 %) | 117 (76 %) |
Median in Monaten (95-%-KI) | 16,5 | 8,2 |
Hazard-Ratio† (95-%-KI) | 0,59 (0,45; 0,79) | |
p-Wert‡ | 0,0001 | |
Gesamtüberleben (OS)§ | ||
Anzahl (%) Patienten mit Ereignis | 62 (41 %) | 78 (51 %) |
Median in Monaten (95-%-KI) | N. e. | 36,7 |
Hazard-Ratio† (95-%-KI) | 0,74 (0,53; 1,03) | |
p-Wert§ | 0,0359 | |
Objektive Ansprechrate | ||
ORR % (95-%-KI) | 45 % (37,1; 53,3) | 33 % (25,8; 41,1) |
Vollständiges Ansprechen | 13 % | 4 % |
Partielles Ansprechen | 32 % | 29 % |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | N. e. | 10,6 |
% mit einer Dauer ≥ 24 Monaten¶ | 84 % | 34 % |
* Mit weiteren 12 Monaten Nachbeobachtungszeit nach der präspezifizierten finalen Analyse für PFS | ||
Abbildung 36: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑177 (Intent-to-Treat-Population)
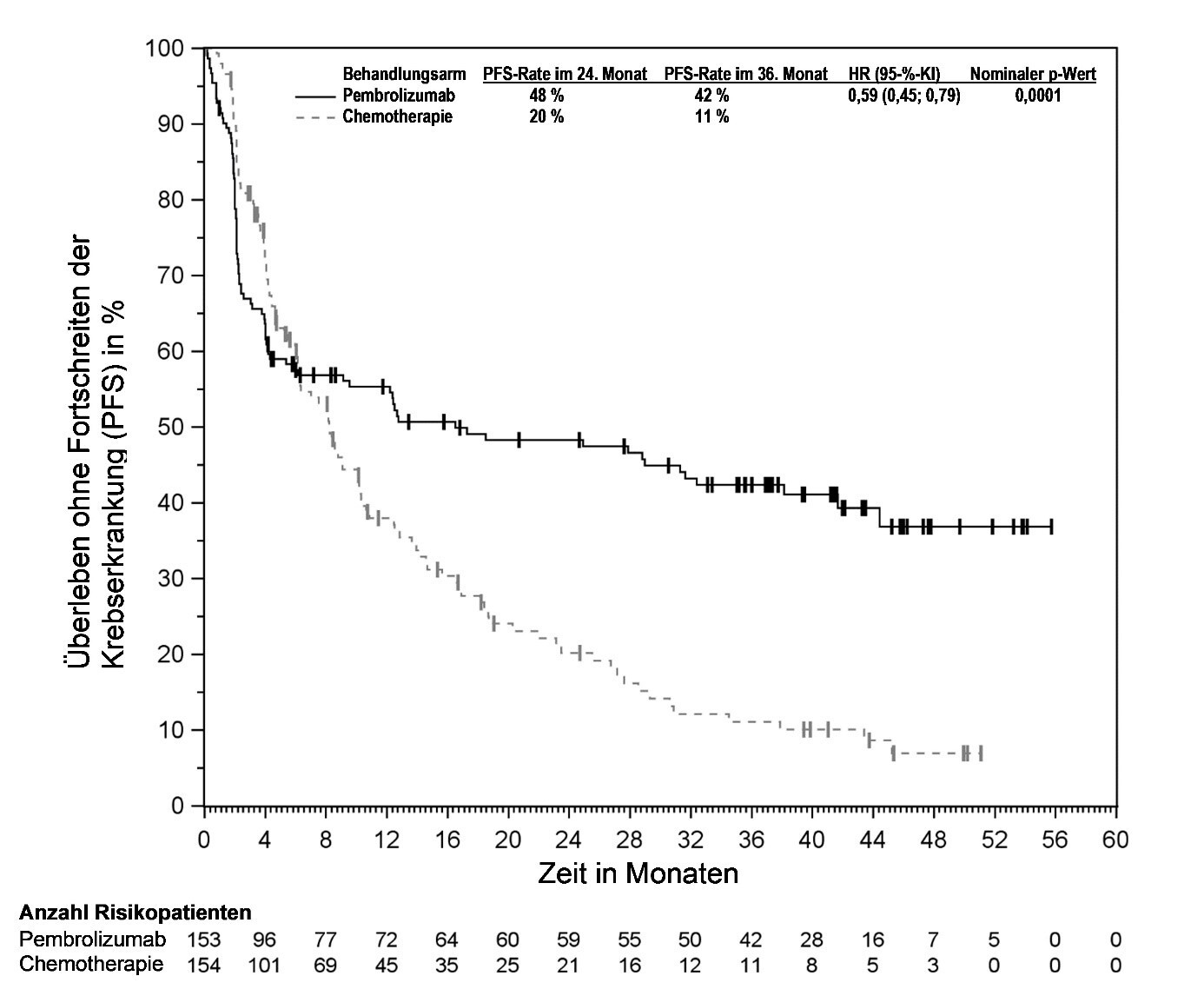
Abbildung 37: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑177 (Intent-to-Treat-Population)
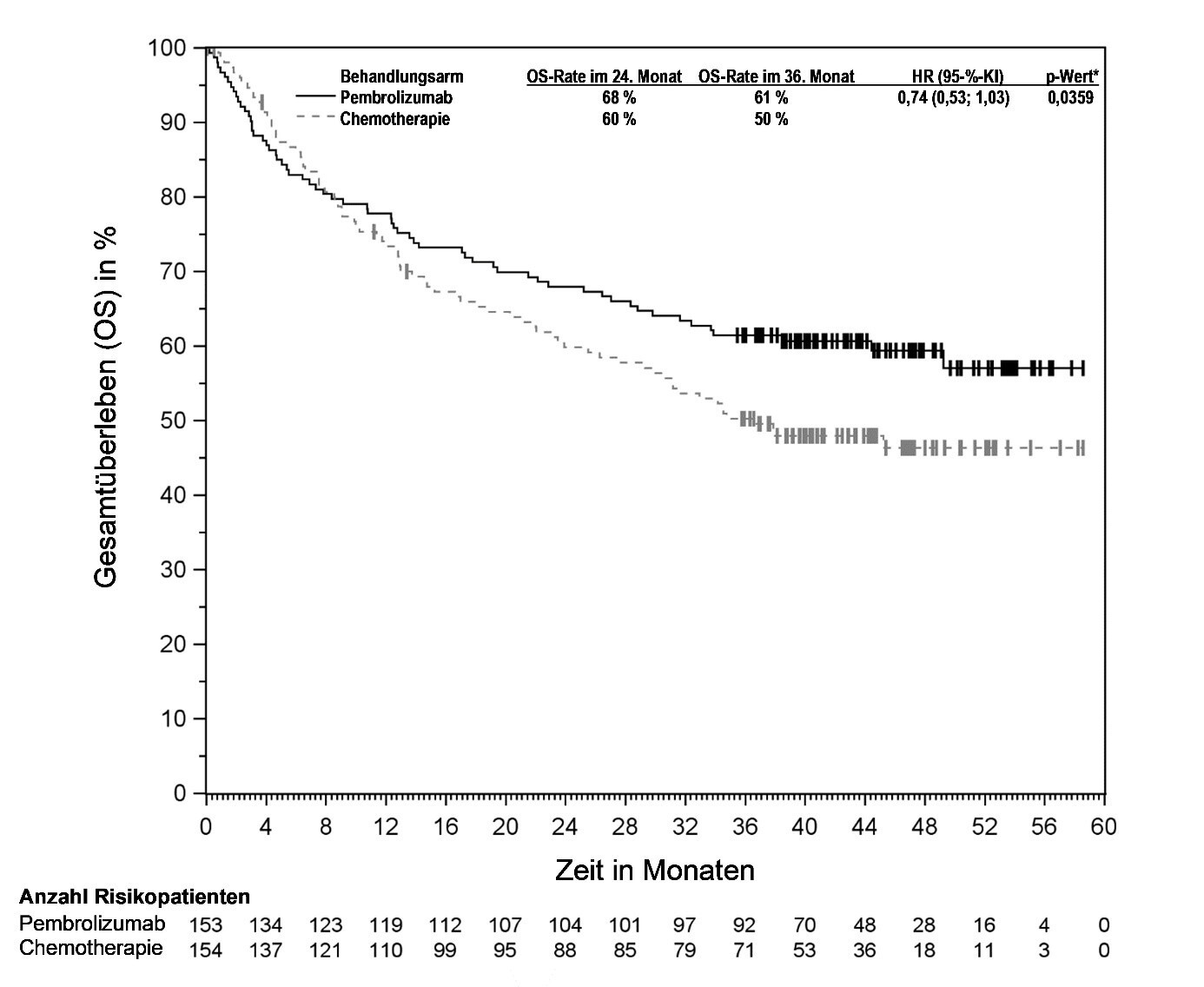
* Statistisch nicht signifikant nach Adjustierung für das multiple Testen
KEYNOTE-164: Offene Studie bei Patienten mit nicht resezierbarem oder metastasierendem MSI‑H- oder dMMR-CRC nach vorheriger Therapie
Die Wirksamkeit von Pembrolizumab wurde im Rahmen der Studie KEYNOTE‑164, einer multizentrischen, nicht-randomisierten, offenen Phase‑II-Studie mit mehreren Kohorten untersucht, die Patienten mit nicht resezierbarem oder metastasierendem MSI‑H- oder dMMR-CRC und Fortschreiten ihrer Krebserkrankung nach vorheriger Fluoropyrimidin-basierter Therapie in Kombination mit Irinotecan und/oder Oxaliplatin einschloss.
Die Patienten erhielten Pembrolizumab in einer Dosierung von 200 mg alle 3 Wochen bis zum Auftreten unzumutbarer Toxizität oder bis zum Fortschreiten der Krebserkrankung. Klinisch stabile Patienten mit initialen Anzeichen eines Fortschreitens der Krebserkrankung durften bis zur Bestätigung des Fortschreitens der Krebserkrankung weiterbehandelt werden. Patienten ohne Fortschreiten der Krebserkrankung wurden bis zu 24 Monate (bis zu 35 Zyklen) behandelt. Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen.
Die 124 Patienten in KEYNOTE‑164 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 56 Jahre (35 % waren 65 Jahre oder älter); 56 % waren Männer; 68 % waren kaukasischer, 27 % asiatischer Herkunft; bei 41 % bzw. 59 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. 12 % der Patienten hatten Tumoren mit BRAF-Mutation und 36 % mit RAS‑Mutation; 39 % bzw. 34 % waren bezüglich einer BRAF- bzw. RAS‑Mutation nicht bestimmt. Bei 97 % lagen Metastasen im M1‑Stadium vor und bei 3 % lagen keine Metastasen vor (M0; lokal fortgeschritten, nicht resezierbar). 76 % der Patienten hatten zwei oder mehr vorhergehende Therapielinien erhalten.
Der primäre Wirksamkeitsendpunkt war die Objektive Ansprechrate (ORR), die mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurde. Zu den sekundären Wirksamkeitsendpunkten gehörte die Dauer des Ansprechens, das Überleben ohne Fortschreiten der Krebserkrankung (PFS) und das Gesamtüberleben (OS). Die mediane Nachbeobachtungszeit betrug 37,3 Monate (Spanne: 0,1 bis 65,2 Monate). Tabelle 41 enthält eine Zusammenfassung der Wirksamkeitsergebnisse.
Tabelle 41: Wirksamkeitsergebnisse in KEYNOTE-164
Endpunkt | n = 124 |
Objektive Ansprechrate* | |
ORR % (95-%-KI) | 34 % (25,6; 42,9) |
Vollständiges Ansprechen | 10 % |
Partielles Ansprechen | 24 % |
Dauer des Ansprechens* | |
Median in Monaten (Spanne) | N. e. (4,4; 58,5+) |
% mit einer Dauer ≥ 36 Monaten# | 92 % |
* Basierend auf Patienten mit bestem objektiven Ansprechen als bestätigtes vollständiges oder partielles Ansprechen | |
Objektives Ansprechen wurde unabhängig vom BRAF- oder RAS‑Mutations-Status beobachtet.
Nicht-kolorektale Karzinome
KEYNOTE-158: Offene Studie bei Patienten mit nicht resezierbarem oder metastasierendem MSI‑H- oder dMMR-Endometrium-, -Magen-, -Dünndarm- oder biliärem Karzinom nach vorheriger Therapie
Die Wirksamkeit von Pembrolizumab wurde bei 355 Patienten mit nicht resezierbaren oder metastasierenden soliden MSI‑H- oder dMMR-Nicht‑CRC-Tumoren im Rahmen der Studie KEYNOTE‑158, einer multizentrischen, nicht-randomisierten, offenen Phase‑II-Studie untersucht, die Patienten mit Endometrium-, Magen-, Dünndarm- oder biliärem Karzinom einschloss. Der MSI‑ bzw. MMR‑Tumorstatus wurde prospektiv mittels PCR bzw. IHC bestimmt.
Die Patienten erhielten Pembrolizumab in einer Dosierung von 200 mg alle 3 Wochen bis zum Auftreten unzumutbarer Toxizität oder bis zum Fortschreiten der Krebserkrankung. Klinisch stabile Patienten mit initialen Anzeichen eines Fortschreitens der Krebserkrankung durften bis zur Bestätigung des Fortschreitens der Krebserkrankung weiterbehandelt werden. Patienten ohne Fortschreiten der Krebserkrankung wurden bis zu 24 Monate (bis zu 35 Zyklen) behandelt. Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen innerhalb des ersten Jahres, im Anschluss daran alle 12 Wochen.
Die 83 Patienten mit Endometriumkarzinom waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 64 Jahre (Spanne: 42 bis 86 Jahre); 46 % waren 65 Jahre oder älter; 84 % waren kaukasischer, 6 % asiatischer und 4 % afrikanischer Herkunft und der ECOG-Performance-Status betrug 0 (46 %) bzw. 1 (54 %). Bei 98 % der Patienten lagen Metastasen im M1‑Stadium vor und bei 2 % lagen keine Metastasen vor (M0). 47 % der Patienten hatten zwei oder mehr vorhergehende Therapielinien erhalten.
Die 51 Patienten mit Magenkarzinom waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 67 Jahre (Spanne: 41 bis 89 Jahre); 57 % waren 65 Jahre oder älter; 65 % waren Männer; 63 % waren kaukasischer, 28 % asiatischer Herkunft und der ECOG-Performance-Status betrug 0 (45 %) bzw. 1 (55 %). Bei allen Patienten lagen Metastasen im M1‑Stadium vor. 45 % der Patienten hatten zwei oder mehr vorhergehende Therapielinien erhalten.
Die 27 Patienten mit Dünndarmkarzinom waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 58 Jahre (Spanne: 21 bis 77 Jahre); 33 % waren 65 Jahre oder älter; 63 % waren Männer; 81 % waren kaukasischer, 11 % asiatischer Herkunft und der ECOG-Performance-Status betrug 0 (56 %) bzw. 1 (44 %). Bei 96 % der Patienten lagen Metastasen im M1‑Stadium vor und bei 4 % lagen keine Metastasen vor (M0). 37 % der Patienten hatten zwei oder mehr vorhergehende Therapielinien erhalten. Hinsichtlich der Tumor-Histologie lag bei allen Patienten ein Adenokarzinom vor.
Die 22 Patienten mit biliärem Karzinom waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 61 Jahre (Spanne: 40 bis 77 Jahre); 41 % waren 65 Jahre oder älter; 73 % waren Männer; 91 % waren kaukasischer, 9 % asiatischer Herkunft; der ECOG-Performance-Status betrug 0 (45 %) bzw. 1 (55 %). Bei 82 % lagen Metastasen im M1‑Stadium vor und bei 18 % lagen keine Metastasen vor (M0). 41 % der Patienten hatten zwei oder mehr vorhergehende Therapielinien erhalten.
Der primäre Wirksamkeitsendpunkt war die Objektive Ansprechrate (ORR), die mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurde. Zu den sekundären Wirksamkeitsendpunkten gehörte die Dauer des Ansprechens, das Überleben ohne Fortschreiten der Krebserkrankung (PFS) und das Gesamtüberleben (OS). Die mediane Nachbeobachtungszeit betrug für das Endometriumkarzinom 21,9 Monate (Spanne: 1,5 bis 64,0 Monate), für das Magenkarzinom 13,9 Monate (Spanne: 1,1 bis 66,9 Monate), für das Dünndarmkarzinom 29,1 Monate (Spanne: 4,2 bis 67,7 Monate) und für das biliäre Karzinom 19,4 Monate (Spanne: 1,1 bis 60,8 Monate). Tabelle 42 enthält eine Zusammenfassung der Wirksamkeitsergebnisse.
Tabelle 42: Wirksamkeitsergebnisse in KEYNOTE-158
Endpunkt | Endometrium | Magen | Dünndarm | Biliär |
Objektive Ansprechrate* | ||||
ORR % (95-%-KI) | 51 % | 37 % | 56 % | 41 % |
Vollständiges Ansprechen | 16 % | 14 % | 15 % | 14 % |
Partielles Ansprechen | 35 % | 24 % | 41 % | 27 % |
Dauer des Ansprechens* | ||||
Median in Monaten (Spanne) | N. e. | N. e. | N. e. | 30,6 |
% mit einer Dauer ≥ 12 Monaten# | 85 % | 90 % | 93 % | 89 % |
% mit einer Dauer ≥ 36 Monaten# | 60 % | 81 % | 73 % | 42 % |
* Basierend auf Patienten mit bestem objektiven Ansprechen als bestätigtes vollständiges oder partielles Ansprechen | ||||
Ösophaguskarzinom
KEYNOTE-590: Kontrollierte Studie einer Kombinationstherapie bei nicht-vorbehandelten Patienten mit Ösophaguskarzinom
Die Wirksamkeit von Pembrolizumab in Kombination mit Chemotherapie wurde in KEYNOTE‑590, einer multizentrischen, randomisierten, doppel-blinden, placebokontrollierten Studie bei Patienten mit lokal fortgeschrittenem nicht resezierbaren oder metastasierenden Ösophaguskarzinom oder Adenokarzinom des GEJ (Siewert-Typ-I) untersucht. Patienten mit einer aktiven Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, oder mit bekanntem HER2-positivem Adenokarzinom des gastroösophagealen Übergangs waren von der Studie ausgeschlossen. Die Randomisierung wurde stratifiziert nach Tumor-Histologie (Plattenepithelkarzinom vs. Adenokarzinom), geografischer Region (Asien vs. Nicht-Asien) sowie ECOG-Performance-Status (0 vs. 1).
Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt:
Pembrolizumab 200 mg an Tag 1 jedes 3-Wochen-Zyklus in Kombination mit Cisplatin 80 mg/m2 i.v. an Tag 1 jedes 3-Wochen-Zyklus für bis zu 6 Zyklen und 5-FU 800 mg/m2 i.v. pro Tag an den Tagen 1 bis 5 jedes 3-Wochen-Zyklus bzw. entsprechend des lokalen Standards der 5-FU-Gabe.
Placebo an Tag 1 jedes 3-Wochen-Zyklus in Kombination mit Cisplatin 80 mg/m2 i.v. an Tag 1 jedes 3-Wochen-Zyklus für bis zu 6 Zyklen und 5-FU 800 mg/m2 i.v. pro Tag an den Tagen 1 bis 5 jedes 3-Wochen-Zyklus bzw. entsprechend des lokalen Standards der 5-FU-Gabe.
Die Behandlung mit Pembrolizumab oder Chemotherapie wurde bis zum Auftreten unzumutbarer Toxizität oder einem Fortschreiten der Krebserkrankung oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Gabe von Pembrolizumab konnte bei klinisch stabilen Patienten bei erstem, gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden bis zur Bestätigung des ersten radiographischen Nachweises des Fortschreitens der Krebserkrankung mit einem frühestens nach 4 Wochen wiederholten bildgebenden Verfahren. Eine Bewertung des Tumorstatus erfolgte alle 9 Wochen.
Unter den 749 Patienten in KEYNOTE‑590 befanden sich 383 (51 %) Patienten mit mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmter PD-L1-Tumorexpression von CPS ≥ 10. Diese 383 Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 63 Jahre (Spanne: 28 bis 89 Jahre); 41 % waren 65 Jahre oder älter, 82 % waren Männer; 34 % waren kaukasischer Herkunft und 56 % waren asiatischer Herkunft; bei 43 % bzw. 57 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor. Bei 93 % lagen Metastasen im M1-Stadium vor. Hinsichtlich der Tumor-Histologie lag bei 75 % der Patienten ein Plattenepithelkarzinom und bei 25 % ein Adenokarzinom vor.
Die primären Wirksamkeitsendpunkte Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS) wurden bei den Populationen mit Plattenepithelhistologie, CPS ≥ 10 sowie bei allen Patienten ausgewertet, wobei die Bewertung des PFS gemäß RECIST‑v1.1-Kriterien durch den Prüfarzt erfolgte. Die Studie zeigte eine statistisch signifikante Verbesserung des OS und des PFS bei allen präspezifizierten Studienpopulationen. Bei allen Patienten, die zu Pembrolizumab in Kombination mit Chemotherapie randomisiert waren, zeigte sich im Vergleich zu Chemotherapie für OS eine HR von 0,73 (95-%-KI: 0,62 – 0,86) und für PFS eine HR von 0,65 (95-%-KI: 0,55 – 0,76). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens gemäß RECIST‑v1.1-Kriterien nach Bewertung durch den Prüfarzt. Tabelle 43 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte der präspezifizierten Analyse in KEYNOTE-590 bei Patienten mit PD‑L1-Tumorexpression (CPS ≥ 10) bei einer medianen Nachbeobachtungszeit von 13,5 Monaten (Spanne: 0,5 bis 32,7 Monate). Die Abbildungen 38 und 39 zeigen die Kaplan-Meier-Kurven für OS und PFS.
Tabelle 43: Wirksamkeitsergebnisse für Pembrolizumab in Kombination mit Chemotherapie bei PD-L1-Expression (CPS ≥ 10) in KEYNOTE‑590
Endpunkt | Pembrolizumab | Standardtherapie* |
n = 186 | n = 197 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 124 (66,7 %) | 165 (83,8 %) |
Median in Monaten† (95-%-KI) | 13,5 (11,1; 15,6) | 9,4 (8,0; 10,7) |
Hazard-Ratio‡ (95-%-KI) | 0,62 (0,49; 0,78) | |
p-Wert§ | < 0,0001 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)¶ | ||
Anzahl (%) Patienten mit Ereignis | 140 (75,3 %) | 174 (88,3 %) |
Median in Monaten† (95-%-KI) | 7,5 (6,2; 8,2) | 5,5 (4,3; 6,0) |
Hazard-Ratio‡ (95-%-KI) | 0,51 (0,41; 0,65) | |
p-Wert§ | < 0,0001 | |
Objektive Ansprechrate (ORR)¶ | ||
ORR§ % (95-%-KI) | 51,1 (43,7; 58,5) | 26,9 (20,8; 33,7) |
Vollständiges Ansprechen | 5,9 % | 2,5 % |
Partielles Ansprechen | 45,2 % | 24,4 % |
p-Wert# | < 0,0001 | |
Dauer des Ansprechens¶, Þ | ||
Median in Monaten (Spanne) | 10,4 (1,9; 28,9+) | 5,6 (1,5+; 25,0+) |
% mit einer Dauer ≥ 6 Monaten† | 80,2 % | 47,7 % |
% mit einer Dauer ≥ 12 Monaten† | 43,7 % | 23,2 % |
% mit einer Dauer ≥ 18 Monaten† | 33,4 % | 10,4 % |
* Cisplatin und 5-FU | ||
Insgesamt wurden 32 Patienten ≥ 75 Jahre mit PD-L1-Expression (CPS ≥ 10) in KEYNOTE-590 (18 im Pembrolizumab-Kombinationsarm und 14 im Kontrollarm) aufgenommen. Die Daten hinsichtlich Wirksamkeit einer Kombination von Pembrolizumab mit Chemotherapie sind für diese Population zu eingeschränkt.
Abbildung 38: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm mit einer PD-L1-Expression (CPS ≥ 10) in KEYNOTE‑590
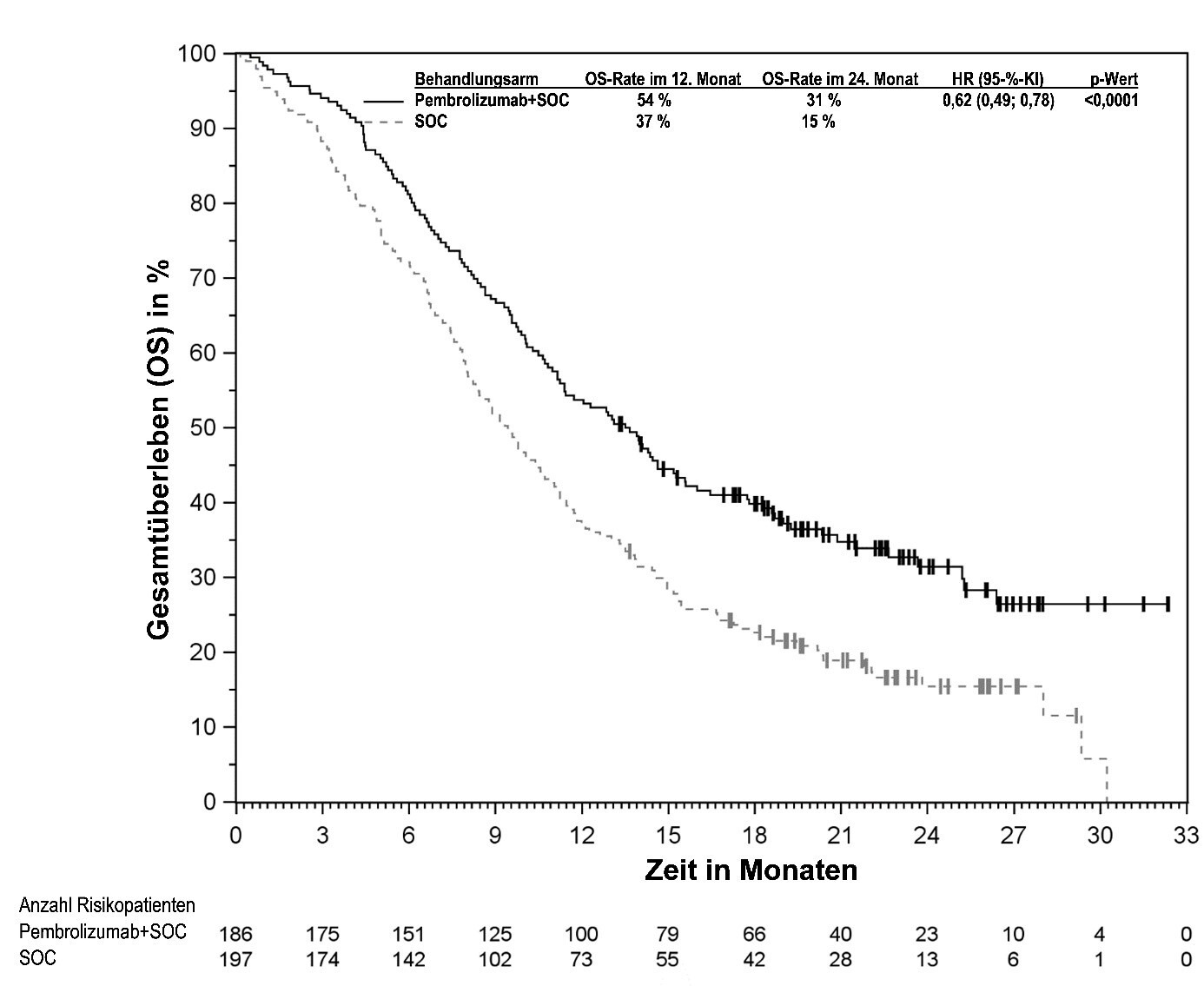
Abbildung 39: Kaplan‑Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm mit einer PD-L1-Expression (CPS ≥ 10) in KEYNOTE‑590
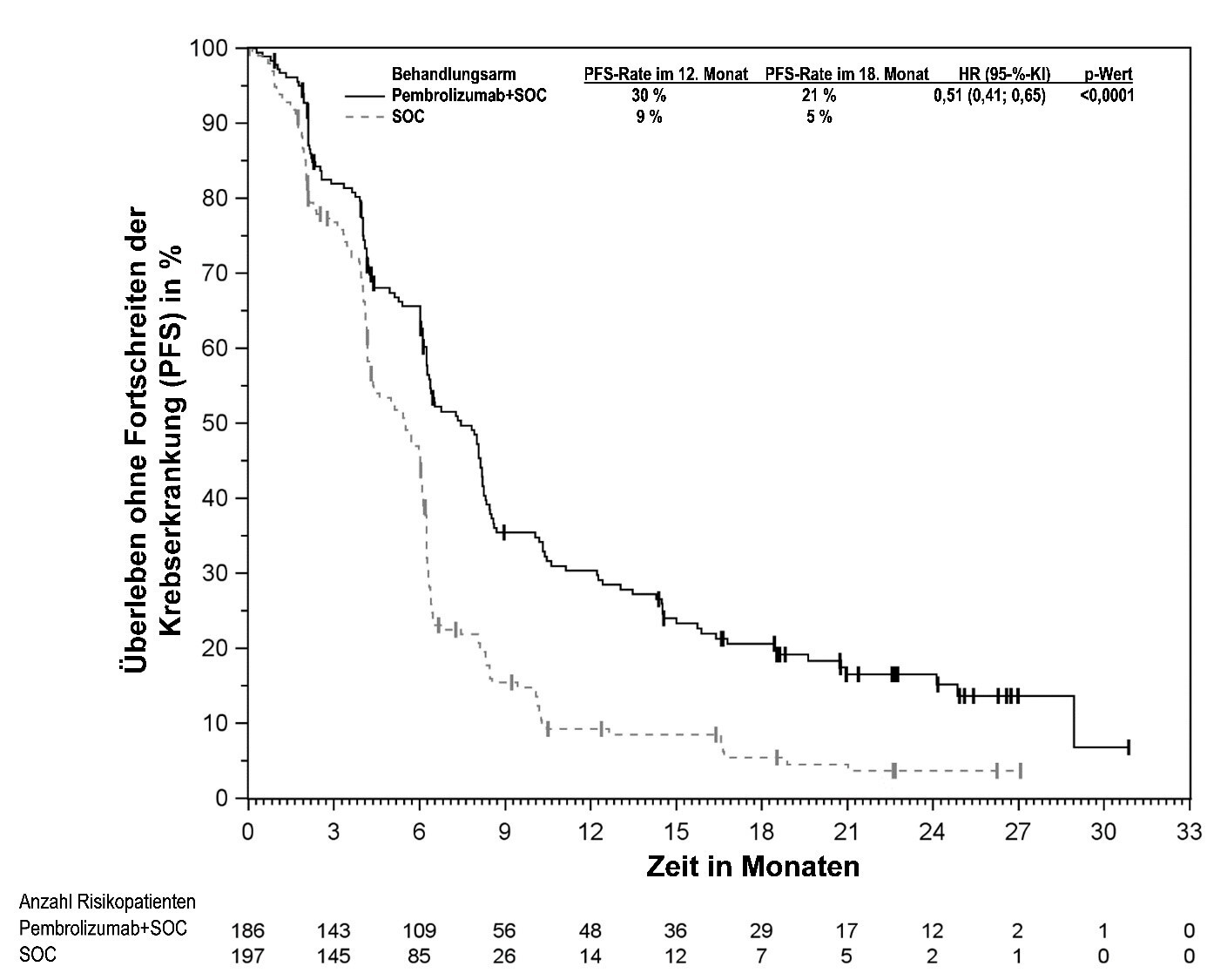
Triple-negatives Mammakarzinom
KEYNOTE-522: Kontrollierte Studie zur neoadjuvanten und adjuvanten Therapie bei Patienten mit lokal fortgeschrittenem, inflammatorischem oder frühem triple-negativem Mammakarzinom mit hohem Rezidivrisiko
Die Wirksamkeit von Pembrolizumab in Kombination mit Chemotherapie zur neoadjuvanten und anschließend nach Operation als Monotherapie zur adjuvanten Behandlung wurde im Rahmen der randomisierten, doppelblinden, multizentrischen, placebokontrollierten Studie KEYNOTE-522 untersucht. Falls indiziert, erhielten die Patienten eine adjuvante Strahlentherapie vor oder gleichzeitig mit der adjuvanten Behandlung mit Pembrolizumab oder Placebo. Die wichtigsten Einschlusskriterien der Studie waren lokal fortgeschrittenes, inflammatorisches oder frühes TNBC mit hohem Rezidivrisiko (Tumorgröße > 1 cm, aber ≤ 2 cm im Durchmesser mit Lymphknotenbeteiligung oder Tumorgröße > 2 cm im Durchmesser unabhängig von der Lymphknotenbeteiligung), ungeachtet der PD-L1-Tumorexpression. Patienten mit einer aktiven Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde stratifiziert nach Lymphknotenstatus (positiv vs. negativ), Tumorgröße (T1/T2 vs. T3/T4) und Wahl von Carboplatin (Gabe alle 3 Wochen vs. wöchentlich). Die Patienten erhielten randomisiert (2:1) entweder Pembrolizumab oder Placebo als intravenöse Infusion:
Vier Zyklen neoadjuvante Therapie mit Pembrolizumab 200 mg alle 3 Wochen oder Placebo an Tag 1 der Zyklen 1 – 4 des Behandlungsregimes in Kombination mit:
Carboplatin
AUC 5 mg/ml/min alle 3 Wochen an Tag 1 der Zyklen 1 – 4 des Behandlungsregimes
oder AUC 1,5 mg/ml/min wöchentlich an den Tagen 1, 8 und 15 der Zyklen 1 – 4 des Behandlungsregimes und
Paclitaxel 80 mg/m2 wöchentlich an den Tagen 1, 8 und 15 der Zyklen 1 – 4 des Behandlungsregimes
Gefolgt von vier weiteren Zyklen neoadjuvante Therapie mit Pembrolizumab 200 mg alle 3 Wochen oder Placebo an Tag 1 der Zyklen 5 – 8 des Behandlungsregimes in Kombination mit:
Doxorubicin 60 mg/m2 oder Epirubicin 90 mg/m2 alle 3 Wochen an Tag 1 der Zyklen 5‑8 des Behandlungsregimes und
Cyclophosphamid 600 mg/m2 alle 3 Wochen an Tag 1 der Zyklen 5 – 8 des Behandlungsregimes
Im Anschluss an die Operation wurden 9 Zyklen adjuvante Therapie mit Pembrolizumab 200 mg alle 3 Wochen oder Placebo verabreicht.
Die Behandlung mit Pembrolizumab oder Placebo wurde bis zum Abschluss der Behandlung (17 Zyklen), bis zum Fortschreiten der Krebserkrankung, das eine kurative Operation ausschließt, bis zum Auftreten eines Rezidivs in der adjuvanten Phase oder bis zum Auftreten unzumutbarer Toxizität fortgeführt.
Insgesamt wurden 1 174 Patienten randomisiert. Die Studienpopulation war wie folgt charakterisiert: medianes Alter 49 Jahre (Spanne: 22 bis 80 Jahre); 11 % waren 65 Jahre oder älter; 99,9 % waren weiblich; 64 % waren kaukasischer, 20 % asiatischer, 5 % afrikanischer und 2 % indigener (amerikanischer oder alaskischer) Herkunft; bei 87 % bzw. 13 % der Patienten lag ein ECOG-Performance-Status von 0 bzw. 1 vor; 56 % der Patienten waren prämenopausal und 44 % postmenopausal; 7 % hatten einen Primärtumorstatus von 1 (T1), 68 % von T2, 19 % fielen unter T3 und 7 % unter T4; 49 % wiesen keine Lymphknotenbeteiligung auf (N0), 40 % wiesen einen Lymphknotenstatus von N1, 11 % von N2 und 0,2 % von N3 auf; bei 1,4 % der Patienten lag ein inflammatorisches Mammakarzinom vor; 75 % der Patienten befanden sich im Gesamtstadium II und 25 % im Stadium III.
Die beiden primären Wirksamkeitsendpunkte waren die pCR‑Rate und das EFS. Die pathologische Komplettremission war definiert als das Fehlen eines invasiven Karzinoms in Brust und Lymphknoten (ypT0/Tis ypN0) und wurde von einem verblindeten lokalen Pathologen zum Zeitpunkt der kurativen Operation beurteilt. EFS war definiert als der Zeitraum von Randomisierung bis zum ersten Auftreten eines der folgenden Ereignisse: Krankheitsprogression, die eine kurative Operation ausschließt, Lokal- oder Fernrezidiv, zweiter Primärtumor oder Tod jeglicher Ursache. Ein sekundärer Wirksamkeitsendpunkt war das OS.
Die Studie zeigte in der präspezifizierten Primäranalyse eine statistisch signifikante Verbesserung der Differenz der pCR‑Raten (n = 602), die pCR‑Raten betrugen 64,8 % (95-%-KI: 59,9 %; 69,5 %) im Pembrolizumab-Arm und 51,2 % (95-%-KI: 44,1 %; 58,3 %) im Placebo-Arm, mit einer Behandlungsdifferenz von 13,6 % (95-%-KI: 5,4 %; 21,8 %; p‑Wert 0,00055). Die Studie zeigte in der präspezifizierten Interimsanalyse ebenfalls eine statistisch signifikante Verbesserung des EFS (mediane Nachbeobachtungszeit für alle Patienten von 37,8 Monaten [Spanne: 2,7 bis 48,0 Monate], HR = 0,63 [95-%-KI: 0,48; 0,82; p-Wert 0,00031]). Bei einer medianen Nachbeobachtungszeit für alle Patienten von 73,1 Monaten (Spanne: 2,7 bis 83,9 Monate) zeigte die Studie auch eine statistisch signifikante Verbesserung des OS.
Die Ergebnisse der präspezifizierten finalen pCR-Analyse (n = 1002) und die entscheidenden Wirksamkeitsendpunkte aus der präspezifizierten Interimsanalyse zu EFS und OS bei einer medianen Nachbeobachtungszeit für alle Patienten von 73,1 Monaten (Spanne: 2,7 bis 83,9 Monate) sind in Tabelle 44 zusammengefasst. Die Kaplan-Meier-Kurven für EFS und OS sind in den Abbildungen 40 und 41 dargestellt.
Tabelle 44: Wirksamkeitsergebnisse in KEYNOTE-522
Endpunkt | Pembrolizumab mit | Placebo mit |
Pathologische Komplettremission (pCR) (ypT0/Tis ypN0)* | n = 669 | n = 333 |
Anzahl Patienten mit pCR | 428 | 182 |
pCR‑Rate (%) (95‑%‑KI) | 64,0 (60,2; 67,6) | 54,7 (49,1; 60,1) |
Behandlungsdifferenz (%) Schätzung (95‑%‑KI)† | 9,2 (2,8; 15,6) | |
p-Wert‡ | 0,00221 | |
Ereignisfreies Überleben (EFS) | n = 784 | n = 390 |
Anzahl (%) Patienten mit Ereignis | 123 (15,7 %) | 93 (23,8 %) |
Hazard-Ratio (95‑%‑KI)¶ | 0,65 (0,51; 0,83) | |
Gesamtüberleben (OS)Þ | n = 784 | n = 390 |
Anzahl (%) Patienten mit Ereignis | 115 (14,7 %) | 85 (21,8 %) |
Hazard-Ratio (95‑%‑KI)¶ | 0,66 (0,50; 0,87) | |
p‑Wert# | 0,00150 | |
* Basierend auf einer präspezifizierten finalen Analyse für pCR (im Vergleich zu einem Signifikanzniveau von 0,0028) | ||
Abbildung 40: Kaplan-Meier-Kurve des Ereignisfreien Überlebens (EFS) nach Behandlungsarm in KEYNOTE‑522 (Intent-to-Treat-Population)
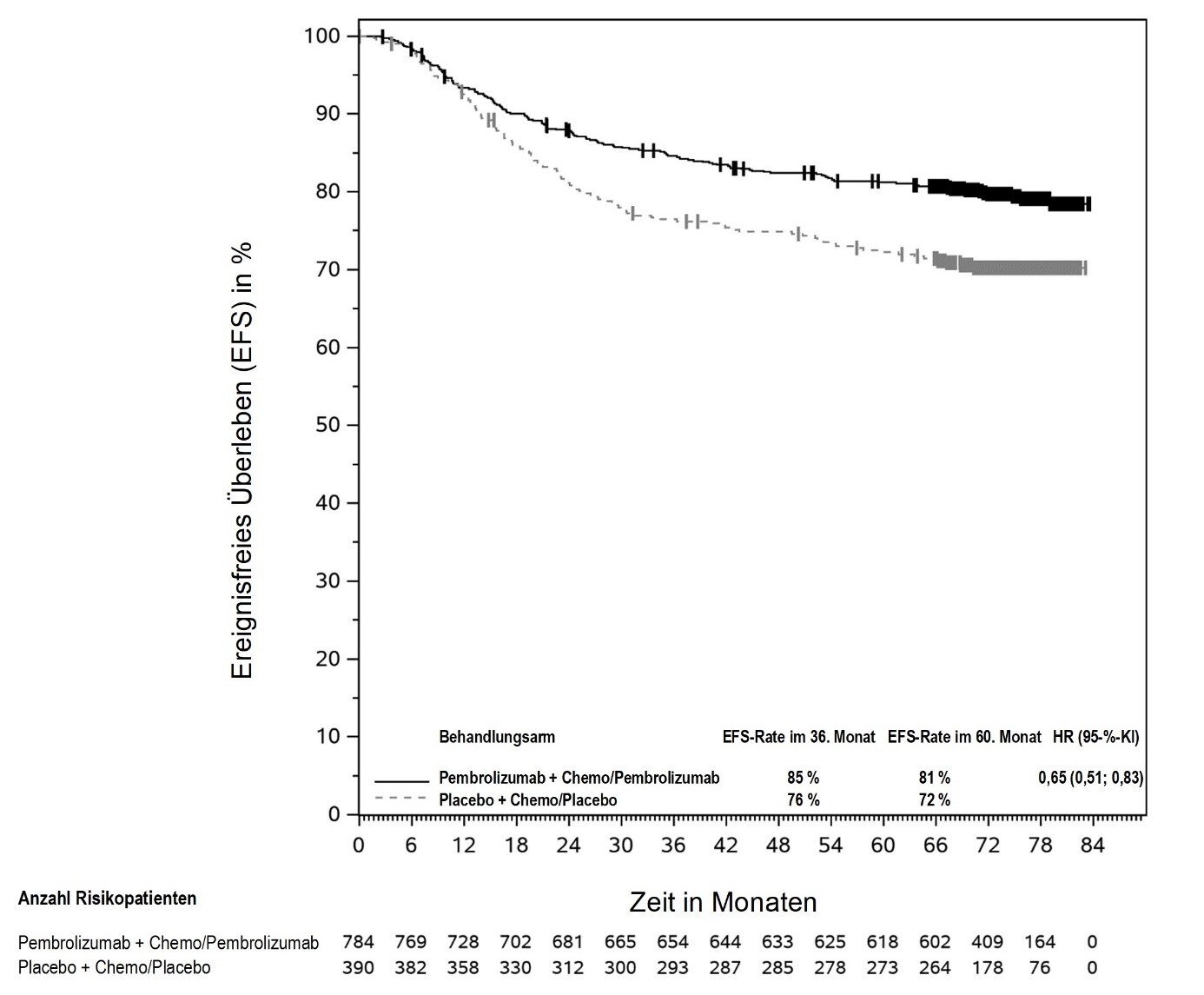
Abbildung 41: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑522 (Intent-to-Treat-Population)
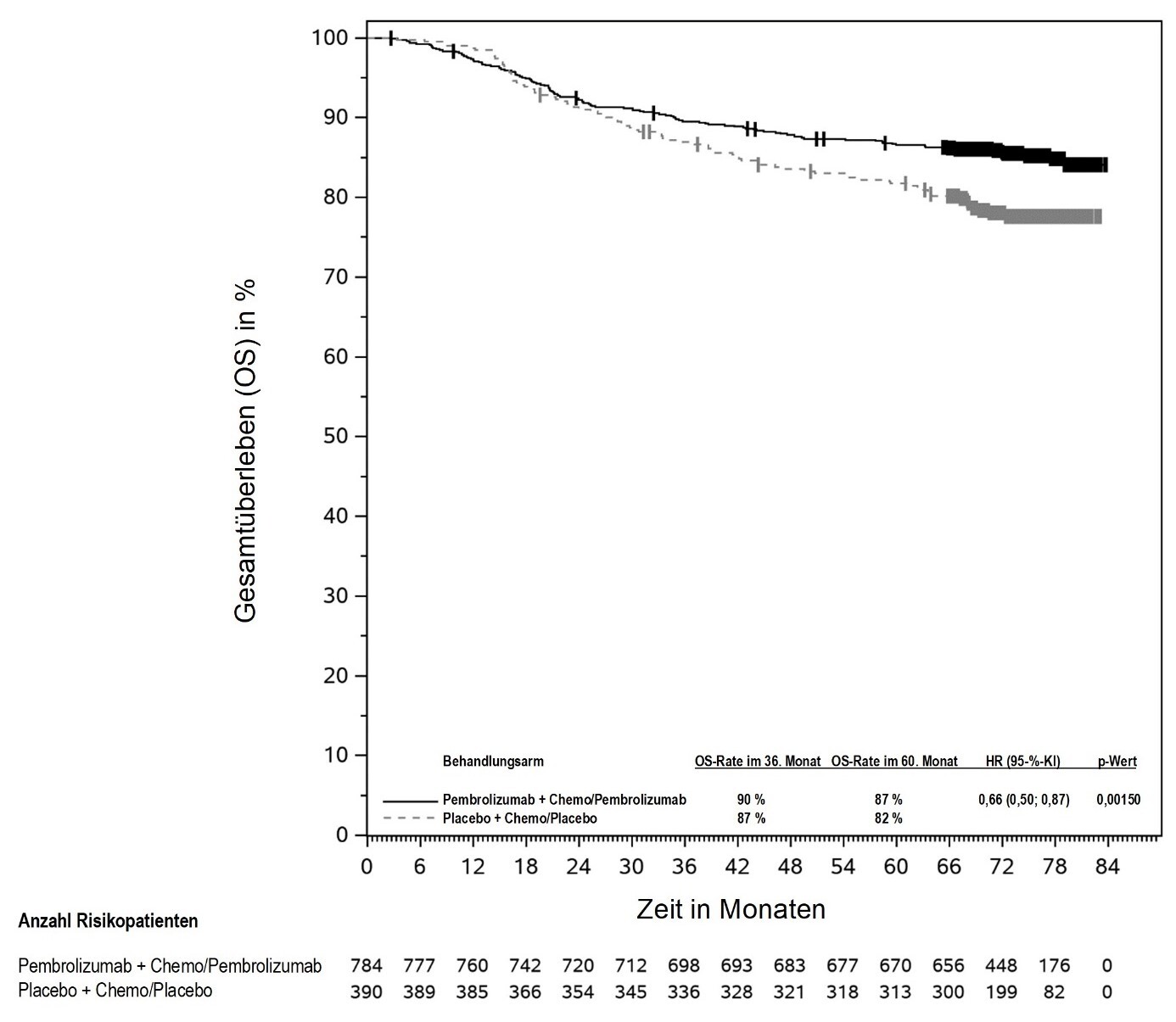
KEYNOTE-355: Kontrollierte Studie einer Kombinationstherapie bei Patienten mit TNBC ohne vorherige Behandlung der metastasierenden Erkrankung
Die Wirksamkeit von Pembrolizumab in Kombination mit Paclitaxel, nab-Paclitaxel oder Gemcitabin und Carboplatin wurde in KEYNOTE‑355, einer randomisierten, doppel-blinden, multizentrischen, placebokontrollierten Studie untersucht. Die wichtigsten Einschlusskriterien waren lokal rezidivierendes nicht-resezierbares oder metastasierendes TNBC, ungeachtet der PD-L1-Tumorexpression, ohne Vorbehandlung der fortgeschrittenen Erkrankung mit Chemotherapie. Patienten mit einer aktiven Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde stratifiziert nach Chemotherapie (Paclitaxel oder nab-Paclitaxel vs. Gemcitabin und Carboplatin), PD‑L1-Tumorexpression (CPS ≥ 1 vs. CPS < 1) und neoadjuvanter Vorbehandlung mit derselben Chemotherapeutika-Wirkstoffklasse („ja“ vs. „nein“). Die Patienten wurden randomisiert (2:1) einem der folgenden Studienarme zur Behandlung mit intravenöser Infusion zugeteilt:
Pembrolizumab 200 mg an Tag 1 alle 3 Wochen in Kombination mit nab-Paclitaxel 100 mg/m2 an den Tagen 1, 8 und 15 alle 28 Tage oder mit Paclitaxel 90 mg/m2 an den Tagen 1, 8 und 15 alle 28 Tage oder mit Gemcitabin 1 000 mg/m2 und Carboplatin AUC 2 mg/ml/min an den Tagen 1 und 8 alle 21 Tage.
Placebo an Tag 1 alle 3 Wochen in Kombination mit nab-Paclitaxel 100 mg/m2 an den Tagen 1, 8 und 15 alle 28 Tage oder mit Paclitaxel 90 mg/m2 an den Tagen 1, 8 und 15 alle 28 Tage oder mit Gemcitabin 1 000 mg/m2 und Carboplatin AUC 2 mg/ml/min an den Tagen 1 und 8 alle 21 Tage.
Die Behandlung mit Pembrolizumab bzw. Placebo, beide jeweils in Kombination mit Chemotherapie, wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten vom Prüfarzt bestätigten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Chemotherapie konnte entsprechend des Behandlungsstandards fortgesetzt werden. Die Behandlung mit Pembrolizumab konnte, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte, bei gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden. Eine Bewertung des Tumorstatus erfolgte in den Wochen 8, 16 und 24, danach alle 9 Wochen im ersten Jahr, im Anschluss daran alle 12 Wochen.
Unter den 847 randomisierten Patienten in KEYNOTE‑355 waren 636 (75 %) Patienten mit mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmter PD‑L1-Tumorexpression von CPS ≥ 1 und 323 (38 %) Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 10. Die 323 Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 10 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 53 Jahre (Spanne: 22 bis 83 Jahre); 20 % waren 65 Jahre oder älter; 100 % waren Frauen; 69 % waren kaukasischer, 20 % asiatischer und 5 % afrikanischer Herkunft. Bei 61 % bzw. 39 % der Patienten lag ein ECOG-Performance-Status von 0 bzw. 1 vor. 67 % der Patienten waren postmenopausal; 3 % hatten Hirnmetastasen in der Vorgeschichte und 20 % hatten ein krankheitsfreies Intervall von < 12 Monaten.
Die beiden primären Wirksamkeitsendpunkte waren Überleben ohne Fortschreiten der Krebserkrankung (PFS) (bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien) sowie Gesamtüberleben (OS). Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) (bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien) und die Dauer des Ansprechens. Die Studie zeigte bei Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 10 unter Pembrolizumab in Kombination mit Chemotherapie eine statistisch signifikante Verbesserung des PFS in der präspezifizierten Interimsanalyse (HR 0,65; 95-%-KI: 0,49; 0,86; p‑Wert 0,0012) sowie des OS in der finalen Analyse im Vergleich zu Placebo in Kombination mit Chemotherapie. Tabelle 45 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte. Die Abbildungen 42 und 43 zeigen die Kaplan-Meier-Kurven für PFS sowie für OS basierend auf der finalen Analyse mit einer medianen Nachbeobachtungszeit von 20,2 Monaten (Spanne: 0,3 bis 53,1 Monate) bei Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 10.
Tabelle 45: Wirksamkeitsergebnisse bei Patienten mit CPS ≥ 10 in KEYNOTE‑355
Endpunkt | Pembrolizumab | Placebo | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS)† | |||
Anzahl (%) Patienten mit Ereignis | 144 (65 %) | 81 (79 %) | |
Hazard-Ratio‡ (95-%-KI) | 0,66 (0,50; 0,88) | ||
p‑Wert§ | 0,0018 | ||
Median in Monaten (95-%-KI) | 9,7 (7,6; 11,3) | 5,6 (5,3; 7,5) | |
Gesamtüberleben (OS) | |||
Anzahl (%) Patienten mit Ereignis | 155 (70 %) | 84 (82 %) | |
Hazard-Ratio‡ (95-%-KI) | 0,73 (0,55; 0,95) | ||
p-Wert¶ | 0,0093 | ||
Median in Monaten (95-%-KI) | 23,0 (19,0; 26,3) | 16,1 (12,6; 18,8) | |
Objektive Ansprechrate (ORR)† | |||
ORR % (95-%-KI) | 53 % (46; 59) | 41 % (31; 51) | |
Vollständiges Ansprechen | 17 % | 14 % | |
Partielles Ansprechen | 35 % | 27 % | |
Dauer des Ansprechens† | |||
Median in Monaten (Spanne) | 12,8 (1,6+; 45,9+) | 7,3 (1,5; 46,6+) | |
% mit einer Dauer ≥ 6 Monaten# | 82 % | 60 % | |
% mit einer Dauer ≥ 12 Monaten# | 56 % | 38 % | |
* Chemotherapie: Paclitaxel, nab‑Paclitaxel oder Gemcitabin und Carboplatin | |||
Abbildung 42: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm mit einer PD-L1-Expression (CPS ≥ 10) in KEYNOTE‑355
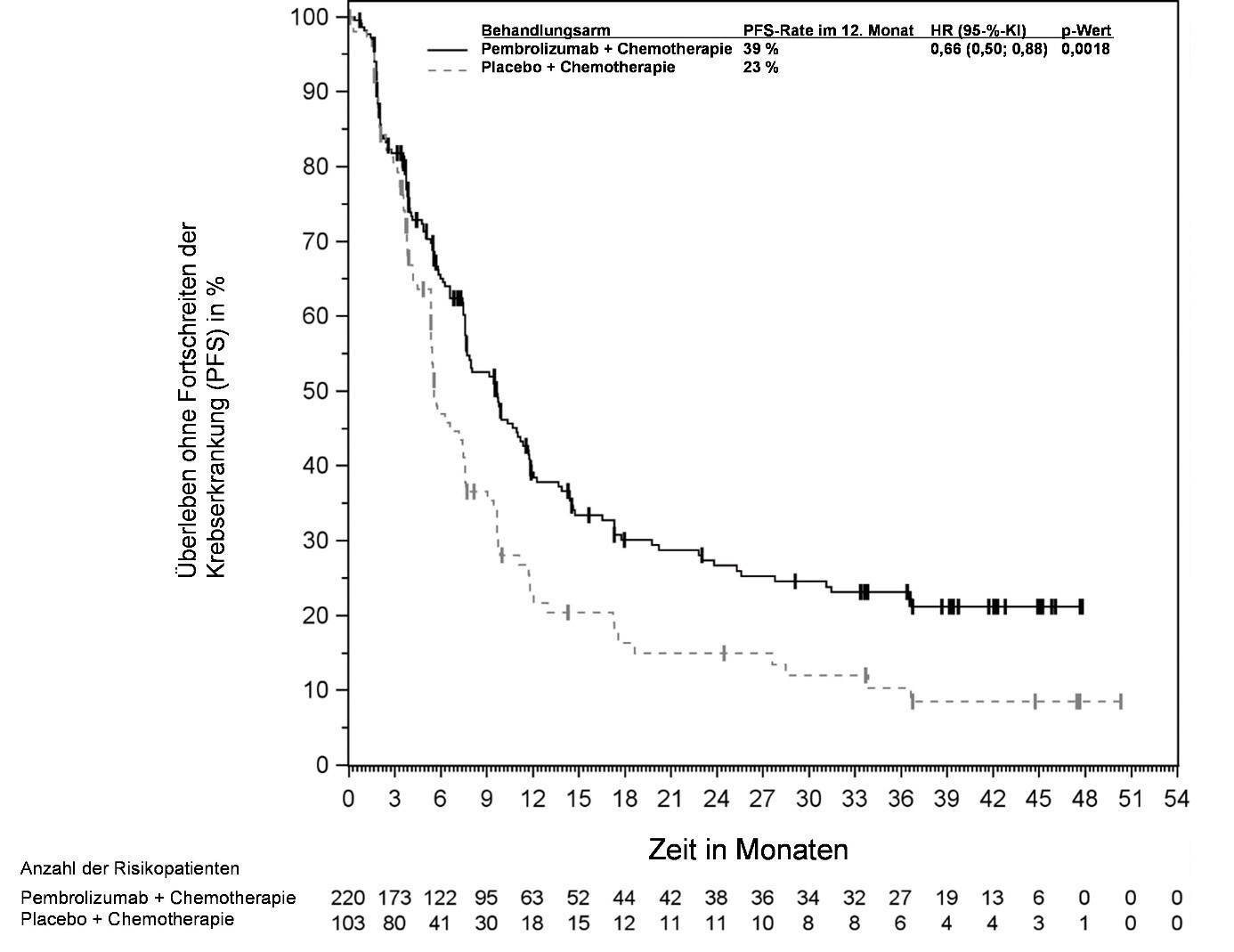
Abbildung 43: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm mit einer PD-L1-Expression (CPS ≥ 10) in KEYNOTE‑355
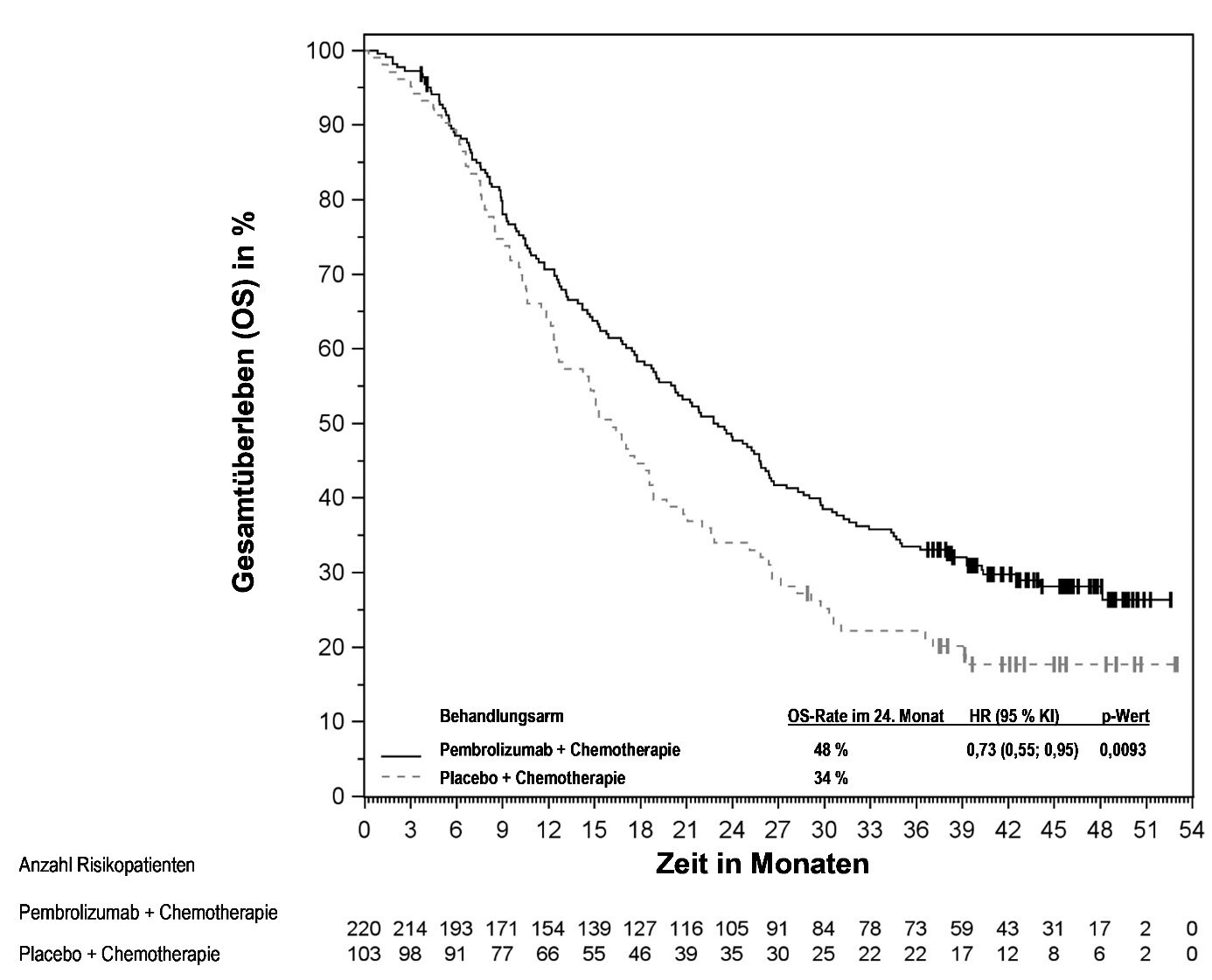
Endometriumkarzinom
KEYNOTE-868 (NRG-GY018): Kontrollierte Studie einer Kombinationstherapie zur Behandlung bei Patienten mit primär fortgeschrittenem oder rezidivierendem EC
Die Wirksamkeit von Pembrolizumab in Kombination mit Paclitaxel und Carboplatin wurde in KEYNOTE‑868 (NRG-GY018), einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten Studie bei 810 Patienten mit fortgeschrittenem oder rezidivierendem Endometriumkarzinom, darunter Patienten mit dMMR(defizienten MMR)- und pMMR(profizienten MMR)-Tumoren, untersucht. Die Patienten hatten zuvor keine systemische Therapie oder hatten zuvor eine Chemotherapie im adjuvanten Setting erhalten. Patienten, die zuvor eine adjuvante Chemotherapie erhalten hatten, waren geeignet, wenn ihr chemotherapiefreies Intervall mindestens 12 Monate betrug. Patienten mit Endometriumsarkom, einschließlich Karzinosarkom, oder Patienten mit aktiver Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach MMR-Status, ECOG-Performance-Status (0 oder 1 vs. 2) und vorheriger adjuvanter Chemotherapie stratifiziert. Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt:
Pembrolizumab 200 mg alle 3 Wochen, Paclitaxel 175 mg/m2 und Carboplatin AUC 5 mg/ml/min für 6 Zyklen, gefolgt von Pembrolizumab 400 mg alle 6 Wochen für bis zu 14 Zyklen.
Placebo alle 3 Wochen, Paclitaxel 175 mg/m2 und Carboplatin AUC 5 mg/ml/min für 6 Zyklen, gefolgt von Placebo alle 6 Wochen für bis zu 14 Zyklen.
Die Gabe der Studienmedikation erfolgte jeweils als intravenöse Infusion an Tag 1 jedes Behandlungszyklus. Die Behandlung wurde bis zum Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 20 Zyklen fortgeführt (bis zu ca. 24 Monaten). Patienten mit messbarer Erkrankung, die am Ende von Zyklus 6 eine gemäß RECIST stabile Erkrankung oder ein partielles Ansprechen aufwiesen, durften nach Ermessen des Prüfarztes die Behandlung mit Paclitaxel und Carboplatin in Kombination mit Pembrolizumab oder Placebo für bis zu 10 Zyklen fortsetzen. Die Beurteilung des Tumorstatus erfolgte in den ersten 9 Monaten alle 9 Wochen und danach alle 12 Wochen.
Unter den 810 randomisierten Patienten hatten 222 (27 %) den dMMR-Tumorstatus und 588 (73 %) den pMMR-Tumorstatus.
Die dMMR-Population war wie folgt charakterisiert: medianes Alter 66 Jahre (Spanne: 37 bis 86 Jahre), 55 % waren 65 Jahre oder älter; 79 % waren kaukasischer, 9 % afrikanischer und 3 % asiatischer Herkunft; 5 % waren hispanischer oder lateinamerikanischer Herkunft; bei 64 % lag ein ECOG-Performance-Status von 0, bei 33 % bzw. 3 % lag ein ECOG-Performance-Status von 1 bzw. 2 vor; 61 % hatten eine rezidivierende und 39 % eine primäre oder persistierende Erkrankung; 5 % hatten zuvor eine adjuvante Chemotherapie und 43 % eine Strahlentherapie erhalten. Die histologischen Subtypen waren endometrioides Karzinom (24 % Grad 1, 43 % Grad 2 und 14 % Grad 3), nicht näher bezeichnetes (Not Otherwise Specified, NOS) Adenokarzinom (11 %) sowie sonstige Karzinome (8 %, einschließlich dedifferenzierte/undifferenzierte, seröse und gemischtzellige Epithelkarzinome).
Die pMMR-Population war wie folgt charakterisiert: medianes Alter 66 Jahre (Spanne: 29 bis 94 Jahre), 54 % waren 65 Jahre oder älter; 72 % waren kaukasischer, 16 % afrikanischer und 5 % asiatischer Herkunft; 6 % waren hispanischer oder lateinamerikanischer Herkunft; bei 67 % lag ein ECOG-Performance-Status von 0, bei 30 % bzw. 3 % lag ein ECOG-Performance-Status von 1 bzw. 2 vor; 56 % hatten eine rezidivierende und 44 % eine primäre oder persistierende Erkrankung; 26 % hatten zuvor eine adjuvante Chemotherapie und 41 % eine Strahlentherapie erhalten. Die histologischen Subtypen waren endometrioides Karzinom (17 % Grad 1, 19 % Grad 2 und 16 % Grad 3), seröses Karzinom (26 %), nicht näher bezeichnetes (NOS) Adenokarzinom (10 %), klarzelliges Karzinom (7 %) sowie sonstige Karzinome (5 %, einschließlich gemischtzellige und dedifferenzierte/undifferenzierte Epithelkarzinome).
Primärer Wirksamkeitsendpunkt war das vom Prüfarzt gemäß RECIST‑v1.1-Kriterien beurteilte PFS in den dMMR- und pMMR-Populationen. Sekundäre Wirksamkeitsendpunkte waren das OS, ORR und die Ansprechdauer in den dMMR- und pMMR-Populationen. Die Studie zeigte sowohl in der dMMR- als auch in der pMMR-Population statistisch signifikante Verbesserungen des PFS bei Patienten, die zu Pembrolizumab in Kombination mit Chemotherapie randomisiert wurden, im Vergleich zu Patienten, die Placebo in Kombination mit Chemotherapie erhielten. Die mediane Nachbeobachtungszeit betrug 13,6 Monate (Spanne: 0,6 bis 39,4 Monate) bzw. 8,7 Monate (Spanne: 0,1 bis 37,2 Monate) in den dMMR- bzw. pMMR-Populationen. Der OS-Endpunkt wurde im Rahmen der Multiplizitätskontrolle nicht formal beurteilt. Die OS‑Ergebnisse waren noch nicht aussagekräftig. Die Wirksamkeitsergebnisse nach MMR-Status sind in Tabelle 46 zusammengefasst. Die Kaplan-Meier-Kurven für PFS nach MMR-Status sind in den Abbildungen 44 bzw. 45 dargestellt.
Tabelle 46: Wirksamkeitsergebnisse in KEYNOTE-868 (NRG-GY018)
Endpunkt | dMMR-Population | pMMR-Population | ||
Pembrolizumab | Placebo | Pembrolizumab | Placebo | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||||
Anzahl (%) Patienten mit Ereignis | 29 (26 %) | 60 (54 %) | 95 (32 %) | 138 (47 %) |
Median in Monaten (95-%-KI) | N.e. | 8,3 | 13,1 | 8,7 |
Hazard-Ratio† | 0,34 (0,22; 0,53) | 0,57 (0,44; 0,74) | ||
p-Wert‡ | < 0,0001 | < 0,0001 | ||
Gesamtüberleben (OS) | ||||
Anzahl (%) Patienten mit Ereignis | 10 (9 %) | 17 (15 %) | 45 (15 %) | 54 (18 %) |
Median in Monaten (95-%-KI) | N.e. | N.e. | 28,0 | 27,4 |
Hazard-Ratio† | 0,55 (0,25; 1,19) | 0,79 (0,53; 1,17) | ||
Objektive Ansprechrate (ORR) | ||||
Anzahl Patienten mit messbarer Erkrankung zu Behandlungsbeginn | n = 95 | n = 95 | n = 220 | n = 235 |
ORR¶ % (95-%-KI) | 78 % (68; 86) | 69 % (59; 79) | 61 % (55; 68) | 51 % (45; 58) |
Dauer des Ansprechens | ||||
Median in Monaten (Spanne) | N.e. | 4,4 | 7,1 | 6,4 |
* Chemotherapie (Paclitaxel und Carboplatin) | ||||
Abbildung 44: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) in KEYNOTE‑868 (NRG-GY018) in der dMMR-Population
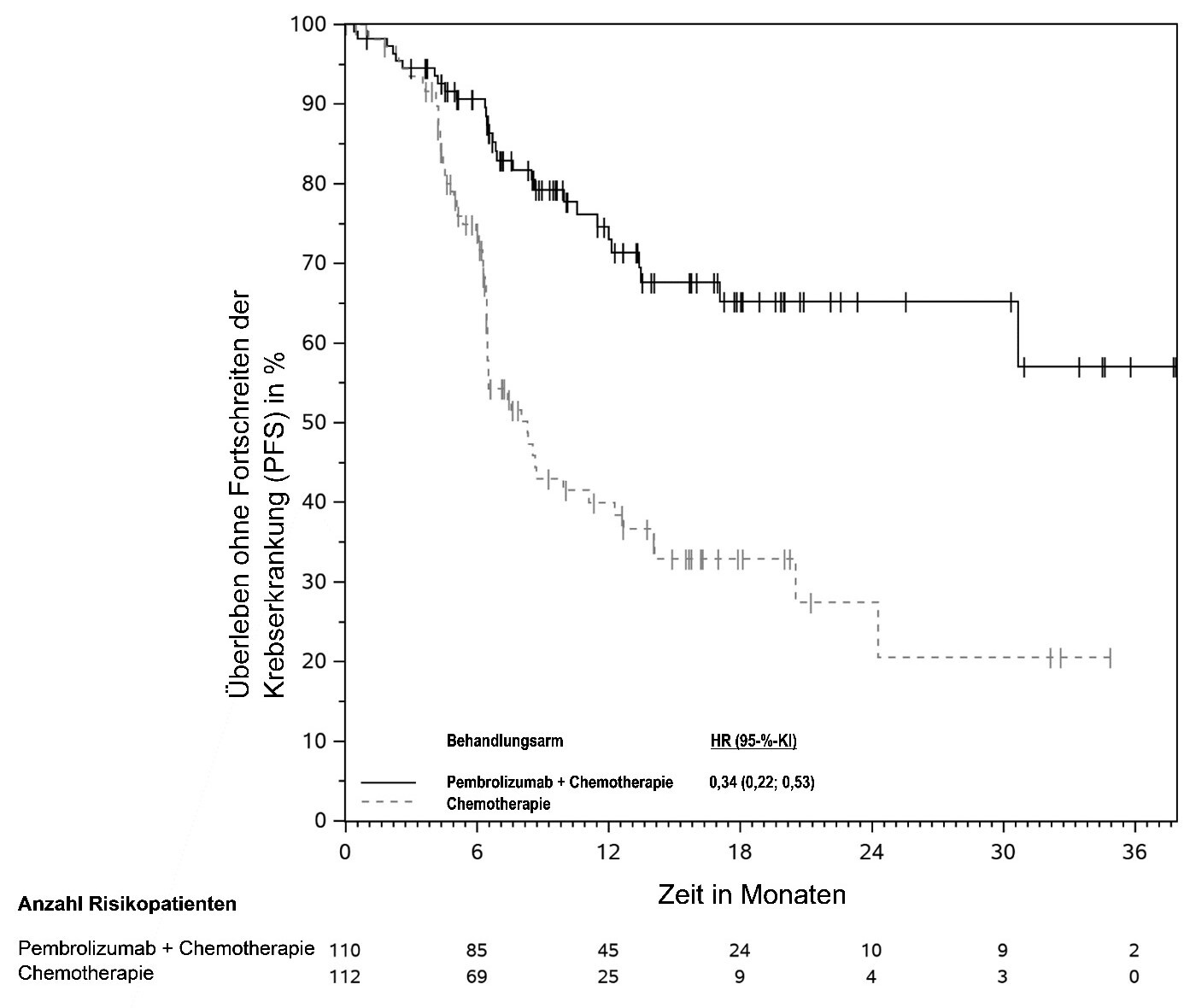
Abbildung 45: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) in KEYNOTE‑868 (NRG-GY018) in der pMMR-Population
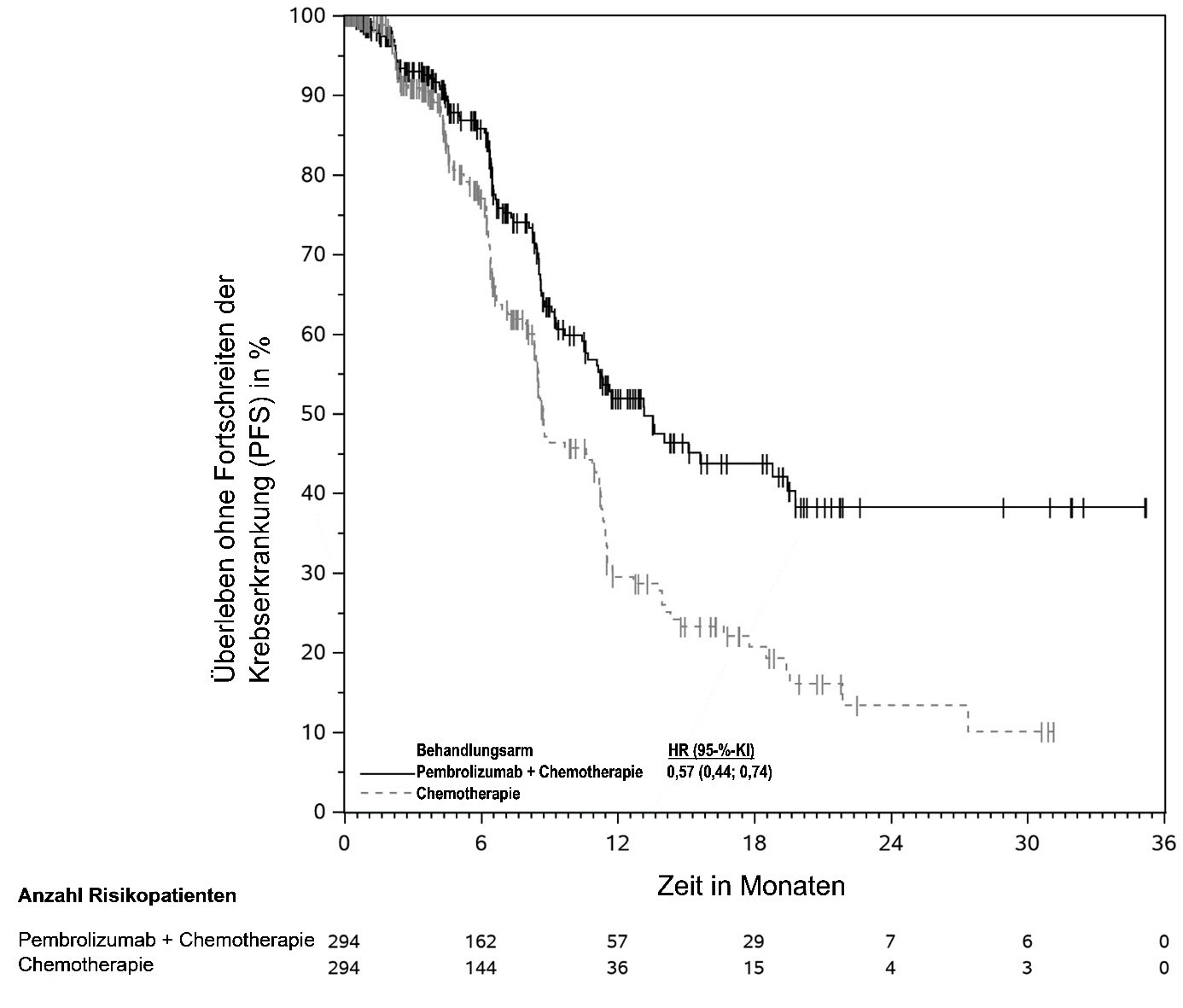
KEYNOTE-775: Kontrollierte Studie einer Kombinationstherapie bei Patienten mit fortgeschrittenem EC nach Vorbehandlung mit systemischer Chemotherapie
Die Wirksamkeit von Pembrolizumab in Kombination mit Lenvatinib wurde in KEYNOTE‑775, einer randomisierten, multizentrischen, offenen, aktiv-kontrollierten Studie bei Patienten mit fortgeschrittenem EC, die mit mindestens einer Platin-haltigen Chemotherapie jeglichen Settings, einschließlich neoadjuvanter und adjuvanter Settings, vorbehandelt waren, untersucht. Die Patienten konnten insgesamt bis zu zwei Platin-haltige Therapien erhalten haben, sofern eine Therapie im neoadjuvanten oder adjuvanten Behandlungssetting gegeben wurde. Patienten mit Endometriumsarkom, Karzinosarkom, vorbestehender Fistel vom Grad ≥ 3, nicht-kontrolliertem Blutdruck (> 150/90 mmHg), signifikanten kardiovaskulären Beeinträchtigungen oder Ereignissen innerhalb der letzten 12 Monate bzw. Patienten mit aktiver Autoimmunerkrankung oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach MMR‑Status (dMMR oder pMMR [mismatch repair proficient]) mittels eines validierten IHC‑Tests stratifiziert. Das pMMR‑Stratum wurde weiter nach ECOG-Performance-Status, geografischer Region und Bestrahlung der Beckenregion in der Krankengeschichte stratifiziert. Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt:
Pembrolizumab 200 mg intravenös alle 3 Wochen in Kombination mit Lenvatinib 20 mg zum Einnehmen einmal/Tag.
Therapie nach Maßgabe des Prüfarztes mit entweder Doxorubicin 60 mg/m2 alle 3 Wochen oder Paclitaxel 80 mg/m2 wöchentlich über 3 Wochen mit anschließender einwöchiger Pause.
Die Behandlung mit Pembrolizumab und Lenvatinib wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten, mittels BICR bestätigten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität oder im Falle von Pembrolizumab bis zu einem Maximum von 24 Monaten fortgeführt. Die Gabe der Studienmedikation konnte bei gemäß RECIST‑v1.1-Kriterien definiertem Fortschreiten der Krebserkrankung fortgeführt werden, sofern der Patient nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte und die Behandlung vertragen wurde. Bei insgesamt 121/411 (29 %) Patienten unter Pembrolizumab und Lenvatinib wurde die Studientherapie über das RECIST‑v1.1-Kriterien definierte Fortschreiten der Krebserkrankung hinaus fortgeführt. Die mediane Dauer der Therapie nach Fortschreiten der Krebserkrankung betrug 2,8 Monate. Eine Bewertung des Tumorstatus wurde alle 8 Wochen durchgeführt.
Insgesamt wurden 827 Patienten in die Studie aufgenommen und erhielten randomisiert Pembrolizumab in Kombination mit Lenvatinib (n = 411) oder nach Maßgabe des Prüfarztes Doxorubicin (n = 306) oder Paclitaxel (n = 110). Diese Patienten waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 65 Jahre (Spanne: 30 bis 86 Jahre); 50 % waren 65 Jahre oder älter; 61 % waren kaukasischer, 21 % asiatischer und 4 % afrikanischer Herkunft. Bei 59 % bzw. 41 % der Patienten lag ein ECOG-Performance-Status von 0 bzw. 1 vor; bei 84 % der Patienten lag ein pMMR-Tumorstatus und bei 16 % ein dMMR-Tumorstatus vor. Die histologischen Subtypen waren endometrioides Karzinom (60 %), seröses Karzinom (26 %), klarzelliges Karzinom (6 %), gemischtzelliges Karzinom (5 %) sowie sonstige Karzinome (3 %). Alle 827 dieser Patienten erhielten eine vorhergehende systemische Therapie des EC: 69 % der Patienten erhielten eine, 28 % der Patienten erhielten zwei und 3 % erhielten drei oder mehr vorhergehende systemische Therapien. 37 % der Patienten erhielten nur eine vorherige neoadjuvante oder adjuvante Therapie.
Primäre Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS), das mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurde. Zu den sekundären Wirksamkeitsendpunkten gehörte die Objektive Ansprechrate (ORR), die mittels BICR gemäß RECIST‑v1.1-Kriterien bewertet wurde. Bei der präspezifizierten Interimsanalyse mit einer medianen Nachbeobachtungszeit von 11,4 Monaten (Spanne: 0,3 bis 26,9 Monate) zeigte die Studie eine statistisch signifikante Verbesserung des OS und PFS. Die präspezifizierte finale Analyse des OS mit etwa 16 Monaten zusätzlicher Nachbeobachtungsdauer ab der Interimsanalyse (gesamte mediane Nachbeobachtungszeit von 14,7 Monaten [Spanne: 0,3 bis 43,0 Monate]) wurde ohne Adjustierung für das multiple Testen durchgeführt. Die Wirksamkeitsergebnisse der MMR‑Subgruppen stimmten mit den Gesamtstudienergebnissen überein. Tabelle 47 enthält eine Zusammenfassung der Ergebnisse für PFS, ORR und die Dauer des Ansprechens zum Zeitpunkt der Interimsanalyse sowie für OS zum Zeitpunkt der finalen Analyse. Die Kaplan-Meier-Kurven für OS zum Zeitpunkt der finalen Analyse bzw. PFS zum Zeitpunkt der Interimsanalyse sind in den Abbildungen 46 bzw. 47 dargestellt.
Tabelle 47: Wirksamkeitsergebnisse in KEYNOTE-775
Endpunkt | Pembrolizumab | Chemotherapie* n = 416 | |
Gesamtüberleben (OS) | |||
Anzahl (%) Patienten mit Ereignis | 276 (67 %) | 329 (79 %) | |
Median in Monaten (95-%-KI) | 18,7 (15,6; 21,3) | 11,9 (10,7; 13,3) | |
Hazard-Ratio† (95-%-KI) | 0,65 (0,55; 0,77) | ||
p-WertÞ | < 0,0001 | ||
Überleben ohne Fortschreiten der Krebserkrankung (PFS)ß | |||
Anzahl (%) Patienten mit Ereignis | 281 (68 %) | 286 (69 %) | |
Median in Monaten (95-%-KI) | 7,2 (5,7; 7,6) | 3,8 (3,6; 4,2) | |
Hazard-Ratio† (95-%-KI) | 0,56 (0,47; 0,66) | ||
p-Wert‡ | < 0,0001 | ||
Objektive Ansprechrate (ORR)ß | |||
ORR§ % (95-%-KI) | 32 % (27; 37) | 15 % (11; 18) | |
Vollständiges Ansprechen | 7 % | 3 % | |
Partielles Ansprechen | 25 % | 12 % | |
p-Wert¶ | < 0,0001 | ||
Dauer des Ansprechensß | |||
Median in Monaten# (Spanne) | 14,4 (1,6+; 23,7+) | 5,7 (0,0+; 24,2+) | |
* Doxorubicin oder Paclitaxel | |||
Abbildung 46: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑775 (Intent-to-Treat-Population)
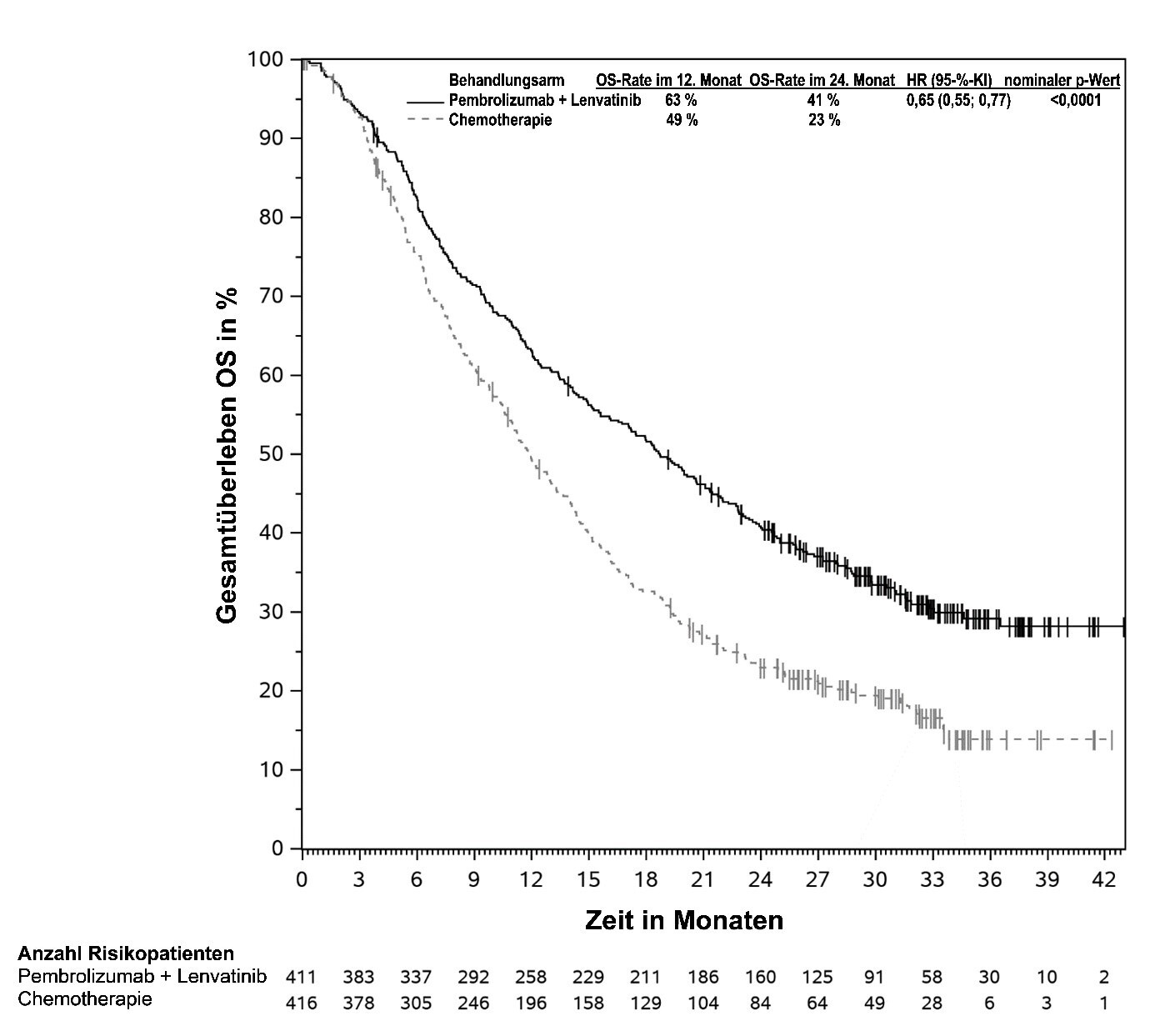
Abbildung 47: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑775 (Intent-to-Treat-Population)
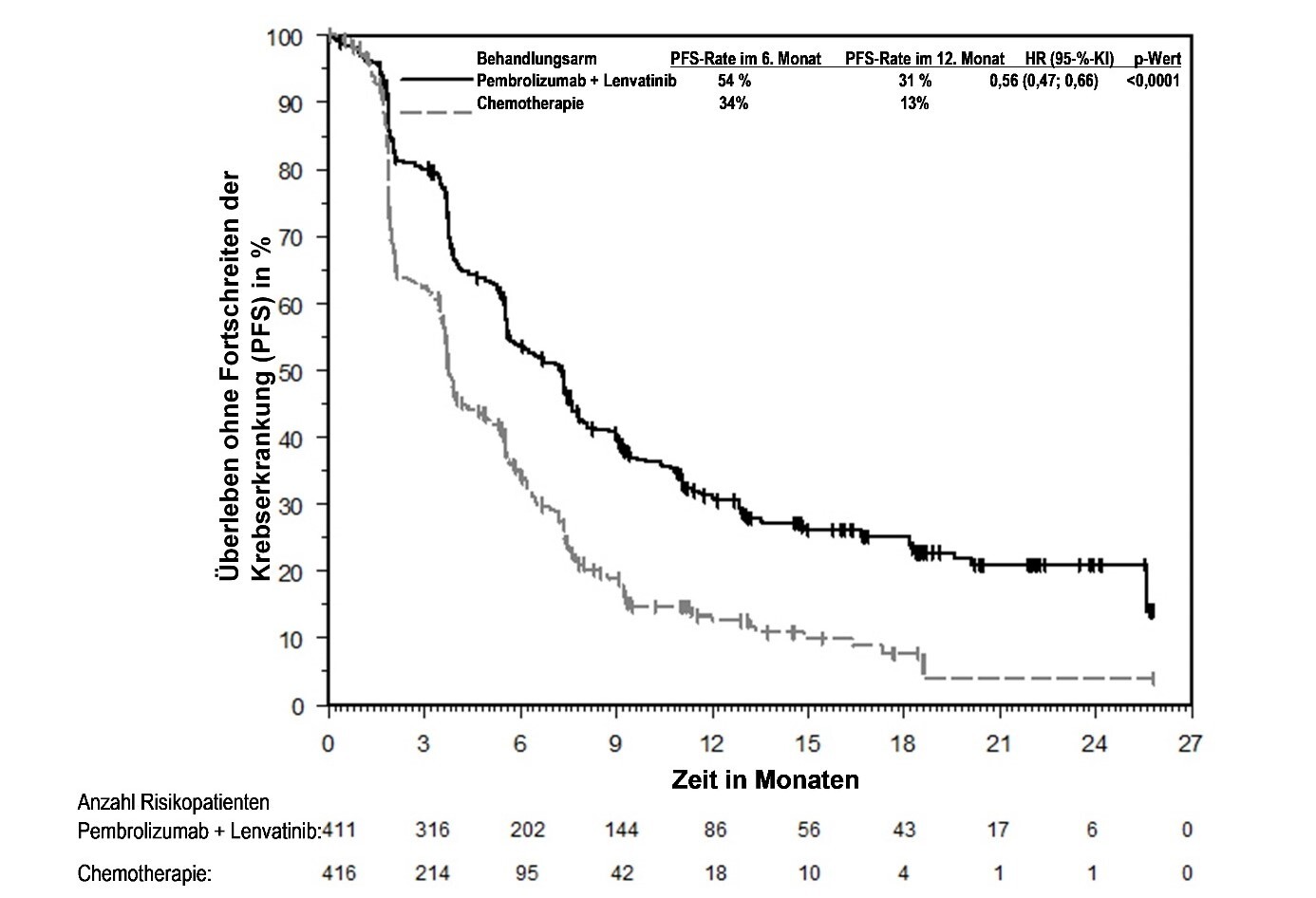
Zervixkarzinom
KEYNOTE-A18: Kontrollierte Studie einer Kombinationstherapie mit CRT bei Patienten mit lokal fortgeschrittenem Zervixkarzinom
Die Wirksamkeit von Pembrolizumab in Kombination mit Cisplatin und einer perkutanen Strahlentherapie (EBRT [external beam radiation therapy]), gefolgt von einer Brachytherapie (BT), wurde im Rahmen der Studie KEYNOTE-A18 untersucht, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie, die 1 060 Patienten mit lokal fortgeschrittenem Zervixkarzinom einschloss, die zuvor noch keine definitive Operation, Bestrahlung oder systemische Therapie des Zervixkarzinoms erhalten hatten. Darunter waren 601 Patienten mit FIGO (Internationale Föderation für Gynäkologie und Geburtshilfe) 2014 Stadium III bis IVA (Tumorbefall des unteren Teils der Vagina mit oder ohne Ausdehnung auf die Beckenseitenwand oder Hydronephrose/nicht funktionierende Niere oder Ausbreitung auf benachbarte Beckenorgane) mit entweder nodal-positiver oder nodal-negativer Erkrankung und 459 Patienten mit FIGO 2014 Stadium IB2 bis IIB (Tumorläsionen > 4 cm oder klinisch sichtbare Läsionen, die sich über den Uterus hinaus ausgebreitet haben, jedoch nicht die Beckenwand oder das untere Drittel der Vagina erreicht haben) mit nodal-positiver Erkrankung. Patienten mit einer Autoimmunerkrankung, die innerhalb der letzten beiden Behandlungsjahre eine systemische Therapie erforderte, oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach geplantem Typ der EBRT (Intensitätsmodulierte Strahlentherapie (IMRT [intensity-modulated radiation therapy]) oder Volumetric-Arc-Therapie (VMAT [volumetric modulated arc therapy]) vs. non-IMRT und non-VMAT), Stadium des Zervixkarzinoms zum Zeitpunkt des Screenings (FIGO 2014 Stadium IB2 bis IIB vs. Stadium III bis IVA) sowie geplanter Gesamtstrahlendosis ([EBRT + BT-Dosis] < 70 Gy vs. ≥ 70 Gy gemäß Äquivalentdosis in 2 Gy-Fraktionen [EQD2]) stratifiziert. Die Patienten wurden randomisiert (1:1) einem der beiden Behandlungsarme zugeteilt:
Pembrolizumab 200 mg intravenös alle 3 Wochen (5 Zyklen) gleichzeitig mit Cisplatin 40 mg/m2 intravenös wöchentlich (5 Zyklen, optional konnte abhängig von der lokalen Behandlungspraxis eine sechste Infusion gegeben werden) und Strahlentherapie (EBRT gefolgt von BT), gefolgt von Pembrolizumab 400 mg intravenös alle 6 Wochen (15 Zyklen).
Placebo intravenös alle 3 Wochen (5 Zyklen) gleichzeitig mit Cisplatin 40 mg/m2 intravenös wöchentlich (5 Zyklen, optional konnte abhängig von der lokalen Behandlungspraxis eine sechste Infusion gegeben werden) und Strahlentherapie (EBRT gefolgt von BT), gefolgt von Placebo intravenös alle 6 Wochen (15 Zyklen).
Die Behandlung wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten, vom Prüfarzt bestätigten Fortschreiten der Krebserkrankung oder bis zum Auftreten unzumutbarer Toxizität fortgeführt. Eine Bewertung des Tumorstatus erfolgte alle 12 Wochen innerhalb der ersten beiden Jahre, alle 24 Wochen im dritten Jahr, im Anschluss daran jährlich.
Die 601 Patienten mit FIGO 2014 Stadium III bis IVA in KEYNOTE-A18 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 51 Jahre (Spanne: 22 bis 87 Jahre); 16 % waren 65 Jahre oder älter; 36 % waren kaukasischer, 1 % afrikanischer und 34 % asiatischer Herkunft, 38 % waren hispanischer oder lateinamerikanischer Herkunft; bei 68 % bzw. 32 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor; 93 % hatten einen CPS ≥ 1; 71 % hatten positive Becken- und/oder positive paraaortale Lymphknoten, 29 % hatten weder positive Becken- noch paraaortale Lymphknoten; bei 86 % wurde eine IMRT oder VMAT EBRT angewendet; bei 90 % war die Gesamtstrahlendosis ≥ 70 Gy (EQD2). Bei 84 % lag ein Plattenepithelkarzinom vor und 16 % hatten eine nicht-plattenepitheliale Histologie.
Die primären Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Krebserkrankung (PFS) (das gemäß RECIST‑v1.1-Kriterien vom Prüfarzt bewertet oder histopathologisch bestätigt wurde) und das Gesamtüberleben (OS). Die Studie zeigte eine statistisch signifikante Verbesserung hinsichtlich PFS (0,70 [95-%-KI 0,55; 0,89; p-Wert 0,0020]) zum Zeitpunkt der ersten präspezifizierten Interimsanalyse und OS (0,67 [95-%-KI 0,50; 0,90; p-Wert 0,0040]) zum Zeitpunkt der zweiten präspezifizierten Interimsanalyse in der Gesamtpopulation bei Patienten, die zu Pembrolizumab mit CRT randomisiert wurden, im Vergleich zu Placebo mit CRT. Tabelle 48 fasst die wichtigsten Wirksamkeitsendpunkte aus der zweiten präspezifizierten Interimsanalyse bei Patienten mit FIGO 2014 Stadium III bis IVA mit einer medianen Nachbeobachtungszeit von 26,6 Monaten (Spanne: 0,9 bis 41,7 Monate) zusammen. Die Kaplan-Meier-Kurven bei Patienten mit FIGO 2014 Stadium III bis IVA für OS und PFS basierend auf dieser Analyse sind in den Abbildungen 48 bzw. 49 dargestellt.
Tabelle 48: Wirksamkeitsergebnisse in KEYNOTE-A18 bei Patienten mit Zervixkarzinom (FIGO 2014 Stadium III bis IVA)
Endpunkt | Pembrolizumab | Placebo |
n = 296 | n = 305 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 43 (15 %) | 73 (24 %) |
Median in Monaten (95-%-KI) | N.e. (N.e.; N.e.) | N.e. (N.e.; N.e.) |
Hazard-Ratio* (95-%-KI) | 0,57 (0,39; 0,83) | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) gemäß Prüfarzt | ||
Anzahl (%) Patienten mit Ereignis | 79 (27 %) | 125 (41 %) |
Median in Monaten (95-%-KI) | N.e. (N.e.; N.e.) | N.e. (26,3; N.e.) |
Hazard-Ratio* (95-%-KI) | 0,57 (0,43; 0,76) | |
* Basierend auf dem unstratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 48: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE-A18 bei Patienten mit Zervixkarzinom (FIGO 2014 Stadium III bis IVA)
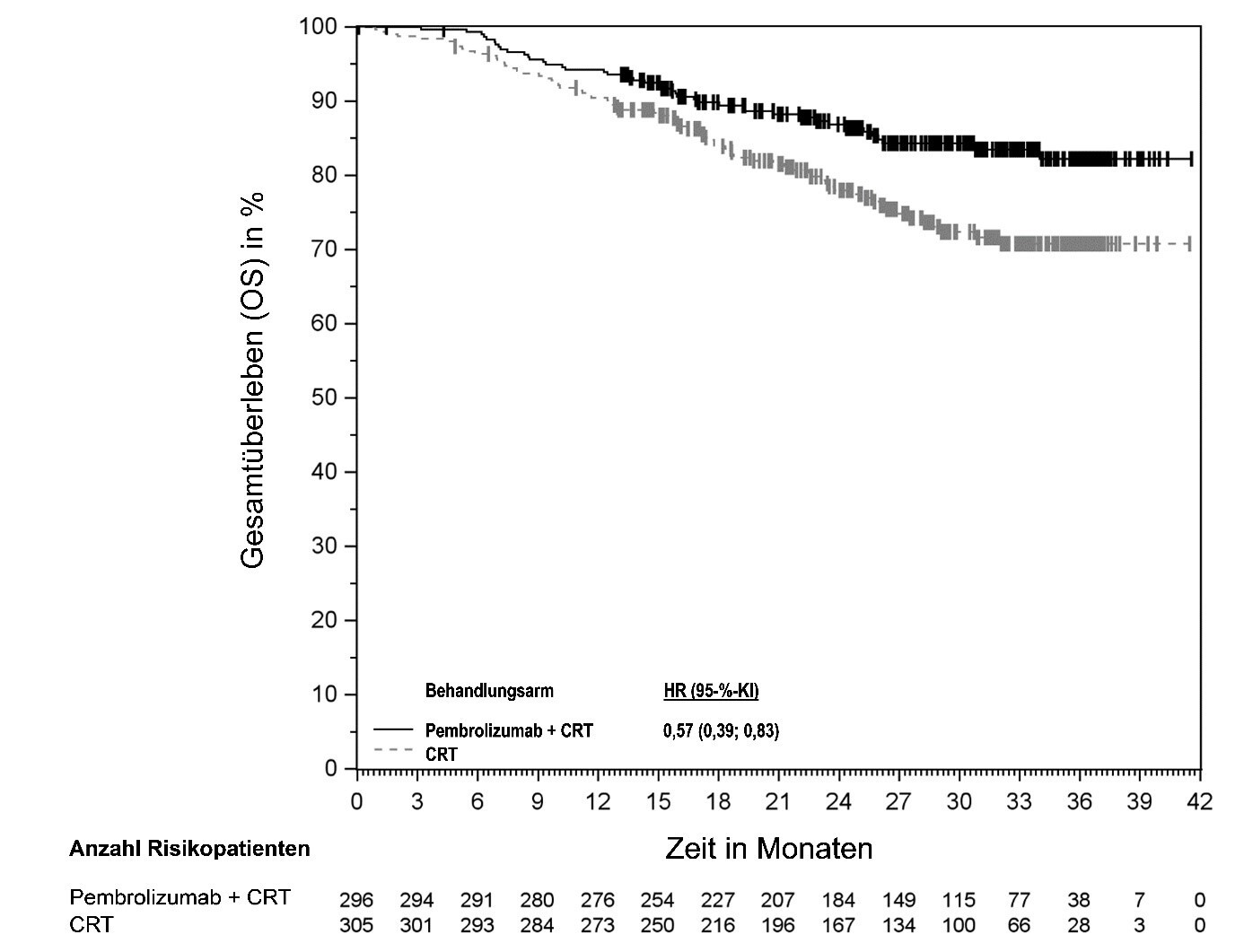
Abbildung 49: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑A18 bei Patienten mit Zervixkarzinom (FIGO 2014 Stadium III bis IVA)
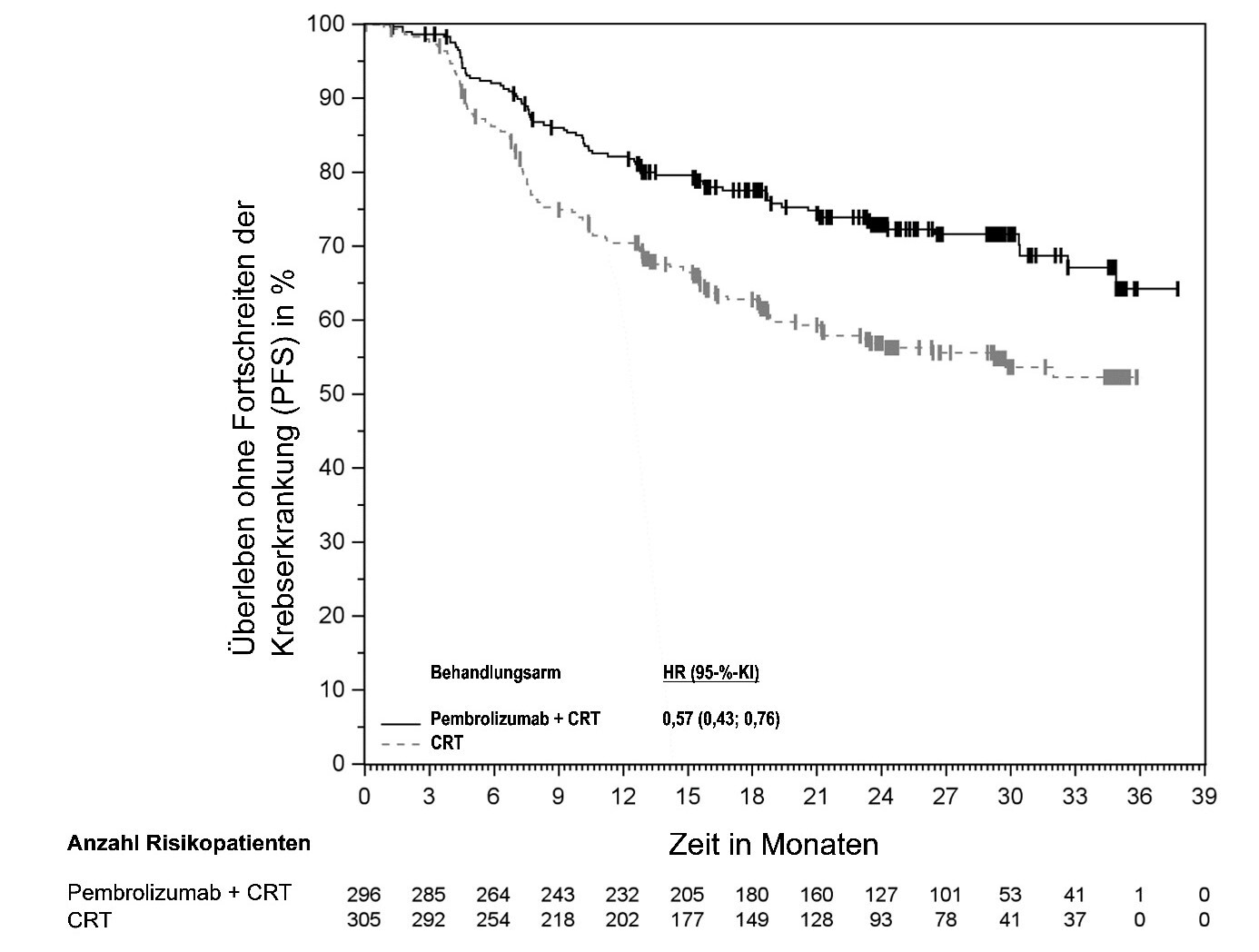
KEYNOTE-826: Kontrollierte Studie einer Kombinationstherapie bei Patienten mit persistierendem, rezidivierendem oder metastasierendem Zervixkarzinom
Die Wirksamkeit von Pembrolizumab in Kombination mit Paclitaxel und Cisplatin oder Paclitaxel und Carboplatin, mit oder ohne Bevacizumab, wurde im Rahmen der Studie KEYNOTE-826 untersucht, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie, die 617 Patienten mit persistierendem, rezidivierendem oder metastasierendem Zervixkarzinom in der Erstlinie einschloss, die nicht mit Chemotherapie vorbehandelt waren, außer bei gleichzeitiger Anwendung als Strahlensensibilisator. Die Patienten wurden ungeachtet des PD‑L1-Tumor-Expressions-Status eingeschlossen. Patienten mit einer Autoimmunerkrankung, die eine systemische Therapie innerhalb der letzten beiden Behandlungsjahre erforderte, oder Patienten mit einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach Status der Metastasierung bei Erstdiagnose, nach Entscheidung des Prüfarztes hinsichtlich der Anwendung von Bevacizumab sowie PD‑L1-Status (CPS < 1 vs. CPS 1 bis < 10 vs. CPS ≥ 10) stratifiziert. Die Patienten wurden randomisiert (1:1) einem der beiden Behandlungsarme zugeteilt:
Behandlungsarm 1: Pembrolizumab 200 mg plus Chemotherapie mit oder ohne Bevacizumab
Behandlungsarm 2: Placebo plus Chemotherapie mit oder ohne Bevacizumab
Der Prüfarzt wählte vor Randomisierung eines der folgenden vier Behandlungsregime aus:
Paclitaxel 175 mg/m2 + Cisplatin 50 mg/m2
Paclitaxel 175 mg/m2 + Cisplatin 50 mg/m2 + Bevacizumab 15 mg/kg KG
Paclitaxel 175 mg/m2 + Carboplatin AUC 5 mg/ml/min
Paclitaxel 175 mg/m2 + Carboplatin AUC 5 mg/ml/min + Bevacizumab 15 mg/kg KG
Die Gabe der Studienmedikation erfolgte jeweils als intravenöse Infusion an Tag 1 jedes dreiwöchigen Behandlungszyklus. Cisplatin konnte an Tag 2 jedes dreiwöchigen Behandlungszyklus gegeben werden. Die Option, Bevacizumab zu verwenden, lag vor Randomisierung im Ermessen des Prüfarztes. Die Behandlung mit Pembrolizumab wurde bis zu einem gemäß RECIST‑v1.1-Kriterien definierten Fortschreiten der Krebserkrankung, bis zum Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Verabreichung von Pembrolizumab war auch über die nach RECIST definierte Krankheitsprogression hinaus zulässig, sofern der Patient klinisch stabil war und nach Ermessen des Prüfarztes von der Behandlung klinisch profitierte. Eine Bewertung des Tumorstatus erfolgte in Woche 9, danach alle 9 Wochen innerhalb des ersten Jahres, im Anschluss daran alle 12 Wochen.
Unter den 617 eingeschlossenen Patienten waren 548 (89 %) Patienten mit PD‑L1-exprimierenden Tumoren mit einem CPS ≥ 1 (basierend auf dem PD‑L1 IHC 22C3 pharmDxTM Kit). Von diesen 548 eingeschlossenen Patienten mit PD‑L1-exprimierenden Tumoren wurden 273 Patienten zu Pembrolizumab in Kombination mit Chemotherapie mit oder ohne Bevacizumab und 275 Patienten zu Placebo in Kombination mit Chemotherapie mit oder ohne Bevacizumab randomisiert. Zu Studienbeginn waren diese 548 Patienten wie folgt charakterisiert: medianes Alter 51 Jahre (Spanne: 22 bis 82 Jahre); 16 % waren 65 Jahre oder älter; 59 % waren kaukasischer, 18 % asiatischer und 1 % afrikanischer Herkunft, 37 % waren hispanischer oder lateinamerikanischer Herkunft; bei 56 % bzw. 43 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor; 63 % erhielten Bevacizumab als Studienmedikation; bei 21 % lag ein Adenokarzinom und bei 5 % eine adenosquamöse Histologie vor; von den Patienten mit persistierender oder rezidivierender Erkrankung mit oder ohne Fernmetastasen hatten zuvor 39 % nur eine Radiochemotherapie und 17 % eine Radiochemotherapie sowie eine Operation erhalten.
Die primären Wirksamkeitsendpunkte waren das Gesamtüberleben (OS) und das Überleben ohne Fortschreiten der Krebserkrankung (PFS), das gemäß RECIST‑v1.1-Kriterien vom Prüfarzt bewertet wurde. Sekundäre Wirksamkeitsendpunkte waren die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens, gemäß RECIST‑v1.1-Kriterien, beurteilt vom Prüfarzt. In einer präspezifizierten Interimsanalyse zeigte die Studie statistisch signifikante Verbesserungen hinsichtlich OS (HR 0,64; 95-%-KI: 0,50; 0,81; p‑Wert = 0,0001) und PFS (HR 0,62; 95-%-KI: 0,50; 0,77; p‑Wert < 0,0001) bei den Patienten mit PD‑L1-exprimierenden Tumoren mit einem CPS ≥ 1, die zu Pembrolizumab in Kombination mit Chemotherapie mit oder ohne Bevacizumab randomisiert wurden, im Vergleich zu Placebo in Kombination mit Chemotherapie mit oder ohne Bevacizumab. Die Studie zeigte ebenfalls statistisch signifikante Verbesserungen hinsichtlich OS und PFS bei der Gesamtpopulation. Tabelle 49 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte bei Patienten mit PD‑L1-exprimierenden Tumoren mit einem CPS ≥ 1 in KEYNOTE‑826 zum Zeitpunkt der finalen Analyse mit einer medianen Nachbeobachtungszeit von 21,3 Monaten. Die Kaplan-Meier-Kurven für OS und PFS basierend auf der finalen Analyse sind in den Abbildungen 50 und 51 dargestellt.
Tabelle 49: Wirksamkeitsergebnisse in KEYNOTE-826 bei Patienten mit PD-L1-Expression (CPS ≥ 1)
Endpunkt | Pembrolizumab 200 mg alle 3 Wochen | Placebo |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 153 (56 %) | 201 (73 %) |
Median in Monaten (95-%-KI) | 28,6 (22,1; 38,0) | 16,5 (14,5; 20,0) |
Hazard-Ratio† (95-%-KI) | 0,60 (0,49; 0,74) | |
p-Wert‡ | < 0,0001 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 171 (63 %) | 220 (80 %) |
Median in Monaten (95-%-KI) | 10,5 (9,7; 12,3) | 8,2 (6,3; 8,5) |
Hazard-Ratio† (95-%-KI) | 0,58 (0,47; 0,71) | |
p‑Wert‡ | < 0,0001 | |
Objektive Ansprechrate (ORR) | ||
ORR¶ % (95-%-KI) | 69 % (63; 74) | 51 % (45; 57) |
Vollständiges Ansprechen | 26 % | 15 % |
Partielles Ansprechen | 43 % | 36 % |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 19,2 (1,3+; 40,9+) | 10,4 (1,5+; 40,7+) |
% mit einer Dauer ≥ 12 Monaten# | 56 | 45 |
% mit einer Dauer ≥ 24 Monaten# | 48 | 30 |
* Chemotherapie (Paclitaxel und Cisplatin oder Paclitaxel und Carboplatin) | ||
Abbildung 50: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm mit einer PD-L1-Expression (CPS ≥ 1) in KEYNOTE‑826
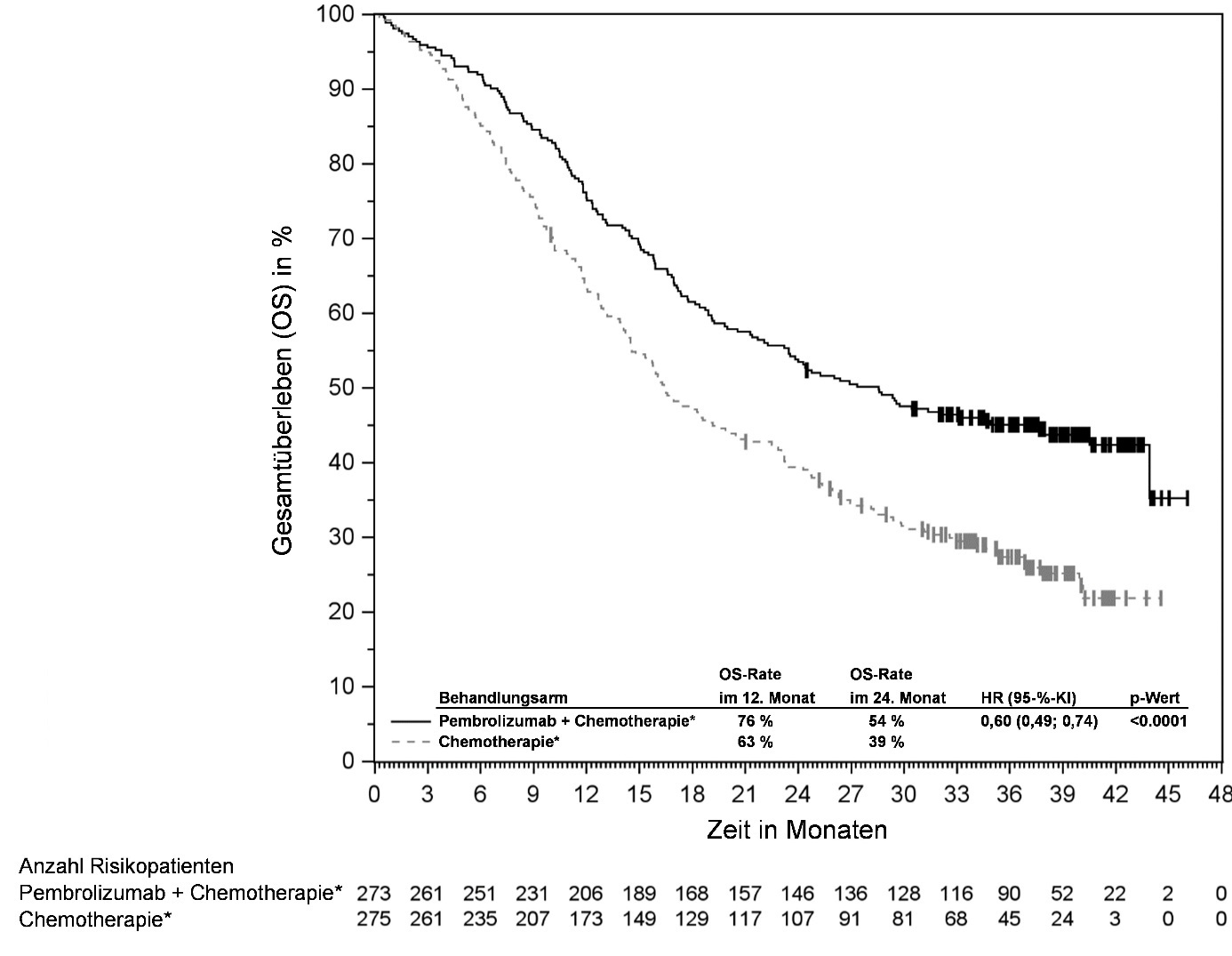
* Chemotherapie (Paclitaxel und Cisplatin oder Paclitaxel und Carboplatin) mit oder ohne Bevacizumab
Abbildung 51: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm mit einer PD-L1-Expression (CPS ≥ 1) in KEYNOTE‑826
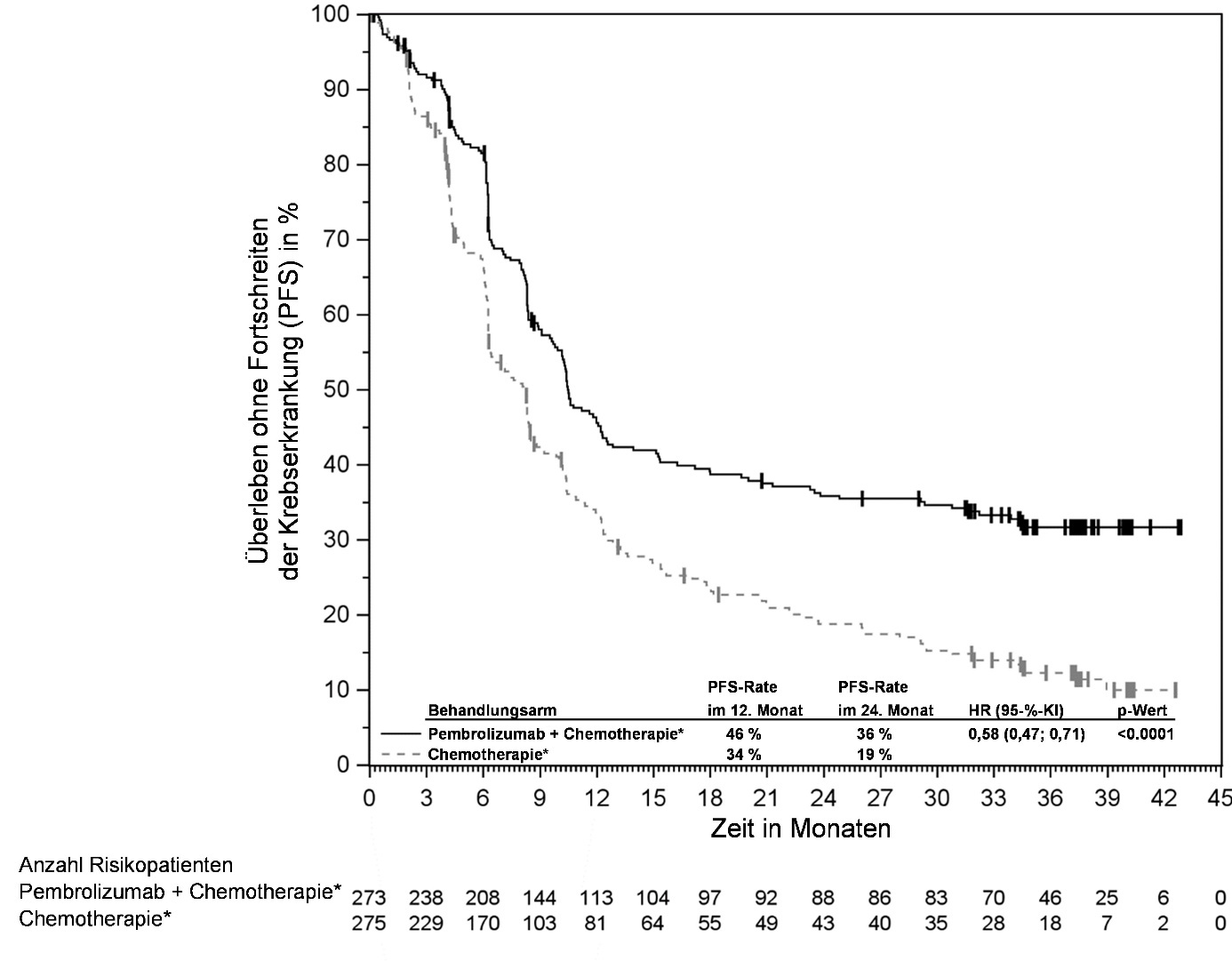
* Chemotherapie (Paclitaxel und Cisplatin oder Paclitaxel und Carboplatin) mit oder ohne Bevacizumab
Adenokarzinom des Magens oder des gastroösophagealen Übergangs (GEJ)
KEYNOTE‑811: Kontrollierte Studie einer Kombinationstherapie bei nicht-vorbehandelten Patienten mit lokal fortgeschrittenem, nicht resezierbarem oder metastasierendem HER2-positiven Adenokarzinom des Magens oder des gastroösophagealen Übergangs
Die Wirksamkeit von Pembrolizumab in Kombination mit Trastuzumab sowie einer Fluoropyrimidin- und Platin-basierten Chemotherapie wurde in KEYNOTE-811, einer multizentrischen, randomisierten, doppel-blinden, placebokontrollierten Studie, bei 698 Patienten mit HER2-positivem fortgeschrittenem Adenokarzinom des Magens oder des GEJ, ungeachtet des PD‑L1-Expressions-Status und ohne vorherige systemische Therapie der metastasierenden Erkrankung, untersucht. Patienten mit einer Autoimmunerkrankung, die innerhalb der letzten beiden Behandlungsjahre eine systemische Therapie erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen.
Die Randomisierung wurde stratifiziert nach PD‑L1-Expression (CPS ≥ 1 oder < 1), Chemotherapieregime (5-FU plus Cisplatin [FP] oder Capecitabin plus Oxaliplatin [CAPOX]) und geografischer Region (Europa/Israel/Nordamerika/Australien, Asien oder Rest der Welt). Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt; sämtliche Studienmedikationen, abgesehen von oralem Capecitabin, wurden als intravenöse Infusion in jedem dreiwöchigen Behandlungszyklus gegeben:
Pembrolizumab 200 mg, Trastuzumab 8 mg/kg als Erstinfusion und 6 mg/kg in den anschließenden Zyklen, gefolgt von einer Kombinationschemotherapie nach Maßgabe des Prüfarztes mit entweder Cisplatin 80 mg/m2 für bis zu 6 Zyklen und 5-FU 800 mg/m2/Tag für 5 Tage (FP) oder Oxaliplatin 130 mg/m2 für bis zu 6 – 8 Zyklen und Capecitabin 1 000 mg/m2 zweimal täglich für 14 Tage (CAPOX). Pembrolizumab wurde vor Trastuzumab und Chemotherapie am ersten Tag jedes Zyklus gegeben.
Placebo, Trastuzumab 8 mg/kg als Erstinfusion und 6 mg/kg in den anschließenden Zyklen, gefolgt von einer Kombinationschemotherapie nach Maßgabe des Prüfarztes mit entweder Cisplatin 80 mg/m2 für bis zu 6 Zyklen und 5-FU 800 mg/m2/Tag für 5 Tage (FP) oder Oxaliplatin 130 mg/m2 für bis zu 6 – 8 Zyklen und Capecitabin 1 000 mg/m2 zweimal täglich für 14 Tage (CAPOX). Placebo wurde vor Trastuzumab und Chemotherapie am ersten Tag jedes Zyklus gegeben.
Die Behandlung mit Pembrolizumab, Trastuzumab und Chemotherapie oder Placebo, Trastuzumab und Chemotherapie wurde bis zu einem mittels BICR gemäß RECIST‑v1.1-Kriterien definierten Fortschreiten der Erkrankung, bis zu einem Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Eine Bewertung des Tumorstatus wurde alle 6 Wochen durchgeführt.
Unter den 698 randomisierten Patienten in KEYNOTE‑811 waren 594 (85 %) Patienten mit mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmter PD‑L1-Tumorexpression von CPS ≥ 1. Die 594 Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 1 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 63 Jahre (Spanne: 19 bis 85 Jahre), 43 % waren 65 Jahre oder älter; 80 % waren Männer; 63 % waren kaukasischer, 33 % asiatischer und 0,7 % afrikanischer Herkunft; bei 42 % lag ein ECOG-PS von 0 und bei 58 % ein ECOG-PS von 1 vor. Bei 98 % der Patienten lag eine metastasierte (Stadium IV) und bei 2 % eine lokal fortgeschrittene inoperable Erkrankung vor. Fünfundneunzig Prozent (n = 562) hatten nicht-MSI-H-Tumoren, 1 % (n = 8) hatten MSI-H-Tumoren und bei 4 % (n = 24) war der Tumor-Status nicht bekannt. Fünfundachtzig Prozent der Patienten erhielten CAPOX.
Die primären Wirksamkeitsendpunkte waren das Überleben ohne Fortschreiten der Erkrankung (PFS) basierend auf BICR gemäß RECIST‑v1.1-Kriterien sowie das Gesamtüberleben (OS). Zu den sekundären Wirksamkeitsendpunkten gehörten die Objektive Ansprechrate (ORR) und die Dauer des Ansprechens basierend auf BICR gemäß RECIST‑v1.1-Kriterien. Bei der zweiten Interimsanalyse der Gesamtpopulation zeigte die Studie bei Patienten unter Pembrolizumab in Kombination mit Trastuzumab und Chemotherapie eine statistisch signifikante Verbesserung des PFS (HR 0,72; 95-%-KI: 0,60; 0,87; p‑Wert 0,0002) im Vergleich zu Patienten unter Placebo in Kombination mit Trastuzumab und Chemotherapie. In dieser Interimsanalyse gab es hinsichtlich des OS keinen statistisch signifikanten Unterschied. Die mediane Nachbeobachtungszeit betrug 15,4 Monate (Spanne: 0,3 bis 41,6 Monate). In der ersten Interimsanalyse, die mit den ersten 264 randomisierten Patienten der Gesamtpopulation (133 Patienten im Pembrolizumab-Arm und 131 im Placebo-Arm) durchgeführt wurde, wurde eine statistisch signifikante Verbesserung der ORR beobachtet (74,4 % vs. 51,9 %, entspricht einer Differenz von 22,7 % in der ORR; [95-%-KI: 11,2; 33,7]; p‑Wert 0,00006).
Tabelle 50 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte der präspezifizierten Subgruppe der Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 1 zum Zeitpunkt der zweiten Interimsanalyse. Die Kaplan-Meier-Kurven für PFS und OS sind in den Abbildungen 52 und 53 dargestellt.
Tabelle 50: Wirksamkeitsergebnisse in KEYNOTE-811 bei Patienten mit PD‑L1-Expression (CPS ≥ 1)
Endpunkt | Pembrolizumab | Placebo |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 199 (67 %) | 215 (73 %) |
Median in Monaten (95-%-KI) | 10,8 (8,5; 12,5) | 7,2 (6,8; 8,4) |
Hazard-Ratio* (95-%-KI) | 0,7 (0,58; 0,85) | |
p‑Wert† | 0,0001 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 167 (56 %) | 183 (62 %) |
Median in Monaten (95-%-KI) | 20,5 (18,2; 24,3) | 15,6 (13,5; 18,6) |
Hazard-Ratio* (95-%-KI) | 0,79 (0,64; 0,98) | |
p-Wert† | 0,0143 | |
Objektive Ansprechrate (ORR) | ||
ORR‡ % (95-%-KI) | 73 % (67,7; 78,1) | 58 % (52,6; 64,1) |
Vollständiges Ansprechen | 14 % | 10 % |
Partielles Ansprechen | 59 % | 49 % |
p-Wert# | 0,00008 | |
Dauer des Ansprechens | ||
Median in Monaten (Spanne) | 11,3 (1,1+; 40,1+) | 9,5 (1,4+; 38,3+) |
% mit einer Dauer ≥ 6 Monaten¶ | 75 % | 67 % |
% mit einer Dauer ≥ 12 Monaten¶ | 49 % | 41 % |
* Basierend auf dem unstratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 52: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE-811 bei Patienten mit PD‑L1-Expression (CPS ≥ 1)
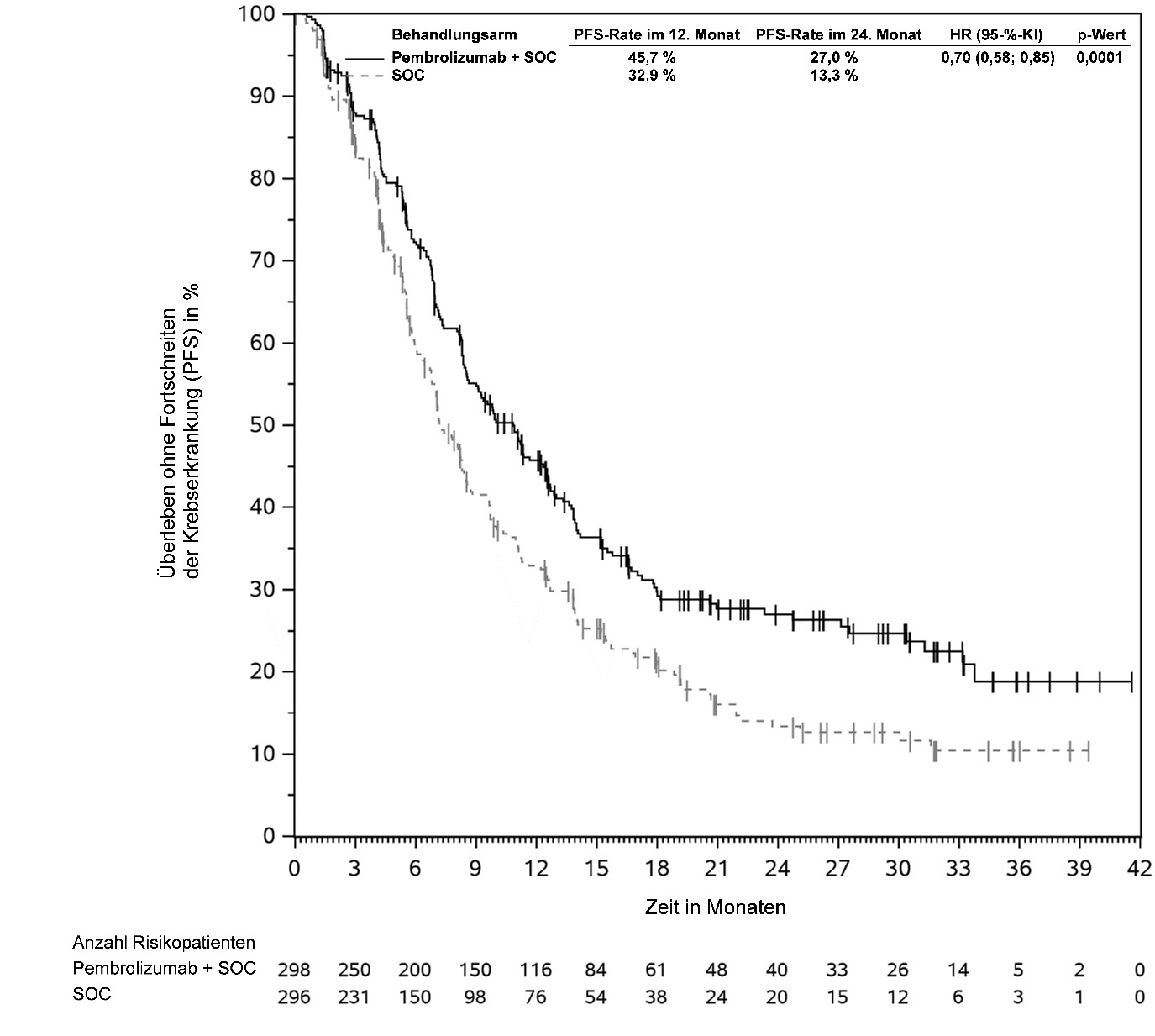
Abbildung 53: Kaplan-Meier-Kurve des Gesamtüberlebens nach Behandlungsarm in KEYNOTE-811 bei Patienten mit PD‑L1-Expression (CPS ≥ 1)
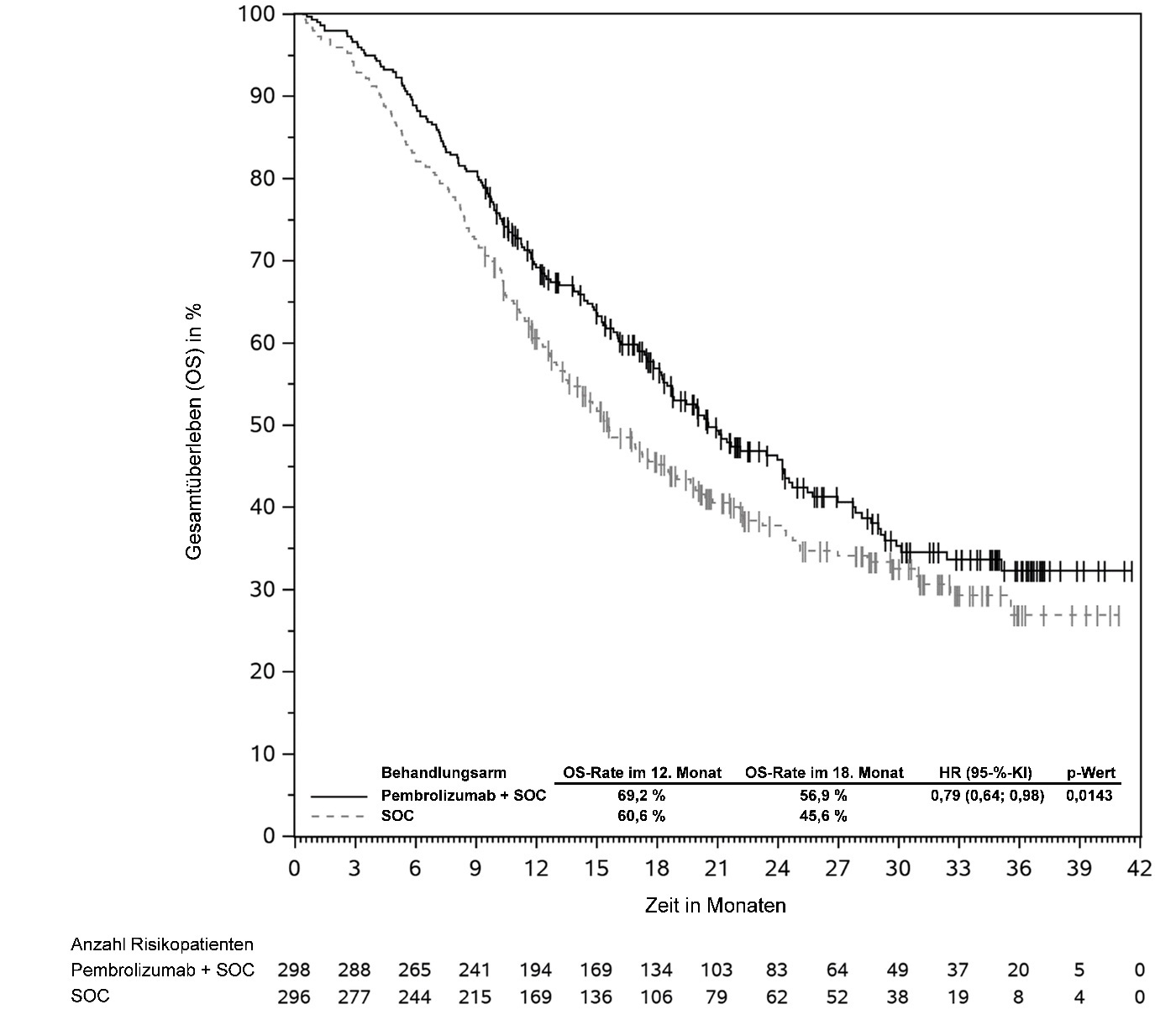
KEYNOTE-859: Kontrollierte Studie einer Kombinationstherapie bei nicht-vorbehandelten Patienten mit lokal fortgeschrittenem nicht resezierbarem oder metastasierendem HER2-negativem Adenokarzinom des Magens oder des gastroösophagealen Übergangs
Die Wirksamkeit von Pembrolizumab in Kombination mit einer Fluoropyrimidin- und Platin-basierten Chemotherapie wurde in KEYNOTE-859, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie mit 1 579 Patienten mit HER2-negativem fortgeschrittenem Adenokarzinom des Magens oder des GEJ, ungeachtet des PD-L1-Expressions-Status und ohne vorherige systemische Therapie der metastasierenden Erkrankung, untersucht. Eine vorhergehende neoadjuvante und/oder adjuvante Therapie war erlaubt, wenn diese mindestens 6 Monate vor Randomisierung abgeschlossen war. Patienten mit einer Autoimmunerkrankung, die innerhalb der letzten beiden Behandlungsjahre eine systemische Therapie erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, oder Patienten, die eine vorhergehende Behandlung mit Immuncheckpoint-Inhibitoren erhalten hatten, waren von der Studie ausgeschlossen.
Die Randomisierung wurde stratifiziert nach PD‑L1-Expression (CPS ≥ 1 oder < 1), Chemotherapieregime (5‑FU plus Cisplatin [FP] oder Capecitabin plus Oxaliplatin [CAPOX]) und geografischer Region (Europa/Israel/Nordamerika/Australien, Asien oder Rest der Welt).
Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt; sämtliche Studienmedikationen, abgesehen von oralem Capecitabin, wurden als intravenöse Infusion in jedem dreiwöchigen Behandlungszyklus gegeben:
Pembrolizumab 200 mg, Kombinationschemotherapie nach Maßgabe des Prüfarztes mit entweder Cisplatin 80 mg/m2 und 5‑FU 800 mg/m2/Tag für 5 Tage (FP) oder Oxaliplatin 130 mg/m2 und Capecitabin 1 000 mg/m2 zweimal täglich für 14 Tage (CAPOX) für bis zu 35 Zyklen. Die Dauer der Behandlung mit Cisplatin oder Oxaliplatin konnte, gemäß lokaler Richtlinien der Länder, auf 6 Zyklen begrenzt werden. Pembrolizumab wurde vor der Chemotherapie am ersten Tag jedes Zyklus gegeben.
Placebo, Kombinationschemotherapie nach Maßgabe des Prüfarztes mit entweder Cisplatin 80 mg/m2 und 5‑FU 800 mg/m2/Tag für 5 Tage (FP) oder Oxaliplatin 130 mg/m2 und Capecitabin 1 000 mg/m2 zweimal täglich für 14 Tage (CAPOX) für bis zu 35 Zyklen. Die Dauer der Behandlung mit Cisplatin oder Oxaliplatin konnte, gemäß lokaler Richtlinien der Länder, auf 6 Zyklen begrenzt werden. Placebo wurde vor der Chemotherapie am ersten Tag jedes Zyklus gegeben.
Die Behandlung mit Pembrolizumab und Chemotherapie oder Placebo und Chemotherapie wurde bis zu einem mittels BICR gemäß RECIST‑v1.1-Kriterien definierten Fortschreiten der Erkrankung, bis zu einem Auftreten unzumutbarer Toxizität oder bis zu einem Maximum von 24 Monaten fortgeführt. Die Beurteilung des Tumorstatus wurde alle 6 Wochen durchgeführt.
Unter den 1 579 Patienten in KEYNOTE‑859 waren 1 235 (78 %) Patienten mit mittels PD‑L1 IHC 22C3 pharmDxTM Kit bestimmter PD‑L1-Tumorexpression von CPS ≥ 1. Die 1 235 Patienten mit einer PD‑L1-Tumorexpression von CPS ≥ 1 waren zu Studienbeginn wie folgt charakterisiert: medianes Alter 62 Jahre (Spanne: 24 bis 86 Jahre), 40 % waren 65 Jahre oder älter; 70,4 % waren Männer; 55,5 % waren kaukasischer Herkunft; 33,1 % waren asiatischer Herkunft; 36,5 % wiesen einen ECOG-PS von 0 und 63,5 % einen ECOG-PS von 1 auf. Bei 96 % der Patienten lag eine metastasierte (Stadium IV) und bei 4 % eine lokal fortgeschrittene inoperable Erkrankung vor. 5 % (n = 66) hatten MSI‑H-Tumoren. 86 % der Patienten erhielten CAPOX.
Der primäre Wirksamkeitsendpunkt war das OS. Zu den weiteren sekundären Wirksamkeitsendpunkten gehörten PFS, ORR und die Dauer des Ansprechens, bewertet mittels BICR gemäß RECIST‑v1.1-Kriterien.
Die Studie zeigte eine statistisch signifikante Verbesserung des OS (HR 0,78; 95-%-KI: 0,70; 0,87; p‑Wert < 0,0001), PFS (HR 0,76; 95-%-KI: 0,67; 0,85; p‑Wert < 0,0001) und ORR (51 % [95-%-KI: 47,7; 54,8] vs. 42 % [95-%-KI: 38,5; 45,5]; p‑Wert 0,00009) in der Gesamtpopulation bei Patienten, die randomisiert Pembrolizumab in Kombination mit Chemotherapie erhielten, im Vergleich zu Placebo in Kombination mit Chemotherapie. Die mediane Nachbeobachtungszeit betrug 12 Monate (Spanne: 0,1 bis 45,9 Monate). Tabelle 51 fasst die wichtigsten Wirksamkeitsergebnisse für die präspezifizierte Subgruppe von Patienten zusammen, deren Tumoren PD‑L1 mit einem CPS ≥ 1 exprimierten. Die Kaplan-Meier-Kurven für OS und PFS sind in den Abbildungen 54 und 55 dargestellt.
Tabelle 51: Wirksamkeitsergebnisse in KEYNOTE-859 bei Patienten mit PD‑L1-Expression (CPS ≥ 1)
Endpunkt | Pembrolizumab | Placebo |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 464 (75 %) | 526 (85 %) |
Median in Monaten* (95-%-KI) | 13,0 (11,6; 14,2) | 11,4 (10,5; 12,0) |
Hazard-Ratio† (95-%-KI) | 0,74 (0,65; 0,84) | |
p‑Wert‡ | < 0,0001 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 443 (72 %) | 483 (78 %) |
Median in Monaten* (95-%-KI) | 6,9 (6,0; 7,2) | 5,6 (5,4; 5,7) |
Hazard-Ratio† (95-%-KI) | 0,72 (0,63; 0,82) | |
p‑Wert‡ | < 0,0001 | |
Objektive Ansprechrate (ORR) | ||
ORR§ % (95-%-KI) | 52 % (48,1; 56,1) | 43 % (38,7; 46,6) |
Vollständiges Ansprechen | 10 % | 6 % |
Partielles Ansprechen | 42 % | 37 % |
p‑Wert¶ | 0,00041 | |
Dauer des Ansprechens | ||
Median in Monaten* (Spanne) | 8,3 (1,2+; 41,5+) | 5,6 (1,3+; 34,2+) |
% mit einer Dauer ≥ 12 Monaten* | 41 % | 26 % |
* Basierend auf einer Kaplan-Meier-Schätzung | ||
Abbildung 54: Kaplan-Meier-Kurve des Gesamtüberlebens nach Behandlungsarm in KEYNOTE-859 bei Patienten mit PD‑L1-Expression (CPS ≥ 1)
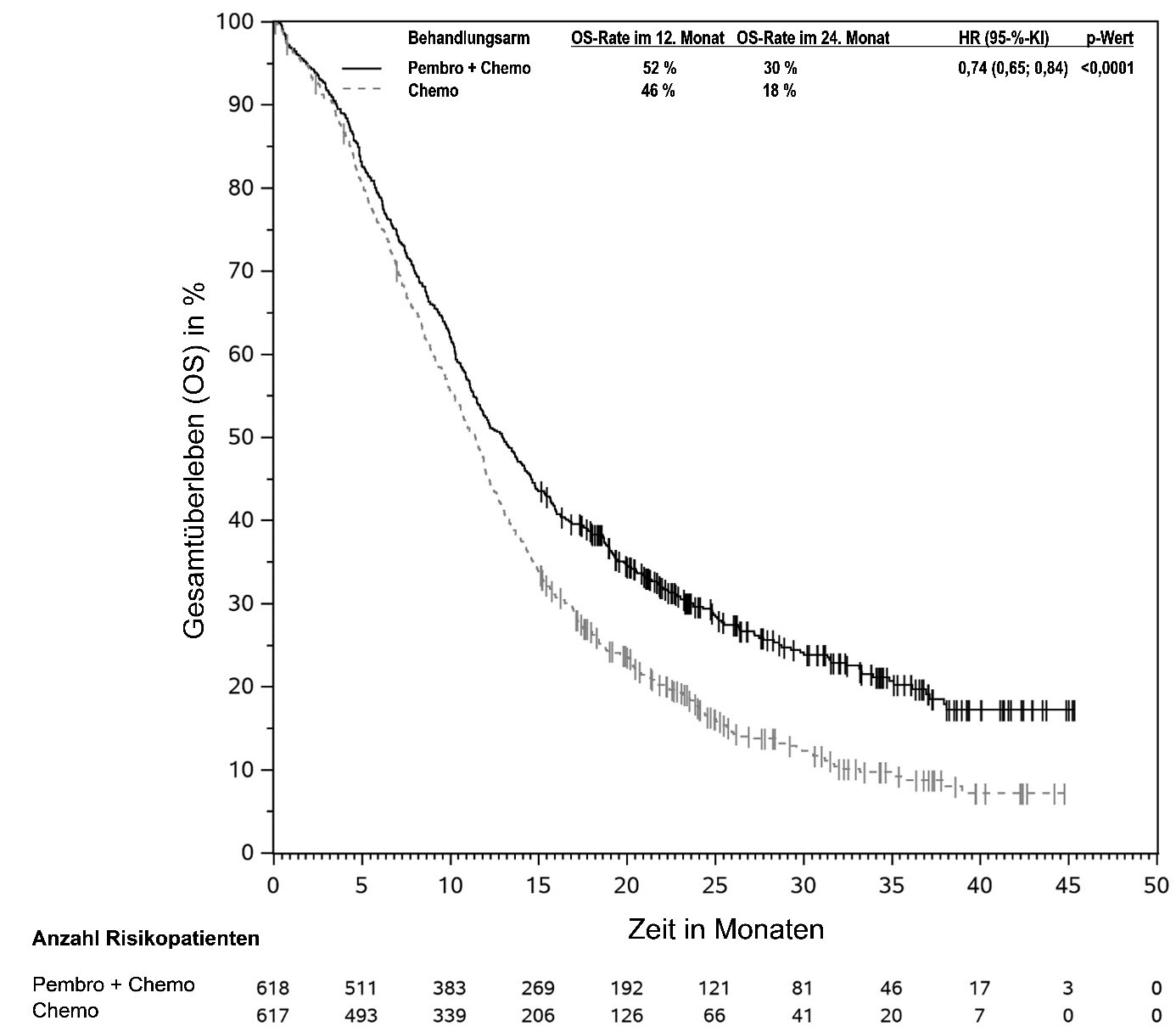
Abbildung 55: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE-859 bei Patienten mit PD‑L1-Expression (CPS ≥ 1)
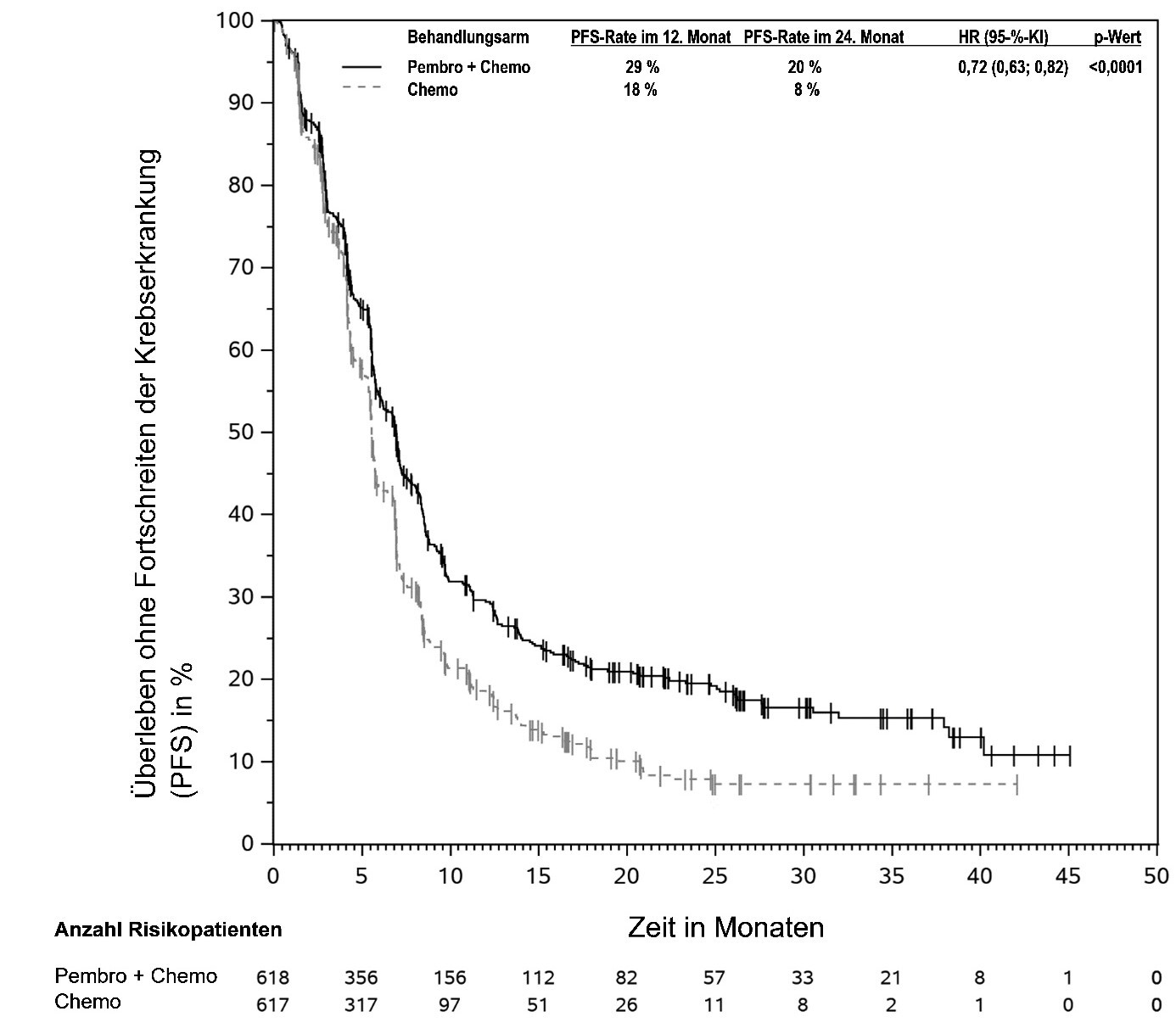
Tabelle 52: Wirksamkeitsergebnisse nach PD‑L1-Expression in KEYNOTE-859
Endpunkt | Pembrolizumab-Kombinationstherapie | Chemotherapie | Pembrolizumab-Kombinationstherapie | Chemotherapie |
n = 337 | n = 345 | n = 279 | n = 272 | |
CPS ≥ 1 bis < 10 | CPS ≥ 10 | |||
OS-HR (95-%-KI) | 0,83 (0,70; 0,98)* | 0,65 (0,53; 0,79)† | ||
PFS-HR (95-%-KI) | 0,83 (0,70; 0,99)* | 0,62 (0,51; 0,76)† | ||
ORR§ % (95-%-KI) | 45 % (39,7; 50,6) | 42 % (37,0; 47,7) | 61 % (54,6; 66,3) | 43 % (37,1; 49,1) |
* Hazard-Ratio (Pembrolizumab-Kombinationstherapie im Vergleich zu Chemotherapie) basierend auf dem unstratifizierten Cox-Proportional-Hazardmodell | ||||
Biliäres Karzinom
KEYNOTE-966: Kontrollierte Studie einer Kombinationstherapie bei Patienten mit lokal fortgeschrittenem nicht resezierbarem oder metastasierendem BTC
Die Wirksamkeit von Pembrolizumab in Kombination mit Gemcitabin und Cisplatin wurde in KEYNOTE-966, einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie mit 1 069 Patienten mit lokal fortgeschrittenem nicht resezierbarem oder metastasierendem BTC, die noch keine vorherige systemische Therapie im fortgeschrittenen Krankheitsstadium erhalten hatten, untersucht. Die Patienten wurden ungeachtet des PD‑L1-Tumor-Expressions-Status eingeschlossen. Die Patienten mussten vertretbare Bilirubinspiegel im Serum haben (≤ 1,5‑fachen ULN oder Bilirubin direkt ≤ ULN bei Studienteilnehmern mit Gesamtbilirubinspiegel > 1,5‑fachen ULN) und jede klinisch relevante biliäre Obstruktion musste vor der Randomisierung behoben werden. Patienten mit einer Autoimmunerkrankung, die innerhalb der letzten beiden Behandlungsjahre eine systemische Therapie erforderte, oder einer Erkrankung, die eine Immunsuppression erforderte, waren von der Studie ausgeschlossen. Die Randomisierung wurde nach geografischer Region (Asien vs. Nicht-Asien), lokal fortgeschritten versus metastasierend und dem Entstehungsort (Gallenblase, intrahepatisches oder extrahepatisches Cholangiokarzinom) stratifiziert.
Die Patienten wurden randomisiert (1:1) einem der beiden Behandlungsarme zugeteilt:
Pembrolizumab 200 mg an Tag 1 plus Gemcitabin 1 000 mg/m2 und Cisplatin 25 mg/m2 an Tag 1 und Tag 8 alle 3 Wochen
Placebo an Tag 1 plus Gemcitabin 1 000 mg/m2 und Cisplatin 25 mg/m2 an Tag 1 und Tag 8 alle 3 Wochen
Die Gabe der Studienmedikation erfolgte jeweils als intravenöse Infusion. Die Behandlung wurde bis zu einem Auftreten unzumutbarer Toxizität oder bis zu einem Fortschreiten der Erkrankung fortgeführt. Die Behandlung mit Pembrolizumab wurde bis zu einem Maximum von 35 Zyklen oder bis zu einer Dauer von circa 24 Monaten durchgeführt. Die Gabe von Cisplatin konnte bis zu einem Maximum von 8 Zyklen erfolgen und die Behandlung mit Gemcitabin konnte über 8 Zyklen hinaus fortgesetzt werden. Die Bewertung des Tumorstatus erfolgte zu Studienbeginn und danach alle 6 Wochen über 54 Wochen, im Anschluss daran alle 12 Wochen.
Die Studienpopulation war wie folgt charakterisiert: medianes Alter 64 Jahre (Spanne: 23 bis 85 Jahre); 47 % waren 65 Jahre oder älter; 52 % waren Männer; 49 % waren kaukasischer und 46 % asiatischer Herkunft; bei 46 % bzw. 54 % lag ein ECOG-Performance-Status von 0 bzw. 1 vor; 31 % der Patienten hatten Hepatitis‑B- und 3 % Hepatitis‑C-Infektionen in der Vorgeschichte.
Der primäre Wirksamkeitsendpunkt war das Gesamtüberleben (OS) und zu den sekundären Wirksamkeitsendpunkten gehörten das Überleben ohne Fortschreiten der Erkrankung (PFS), die Objektive Ansprechrate (ORR) sowie die Dauer des Ansprechens basierend auf BICR gemäß RECIST‑v1.1-Kriterien. Die Studie zeigte in der finalen Analyse eine statistisch signifikante Verbesserung des OS bei Patienten unter Pembrolizumab in Kombination mit Chemotherapie im Vergleich zu Patienten unter Placebo in Kombination mit Chemotherapie. Tabelle 53 enthält eine Zusammenfassung der entscheidenden Wirksamkeitsendpunkte und die Abbildungen 56 und 57 zeigen die Kaplan-Meier-Kurven für PFS und OS basierend auf der finalen Analyse mit einer medianen Nachbeobachtungszeit von 11,6 Monaten (Spanne: 0,2 bis 37,5 Monate).
Tabelle 53: Wirksamkeitsergebnisse in KEYNOTE-966
Endpunkt | Pembrolizumab | Placebo |
n = 533 | n = 536 | |
Gesamtüberleben (OS) | ||
Anzahl (%) Patienten mit Ereignis | 414 (78 %) | 443 (83 %) |
Median in Monaten (95-%-KI) | 12,7 (11,5; 13,6) | 10,9 (9,9; 11,6) |
Hazard-Ratio* (95-%-KI) | 0,83 (0,72; 0,95) | |
p-Wert† | 0,0034 | |
Überleben ohne Fortschreiten der Krebserkrankung (PFS) | ||
Anzahl (%) Patienten mit Ereignis | 428 (80 %) | 448 (84 %) |
Median in Monaten (95-%-KI) | 6,5 (5,7; 6,9) | 5,6 (4,9; 6,5) |
Hazard-Ratio* (95-%-KI) | 0,87 (0,76; 0,99) | |
p‑Wert‡ | 0,0171 | |
Objektive Ansprechrate (ORR) | ||
ORR % (95-%-KI) | 29,3 % (25,4; 33,3) | 28,4 % (24,6; 32,4) |
Vollständiges Ansprechen | 2,6 % | 1,7 % |
Partielles Ansprechen | 26,6 % | 26,7 % |
p-Wertα | 0,3610 | |
Dauer des Ansprechens§, ¶ | ||
Median in Monaten (Spanne) | 8,3 (1,2+; 33,0+) | 6,8 (1,1+; 30,0+) |
% mit einer Dauer ≥ 6 Monaten¶ | 65 % | 55 % |
% mit einer Dauer ≥ 12 Monaten¶ | 38 % | 27 % |
* Basierend auf dem stratifizierten Cox-Proportional-Hazardmodell | ||
Abbildung 56: Kaplan-Meier-Kurve des Gesamtüberlebens (OS) nach Behandlungsarm in KEYNOTE‑966 (Intent-to-Treat-Population)
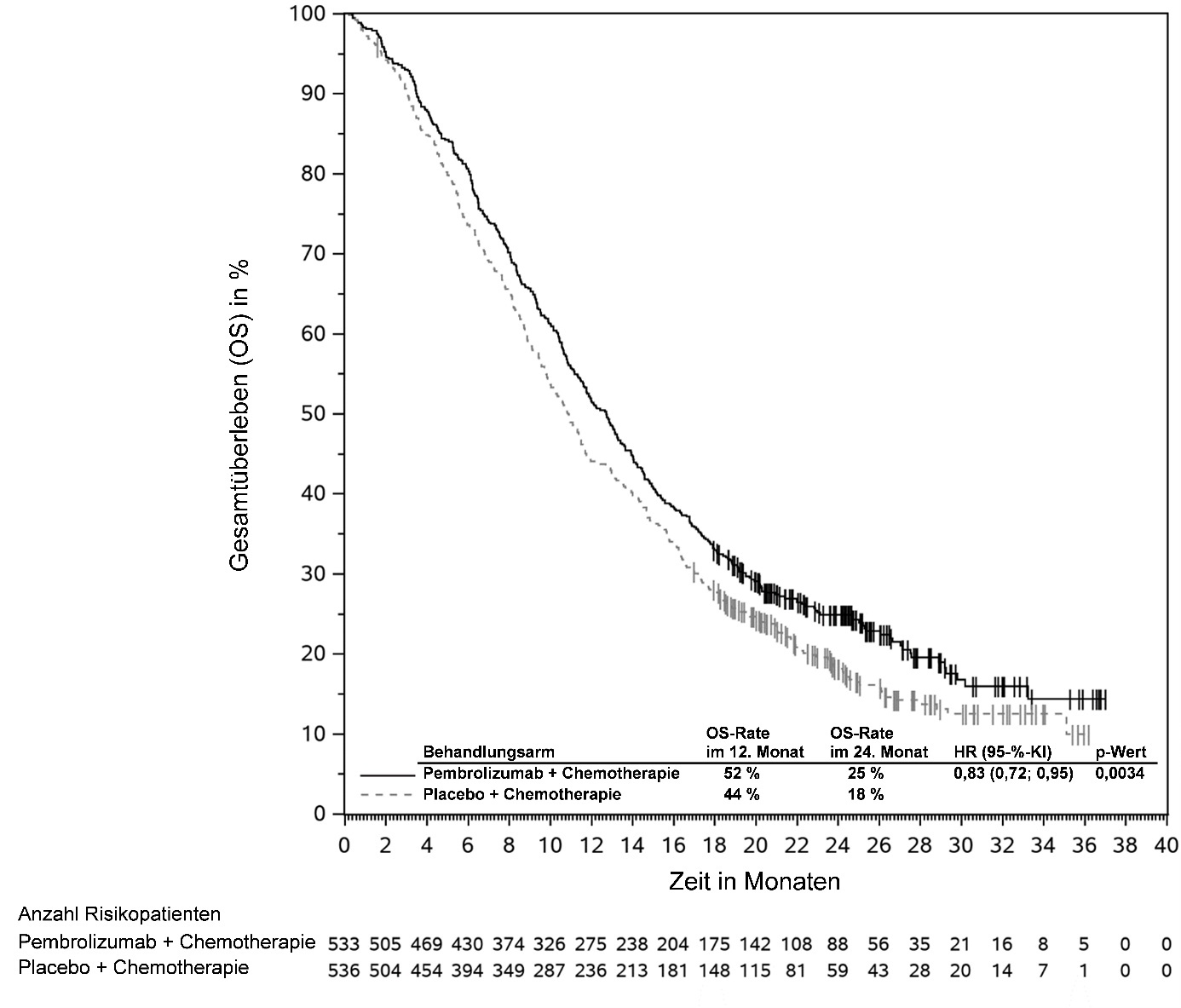
Abbildung 57: Kaplan-Meier-Kurve des Überlebens ohne Fortschreiten der Krebserkrankung (PFS) nach Behandlungsarm in KEYNOTE‑966 (Intent-to-Treat-Population)
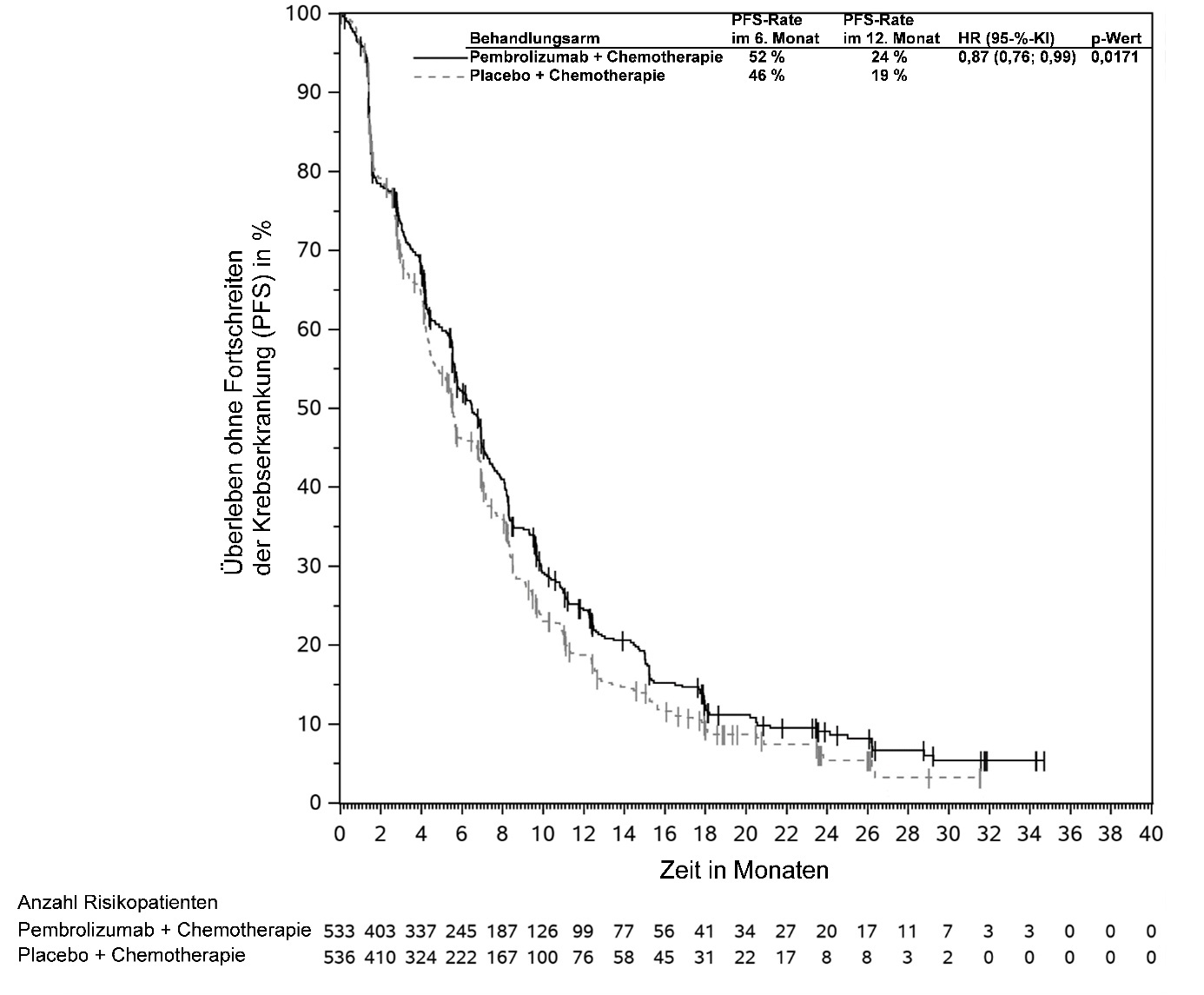
Ältere Patienten
Insgesamt wurden hinsichtlich Sicherheit keine Unterschiede bei Patienten ≥ 75 Jahre im Vergleich zu jüngeren Patienten unter Pembrolizumab-Monotherapie beobachtet. Basierend auf begrenzten Sicherheitsdaten von Patienten ≥ 75 Jahre zeigte Pembrolizumab bei Anwendung in Kombination mit Chemotherapie eine geringere Verträglichkeit bei Patienten ≥ 75 Jahre im Vergleich zu jüngeren Patienten. Daten hinsichtlich Wirksamkeit bei Patienten ≥ 75 Jahre finden Sie im entsprechenden Abschnitt der jeweiligen Indikation.
Kinder und Jugendliche
In KEYNOTE‑051 wurde 161 Kindern und Jugendlichen (62 Kinder im Alter von 9 Monaten bis < 12 Jahren und 99 Jugendliche zwischen 12 und 17 Jahren) mit fortgeschrittenem Melanom oder PD‑L1-positiven fortgeschrittenen, rezidivierenden oder refraktären soliden Tumoren oder Lymphom Pembrolizumab in einer Dosierung von 2 mg/kg KG alle 3 Wochen gegeben. Alle Patienten erhielten im Median 4 Dosen (Spanne: 1 – 35 Dosen) Pembrolizumab, dabei erhielten 138 Patienten (85,7 %) 2 oder mehr Dosen Pembrolizumab. Studienteilnehmer wurden gemäß Primärdiagnose über 28 Tumorarten hinweg eingeschlossen. Die häufigsten Tumorarten nach Histologie waren Hodgkin-Lymphom (13,7 %), Glioblastoma multiforme (9,3 %), Neuroblastom (6,2 %), Osteosarkom (6,2 %) und Melanom (5,6 %). Von den 161 eingeschlossenen Patienten hatten 137 solide Tumoren, 22 Patienten hatten Hodgkin-Lymphom und 2 Patienten hatten andere Lymphomarten. Die Objektive Ansprechrate (ORR) bei Patienten mit soliden Tumoren und anderen Lymphomarten lag bei 5,8 %, kein Patient hatte vollständiges Ansprechen und 8 (5,8 %) Patienten hatten partielles Ansprechen. In der Population mit Hodgkin-Lymphom (n = 22) waren die Patienten zwischen 11 und 17 Jahren zu Studienbeginn wie folgt charakterisiert: medianes Alter 15 Jahre; 64 % waren Jungen/Männer, 68 % waren kaukasischer Herkunft, bei 77 % lag der Lansky/Karnofsky-Index bei 90 – 100 und bei 23 % bei 70 – 80. 86 % der Patienten hatten zwei oder mehr vorhergehende Therapielinien und 64 % befanden sich im Erkrankungsstadium-III oder höher. Bei den Kindern und Jugendlichen mit klassischem HL lag die ORR bewertet mittels BICR entsprechend der IWG-2007-Kriterien bei 54,5 %, 1 (4,5 %) Patient zeigte vollständiges Ansprechen und 11 (50,0 %) Patienten zeigten partielles Ansprechen; die ORR bewertet mittels Lugano-2014-Kriterien lag bei 63,6 %, 4 Patienten (18,2 %) zeigten vollständiges Ansprechen und 10 Patienten (45,5 %) zeigten partielles Ansprechen. Die Daten aus klinischen Studien mit Melanompatienten im Kindes-/Jugendalter sind sehr begrenzt und die Wirksamkeit wurde durch Extrapolation aus Daten von Erwachsenen ermittelt. Unter den 5 Studienteilnehmern im Kindes-/Jugendalter mit fortgeschrittenem Melanom, die in KEYNOTE-051 behandelt wurden, zeigte kein Patient vollständiges oder partielles Ansprechen und 1 Patient wies eine stabile Erkrankung auf.
Die Europäische Arzneimittel-Agentur hat für Pembrolizumab eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen in der Behandlung von Hodgkin-Lymphom gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Pharmakokinetik von Pembrolizumab wurde bei 2 993 Patienten mit metastasierendem oder nicht resezierbarem Melanom, NSCLC oder Karzinom im Dosisbereich von 1 bis 10 mg/kg KG alle 2 Wochen, 2 bis 10 mg/kg KG alle 3 Wochen oder 200 mg alle 3 Wochen untersucht.
Resorption
Pembrolizumab wird intravenös gegeben und ist daher sofort und vollständig bioverfügbar.
Verteilung
In Übereinstimmung mit einer begrenzten extravaskulären Verteilung ist das Verteilungsvolumen von Pembrolizumab im Steady State gering (~6,0 l; CV: 20 %). Wie bei Antikörpern erwartet, bindet Pembrolizumab nicht spezifisch an Plasmaproteine.
Biotransformation
Pembrolizumab wird über unspezifische Stoffwechselwege abgebaut; der Metabolismus trägt nicht zur Ausscheidung bei.
Elimination
Die Ausscheidung von Pembrolizumab ist nach Erreichen der maximalen Änderung bei Steady State annähernd 23 % geringer (geometrischer Mittelwert, 195 ml/Tag [CV %: 40 %]) im Vergleich zur Initialdosis (252 ml/Tag [CV %: 37 %]); diese Verringerung der Ausscheidung im Laufe der Zeit wird als nicht klinisch relevant betrachtet. Der geometrische Mittelwert (CV %) der terminalen Halbwertszeit beträgt 22 Tage (32 %) bei Steady State.
Linearität/Nicht-Linearität
Die Exposition von Pembrolizumab angegeben durch die Spitzenkonzentration (Cmax) oder als Fläche unter der Plasma-Konzentrationszeitkurve (AUC) nahm dosisproportional innerhalb des wirksamen Dosisbereichs zu. Steady-State-Konzentrationen von Pembrolizumab wurden bei wiederholter Gabe alle 3 Wochen nach 16 Wochen erreicht und die systemische Akkumulation betrug das 2,1-Fache. Die medianen Talspiegel (Cmin) bei Steady State entsprachen in etwa 22 Mikrogramm/ml bei einer Dosierung von 2 mg/kg KG alle 3 Wochen und 29 Mikrogramm/ml bei einer Dosierung von 200 mg alle 3 Wochen. Die mediane Fläche unter der Konzentrationszeitkurve bei Steady State über 3 Wochen (AUC0 – 3 Wochen) betrug 794 Mikrogramm•Tag/ml bei einer Dosierung von 2 mg/kg KG alle 3 Wochen und 1 053 Mikrogramm•Tag/ml bei einer Dosierung von 200 mg alle 3 Wochen.
Nach Gabe von 200 mg Pembrolizumab alle 3 Wochen wurden bei Patienten mit klassischem HL bis zu 40 % höhere mediane Steady-State-Talspiegel (Cmin) beobachtet, als bei anderen, mit derselben Dosierung behandelten Tumorarten; die Spanne der Talspiegel ist jedoch ähnlich. Es gibt keine bemerkenswerten Unterschiede bei den medianen Spitzenkonzentrationen (Cmax) zwischen klassischem HL und anderen Tumorarten. Basierend auf verfügbaren Sicherheitsdaten bei klassischem HL und anderen Tumorarten sind diese Unterschiede klinisch nicht bedeutsam.
Besondere Patientengruppen
Die Auswirkung verschiedener Parameter auf die Pharmakokinetik von Pembrolizumab wurde in populationsbezogenen pharmakokinetischen Analysen bewertet. Folgende Faktoren hatten keinen klinisch bedeutsamen Effekt auf die Ausscheidung von Pembrolizumab: Alter (Spanne: 15 – 94 Jahre), Geschlecht, ethnische Herkunft, leichte oder moderate Einschränkung der Nierenfunktion, leichte oder moderate Einschränkung der Leberfunktion sowie Tumorlast. Der Zusammenhang zwischen Körpergewicht und Ausscheidung unterstützt sowohl die Anwendung einer fixen Dosierung als auch einer gewichtsbasierten Dosierung, die beide eine angemessene und vergleichbare Kontrolle der Exposition liefern. Bei einer gewichtsbasierten Dosierung von 2 mg/kg KG alle 3 Wochen sind die Pembrolizumab-Expositionen bei Kindern und Jugendlichen (≥ 3 bis 17 Jahre) und erwachsenen Patienten bei gleicher Dosis vergleichbar.
Einschränkung der Nierenfunktion
Die Auswirkung einer eingeschränkten Nierenfunktion auf die Ausscheidung von Pembrolizumab wurde in populationsbezogenen pharmakokinetischen Analysen bei Patienten mit leichter oder moderater Einschränkung der Nierenfunktion im Vergleich zu Patienten mit normaler Nierenfunktion untersucht. Es wurden keine klinisch bedeutsamen Unterschiede in der Ausscheidung von Pembrolizumab bei Patienten mit leichter oder moderater Einschränkung der Nierenfunktion im Vergleich zu Patienten mit normaler Nierenfunktion festgestellt. Pembrolizumab wurde nicht bei Patienten mit schwerer Einschränkung der Nierenfunktion untersucht (siehe Abschnitt 4.2).
Einschränkung der Leberfunktion
Die Auswirkung einer eingeschränkten Leberfunktion auf die Ausscheidung von Pembrolizumab wurde in populationsbezogenen pharmakokinetischen Analysen bei Patienten mit leichter und moderater Einschränkung der Leberfunktion (definiert nach den Kriterien des US-amerikanischen Instituts für Krebserkrankungen „US National Cancer Institute“ (NCI) für Leberfunktionsstörungen) im Vergleich zu Patienten mit normaler Leberfunktion untersucht. Es wurden keine klinisch bedeutsamen Unterschiede in der Ausscheidung von Pembrolizumab bei Patienten mit leichter oder moderater Einschränkung der Leberfunktion im Vergleich zu Patienten mit normaler Leberfunktion festgestellt. Pembrolizumab wurde nicht bei Patienten mit schwerer Einschränkung der Leberfunktion untersucht (siehe Abschnitt 4.2).
Die Sicherheit von Pembrolizumab wurde in einer 1-Monats- und einer 6-Monats-Studie zur Toxizität bei wiederholter Gabe bei Affen der Gattung Cynomolgus untersucht. Diesen wurden intravenöse Dosen von 6, 40 oder 200 mg/kg KG einmal die Woche in der 1-Monatsstudie und einmal alle 2 Wochen in der 6-Monatsstudie verabreicht, gefolgt von einer 4-monatigen behandlungsfreien Zeit. Es wurden keine toxikologisch relevanten Ergebnisse beobachtet und die höchste nebenwirkungsfreie Konzentration, der „No Observed Adverse Effect Level (NOAEL)“, lag in beiden Studien bei ≥ 200 mg/kg KG, was einer 19‑fachen beziehungsweise einer 94‑fachen Exposition im Vergleich zu Dosen von 10 mg/kg KG beziehungsweise 2 mg/kg KG beim Menschen entsprach. Die höchste nebenwirkungsfreie Konzentration „NOAEL“ entsprach der 74‑fachen Exposition einer Dosis von 200 mg beim Menschen.
Tierstudien zur Reproduktion wurden mit Pembrolizumab nicht durchgeführt. Man vermutet, dass der PD‑1/PD‑L1-Signalweg beteiligt ist, die Immuntoleranz gegen den Fötus während der Schwangerschaft aufrechtzuerhalten. Eine Blockade des PD‑L1-Signalwegs zeigte bei trächtigen Mäusen eine Störung der Toleranz gegen den Fötus und eine Erhöhung der Abortrate.
Studien zur Fertilität bei Tieren wurden mit Pembrolizumab nicht durchgeführt. In einer 1-Monats- und einer 6-Monats-Studie zur Toxizität bei wiederholter Gabe bei Affen wurden keine bedeutsamen Effekte auf die männlichen und weiblichen Fortpflanzungsorgane beobachtet; in diesen Studien waren jedoch viele Tiere nicht geschlechtsreif.
L-Histidin
L-Histidinhydrochlorid-Monohydrat
Saccharose
Polysorbat 80 (E 433)
Wasser für Injektionszwecke
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden, außer mit den unter Abschnitt 6.6 aufgeführten.
Ungeöffnete Durchstechflasche
2 Jahre.
Nach Zubereitung der Infusion
Chemische und physikalische Stabilität der verdünnten Lösung wurde für bis zu 42 Tage bei 2 °C bis 8 °C bzw. 23 °C bis 27 °C nachgewiesen.
Aus mikrobiologischer Sicht sollte das Produkt, sobald es verdünnt ist, umgehend verwendet werden. Die verdünnte Lösung darf nicht eingefroren werden. Falls die Lösung nicht umgehend verwendet wird, liegen die Aufbewahrungsdauer und ‑bedingungen vor der Anwendung in der Verantwortung des Anwenders und sollten normalerweise 7 Tage bei 2 °C bis 8 °C bzw. 12 Stunden bei Raumtemperatur nicht überschreiten, es sei denn, die Verdünnung wurde unter kontrollierten und validierten aseptischen Bedingungen hergestellt. Nach Aufbewahrung im Kühlschrank müssen die Durchstechflaschen und/oder Infusionsbeutel vor der Anwendung Raumtemperatur annehmen.
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
4 ml Konzentrat in einer klaren 10‑ml-Typ-I-Glas-Durchstechflasche mit einem beschichteten grauen Chlorobutyl- oder Bromobutylstopfen und einem Aluminiumsiegel mit einer dunkelblauen Schutzkappe enthalten 100 mg Pembrolizumab.
Packungsgrößen: Eine oder zwei Durchstechflaschen pro Karton.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Zubereitung und Anwendung der Infusion
Die Durchstechflasche nicht schütteln.
Lassen Sie die Durchstechflasche Raumtemperatur annehmen (Temperaturen bei oder unter 25 °C).
Vor Verdünnung kann die Durchstechflasche mit der Flüssigkeit bis zu 24 Stunden außerhalb des Kühlschranks (Temperaturen bei oder unter 25 °C) aufbewahrt werden.
Parenterale Arzneimittel sind vor der Infusion auf sichtbare Partikel und Verfärbung zu prüfen. Das Konzentrat ist eine klare bis leicht opaleszente, farblose bis schwach gelbliche Lösung. Verwerfen Sie den Inhalt samt Durchstechflasche, wenn Sie Partikel beobachten.
Entnehmen Sie das benötigte Volumen von bis zu 4 ml (100 mg) Konzentrat und überführen Sie dieses in einen Infusionsbeutel mit Natriumchloridlösung 9 mg/ml (0,9 %) oder Glucoselösung 50 mg/ml (5 %), um eine verdünnte Lösung mit einer Endkonzentration von 1 bis 10 mg/ml herzustellen. Jede Durchstechflasche enthält einen Überschuss von 0,25 ml (Gesamtinhalt 4,25 ml pro Durchstechflasche), um die Entnahme von 4 ml Konzentrat pro Durchstechflasche sicherzustellen. Die verdünnte Lösung durch vorsichtiges Umdrehen mischen.
Nach Aufbewahrung im Kühlschrank müssen die Durchstechflaschen und/oder Infusionsbeutel vor der Anwendung Raumtemperatur annehmen. In der verdünnten Lösung können transluzente bis weiße proteinartige Partikel zu sehen sein. Die Infusionslösung sollte intravenös über 30 Minuten gegeben werden unter Anwendung eines sterilen, pyrogenfreien 0,2 bis 5 Mikrometer In-line- oder Add-On-Filters mit geringer Proteinbindung.
Andere Arzneimittel dürfen nicht über dieselbe Infusionsleitung gegeben werden.
KEYTRUDA ist nur zur einmaligen Anwendung. Nicht benötigte Reste in der Durchstechflasche sind zu verwerfen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Merck Sharp & Dohme B.V.
Waarderweg 39
2031 BN Haarlem
Niederlande
EU/1/15/1024/002
EU/1/15/1024/003
Datum der Erteilung der Zulassung: 17. Juli 2015
Datum der letzten Verlängerung der Zulassung: 24. März 2020
Juni 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu/ verfügbar.
Verschreibungspflichtig
Für weitere Informationen zu diesem Präparat wenden Sie sich bitte an die deutsche Vertretung des Zulassungsinhabers:
MSD Sharp & Dohme GmbH
Levelingstr. 4a
81673 München
Tel.: +49 (0) 89 20 300 4500
E-Mail: medinfo@msd.de
KEY-GPC-25 mg/ml-2025 06/PSUSA-202409
RCN: 000028018-DE
FACH-9000240-0052