Otriven gegen Schnupfen 0,025 % Nasentropfen
Für Säuglinge und Kleinkinder unter 2 Jahren
Xylometazolinhydrochlorid 0,25 mg/ml
Nasentropfen, Lösung
1 ml Lösung enthält 0,25 mg Xylometazolinhydrochlorid.
Ein Tropfen zu 0,023 ml Lösung enthält 0,006 mg Xylometazolinhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung:
Enthält 0,0023 mg Benzalkoniumchlorid pro Tropfen, entsprechend 0,1 mg/ml Lösung.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Nasentropfen, Lösung.
Klare, farblose Lösung.
Entzündungszustände der Schleimhäute im Nasen-Rachen-Raum (z. B. Schnupfen; zur Erleichterung des Sekretabflusses bei Nasennebenhöhlenentzündung; bei Tubenmittelohrkatarrh).
Otriven gegen Schnupfen 0,025 % Nasentropfen sind für Säuglinge und Kleinkinder unter 2 Jahren bestimmt.
Otriven gegen Schnupfen 0,025 % Nasentropfen sind zur Anwendung bei Säuglingen unter einem Jahr nur auf ärztlichen Rat hin vorgesehen. Bei Säuglingen und Kleinkindern unter 2 Jahren ist das Arzneimittel nur von Erwachsenen zu verabreichen.
Dosierung
Säuglinge und Kleinkinder unter 2 Jahren: 1 Tropfen in jedes Nasenloch, 2 – 3‑mal täglich (alle 8 bis 10 Stunden) ist grundsätzlich ausreichend. Eine 3‑malige Anwendung pro Tag und Nasenloch ist nicht zu überschreiten.
Otriven gegen Schnupfen 0,025 % Nasentropfen dürfen nicht länger als 7 Tage nacheinander angewendet werden.
Die empfohlene Dosierung darf nicht überschritten werden.
Bei untergewichtigen Säuglingen und Frühgeborenen darf die Dosierung nur nach Anordnung eines Arztes erfolgen.
Art der Anwendung
Zur nasalen Anwendung.
Vorbereitung des Tropfers:
Vor der ersten Anwendung muss der Tropfer vorbereitet werden. Die zu verabreichende Tropfenmenge ist mit nur 23 Mikroliter (μl) sehr gering, weshalb mehrere Pumpvorgänge nötig sind, bis die Pumpe vollständig gefüllt und die entsprechende Tropfengröße erreicht ist.
Hierzu ist die Flaschenöffnung nach unten zu richten und durch Druck auf die Fingerauflage zu pumpen bis ein Tropfen austritt. Nach weiteren 7 Pumpstößen ist der Tropfer einsatzbereit.
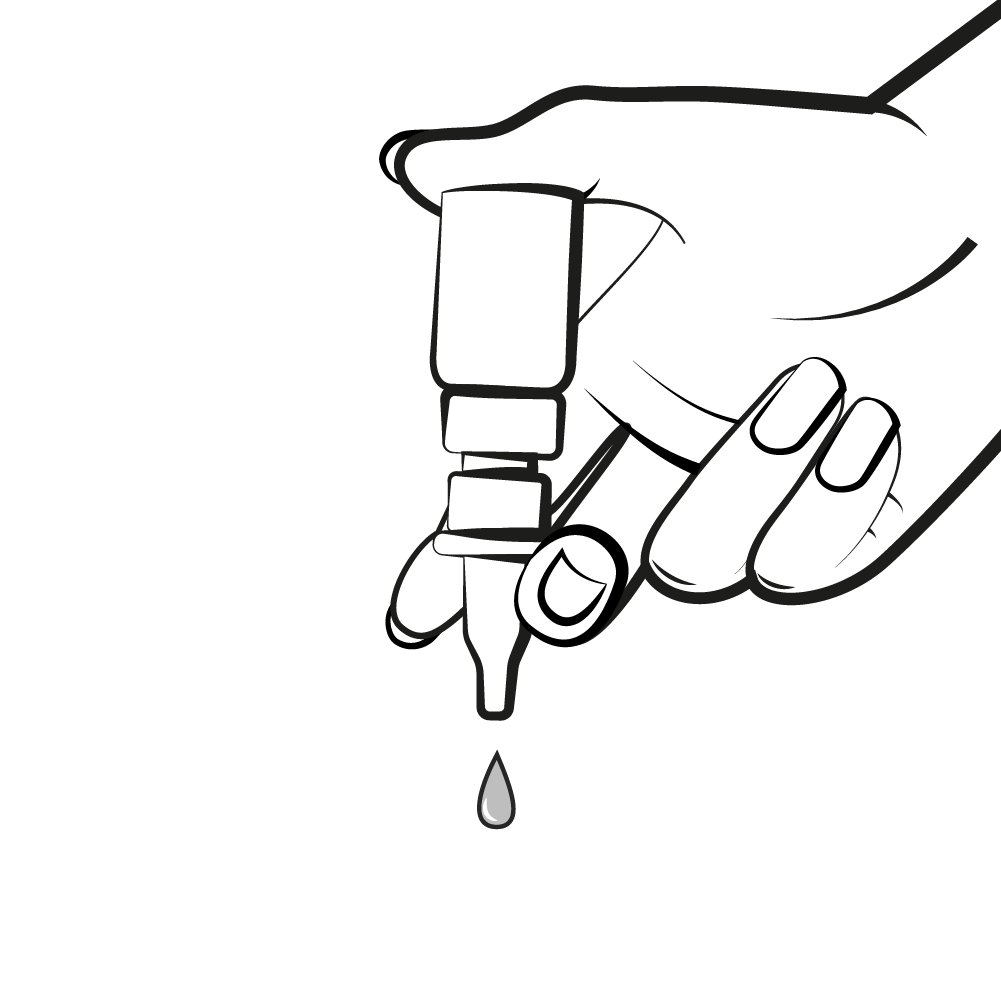
Bei den weiteren Anwendungen ist der Tropfer sofort gebrauchsfertig. Wenn das Arzneimittel 1 Woche nicht angewendet wurde, muss der Tropfer mit 4 Pumpstößen aktiviert werden.
1. Vor der Anwendung die Nase des Kindes gründlich reinigen. |
2. Die Anwendung sollte beim liegenden Kind mit leicht zur Seite geneigtem Kopf erfolgen. Hierbei den Tropfer direkt vor das untere Nasenloch halten und 1 Tropfen einträufeln. Es sollte vermieden werden, den Tropfer in das Nasenloch einzuführen. Danach den Tropfen kurz einwirken lassen. |
|
3. Zur Behandlung des anderen Nasenloches den Kopf des Kindes leicht zur anderen Seite drehen und den Vorgang an dem jetzt unteren Nasenloch wiederholen. |
|
4. Tropfer nach Gebrauch mit einem sauberen Tuch reinigen und Schutzkappe wider auf die Fläsche aufsetzen |
Die letzte Anwendung des Tages sollte möglichst vor dem Zubettgehen erfolgen.
Aus hygienischen Gründen und zur Vermeidung von Infektionen wird darauf hingewiesen, dass jede Dosiereinheit immer nur für einen Patienten verwendet werden darf.
|
|
|
|
Otriven gegen Schnupfen 0,025 % Nasentropfen sollten, wie auch andere Sympathomimetika, mit Vorsicht angewendet werden bei Patienten mit einer starken Reaktion auf adrenerge Substanzen, was sich durch Anzeichen von Schlaflosigkeit, Schwindel, Tremor, Herzrhythmusstörungen oder erhöhtem Blutdruck äußern kann.
Otriven gegen Schnupfen 0,025 % Nasentropfen dürfen nur mit Vorsicht angewendet werden bei Patienten mit:
|
|
|
|
|
Patienten mit Long-QT-Syndrom, die mit Xylometazolin behandelt werden, haben möglicherweise ein erhöhtes Risiko für schwere ventrikuläre Arrhythmien.
Wie auch andere topische Vasokonstriktoren dürfen Otriven gegen Schnupfen 0,025 % Nasentropfen nicht länger als 7 Tage angewendet werden. Eine langfristige Anwendung oder übermäßiger Gebrauch kann zu einer chronischen Schwellung (Rhinitis medicamentosa) und/oder Atrophie der Nasenschleimhaut führen.
Benzalkoniumchlorid kann eine Reizung oder Schwellung der Nasenschleimhaut hervorrufen, insbesondere bei längerer Anwendung.
Kinder
Bei Säuglingen unter einem Jahr wird die Anwendung nur auf ärztlichen Rat hin empfohlen.
Neugeborene und junge Säuglinge sollten mit besonderer Vorsicht behandelt werden. Es gibt einzelne Berichte zu schweren Nebenwirkungen (insbesondere Apnoe) bei Anwendung therapeutischer Dosen in dieser Altersgruppe. Dosisüberschreitungen sind unbedingt zu vermeiden.
Die kombinierte Anwendung von Xylometazolin mit Monoaminooxidase-Hemmern (MAO-Hemmern) oder tri- und tetrazyklischen Antidepressiva kann aufgrund der kardiovaskulären Wirkung dieser Substanzen zu einer Blutdruckerhöhung führen (siehe Abschnitt 4.4).
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen (weniger als 300 Schwangerschaftsausgänge) mit der Anwendung von Xylometazolin bei Schwangeren vor.
Tierexperimentelle Studien haben Reproduktionstoxizität gezeigt (siehe 5.3).
In Anbetracht eines potenziellen systemischen Vasokonstriktoreffektes ist es nicht empfehlenswert, Otriven gegen Schnupfen 0,025 % Nasentropfen während der Schwangerschaft anzuwenden.
Stillzeit
Eine Anwendung von Otriven gegen Schnupfen 0,025 % Nasentropfen in der Stillzeit sollte unterbleiben, da nicht bekannt ist, ob der Wirkstoff Xylometazolin in die Muttermilch übergeht.
Fertilität
Es liegen keine ausreichenden Daten zu den Auswirkungen von Xylometazolin auf die menschliche Fertilität vor.
Otriven gegen Schnupfen 0,025 % Nasentropfen haben keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig | (≥ 1/10) |
Häufig | (≥ 1/100 bis < 1/10) |
Gelegentlich | (≥ 1/1.000 bis < 1/100) |
Selten | (≥ 1/10.000 bis < 1/1.000) |
Sehr selten | (< 1/10.000) |
Nicht bekannt | (Häufigkeit auf Grundlage der verfügabren Daten nicht abschätzbar) |
Erkrankungen des Immunsystems
Sehr selten: Überempfindlichkeitsreaktionen (Angioödem, Hautausschlag, Juckreiz).
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Sehr selten: Unruhe, Schlaflosigkeit, Müdigkeit (Schläfrigkeit, Sedierung), Halluzinationen (vorrangig bei Kindern).
Augenerkrankungen:
Sehr selten: Vorübergehende Sehstörungen.
Herzerkrankungen
Selten: Herzklopfen, Tachykardie, Hypertonie.
Sehr selten: Unregelmäßige Herzfrequenz, erhöhte Herzfrequenz.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Trockenheit der Nasenschleimhaut, Nasenbeschwerden, Niesen.
Gelegentlich: Nach Abklingen der Wirkung verstärkte Schleimhautschwellung, Epistaxis (Nasenbluten).
Sehr selten: Apnoe bei jungen Säuglingen und Neugeborenen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr selten: Konvulsionen (insbesondere bei Kindern).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Brennen an der Applikationsstelle.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Das klinische Bild einer Intoxikation mit Imidazol-Derivaten kann verwirrend sein, da sich Phasen der Stimulation mit Phasen einer Unterdrückung des zentralen Nervensystems und des kardiovaskulären Systems abwechseln können.
Symptome einer Stimulation des zentralen Nervensystems sind Angstgefühl, Erregung, Halluzinationen und Konvulsionen.
Symptome infolge der Hemmung des zentralen Nervensystems sind Erniedrigung der Körpertemperatur, Lethargie, Schläfrigkeit und Koma.
Folgende weitere Symptome können auftreten:
Miosis, Mydriasis, Schwitzen, Fieber, Blässe, Zyanose, Übelkeit, Tachykardie, Bradykardie, kardiale Arrhythmie, Herzstillstand, Hypertonie, schockähnliche Hypotonie, Lungenödem, Atemstörungen und Apnoe.
Besonders bei Kindern kommt es nach Überdosierung häufig zu dominierenden zentralnervösen Effekten mit Krämpfen und Koma, Bradykardie, Apnoe sowie einer Hypertonie, die von einer Hypotonie abgelöst werden kann.
Therapiemaßnahmen bei Überdosierung
Bei Verdacht auf Überdosierung sollten geeignete unterstützende Maßnahmen eingeleitet werden. Falls erforderlich, ist eine akute symptomatische Behandlung unter ärztlicher Aufsicht angezeigt. Dies schließt eine Überwachung des Patienten über mehrere Stunden ein.
Pharmakotherapeutische Gruppe: Rhinologika – Dekongestiva und andere Rhinologika zur topischen Anwendung - Sympathomimetika, rein;
ATC-Code: R01AA07
Wirkmechanismus
Xylometazolinhydrochlorid ist ein Sympathomimetikum, das auf alpha-adrenerge Rezeptoren in der Nasenschleimhaut wirkt. Bei Verabreichung in die Nase verengen sich die nasalen Blutgefäße. Dadurch kommt es zur Abschwellung der Nasenschleimhaut sowie der benachbarten Regionen des Rachenraums.
Es reduziert auch die mit Schleimhypersekretion zusammenhängenden Symptome und erleichtert den Sekretabfluss bei verstopfter Nase. Das Abschwellen der Nasenschleimhaut ermöglicht Patienten mit verstopfter Nase leichter durch die Nase zu atmen.
Pharmakodynamische Wirkungen
Die Wirkung von Otriven setzt innerhalb von 2 Minuten ein und hält mehrere Stunden an – im Durchschnitt 6 – 8 Stunden.
Der pH-Wert von Otriven ist dem pH-Wert-Bereich der Nasenhöhle angepasst.
Nach lokaler nasaler Verabreichung von Xylometazolin am Menschen sind die Plasmakonzentrationen sehr niedrig.
Resorption
Lokale Verabreichung führt zu einer minimalen systemischen Absorption. Bei Überschreiten der empfohlenen Dosierung kann es dennoch zu einer systemischen Resorption von intranasalem Xylometazolin kommen und zu systemischen sympathomimetischen Nebenwirkungen führen (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Verteilung
Es liegen keine Daten aus Studien am Menschen vor.
Biotransformation
Es liegen keine Daten aus Studien am Menschen vor.
Elimination
Es liegen keine Daten aus Studien am Menschen vor.
Besondere Patientengruppen
Es wurden keine Studien an speziellen Patientengruppen durchgeführt.
Basierend auf konventionellen Studien zur Toxizität bei wiederholter Gabe, lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Kanzerogenität und Genotoxizität
Es liegen keine Daten zur Kanzerogenität für Xylometazolin vor. In-vitro- und In-vivo-Daten zur Genotoxizität deuten jedoch nicht auf ein genotoxisches Potenzial hin.
Reproduktionstoxikologie
Bei Mäusen, Ratten und Kaninchen wurden keine teratogenen Wirkungen von Xylometazolin beobachtet.
Dosierungen oberhalb therapeutischer Mengen waren embryoletal oder führten zu einem verminderten Wachstum der Feten.
Bei Ratten wurde die Milchproduktion gehemmt. Es liegen keine Anzeichen für Fertilitätsstörungen vor.
Gereinigtes Wasser; Sorbitol; Natriumchlorid; Natriumdihydrogenphosphat-Dihydrat; Dinatriumhydrogenphosphat; Natriumedetat; Benzalkoniumchlorid.
Keine bekannt.
2 Jahre.
Nach Anbruch 6 Monate haltbar.
Nicht über 30 °C lagern.
Nicht einfrieren.
Kunststoffflasche mit Dosierpumpe.
10 ml Nasentropfen, Lösung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Haleon Germany GmbH
80258 München
Tel.: 0800 664 5626
E-Mail: mystory.de@haleon.com
6095041.00.00
12. Oktober 2004
Januar 2024
Apothekenpflichtig
A80-0