ONIVYDE pegylated liposomal 4,3 mg/ml Konzentrat zur Herstellung einer Infusionsdispersion
Eine 10 ml Konzentrat-Durchstechflasche enthält 43 mg wasserfreies Irinotecan als freie Base (als Irinotecan-Sucrosofatsalz in pegylierter liposomaler Formulierung).
1 ml Konzentrat enthält 4,3 mg wasserfreies Irinotecan als freie Base (als Irinotecan-Sucrosofatsalz in pegylierter liposomaler Form).
Sonstiger Bestandteil mit bekannter Wirkung
1 ml Konzentrat enthält 0,144 mmol (3,31 mg) Natrium.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Konzentrat zur Herstellung einer Infusionsdispersion.
Weiße bis leicht gelbliche, undurchsichtige isotonische liposomale Dispersion.
Das Konzentrat besitzt einen pH‑Wert von 7,2 und eine Osmolalität von 295 mOsm/kg.
ONIVYDE pegylated liposomal wird angewendet:
in Kombination mit Oxaliplatin, 5‑Fluorouracil (5‑FU) und Leucovorin (LV) zur Erstlinienbehandlung von erwachsenen Patienten mit metastasiertem Adenokarzinom des Pankreas,
in Kombination mit 5‑FU und LV zur Behandlung des metastasierten Adenokarzinoms des Pankreas, bei erwachsenen Patienten, deren Erkrankung unter einer Gemcitabin‑basierten Therapie fortgeschritten ist.
ONIVYDE pegylated liposomal darf Patienten nur durch Angehörige der Gesundheitsberufe, die Erfahrung in der Anwendung von Krebstherapien haben, verschrieben und verabreicht werden.
ONIVYDE pegylated liposomal entspricht nicht den nicht‑liposomalen Irinotecan-Formulierungen. Die unterschiedlichen Formulierungen sollten nicht gegeneinander ausgetauscht werden.
Dosierung
ONIVYDE pegylated liposomal sollte nicht als einziger Wirkstoff verabreicht werden. Die Therapie sollte bis zur Krankheitsprogression fortgesetzt werden oder bis der Patient das Medikament nicht mehr verträgt.
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5‑Fluorouracil und Leucovorin:
ONIVYDE pegylated liposomal, Oxaliplatin, LV und 5-FU sollten sequentiell verabreicht werden. Die empfohlene Dosis ONIVYDE pegylated liposomal ist 50 mg/m² intravenös über 90 Minuten, gefolgt von Oxaliplatin 60 mg/m² intravenös über 120 Minuten, gefolgt von LV 400 mg/m² intravenös über 30 Minuten, gefolgt von 5-FU 2 400 mg/m² intravenös über 46 Stunden. Dieses Behandlungsschema soll alle 2 Wochen wiederholt werden.
Sollte Oxaliplatin nicht gut vertragen werden, kann es abgesetzt werden und die Behandlung kann mit ONIVYDE pegylated liposomal und 5-FU /LV weitergeführt werden.
Die empfohlene Anfangsdosis von ONIVYDE pegylated liposomal für Patienten, die Träger der UGT1A1*28-Variante (UGT1A1*28-Allel-Homozygot) sind, ist unverändert und bleibt bei einer intravenösen Verabreichung von 50 mg/m² über 90 Minuten bestehen (siehe Abschnitte 5.1 und 5.2).
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
ONIVYDE pegylated liposomal, Leucovorin und 5‑Fluorouracil sollten sequentiell verabreicht werden. Die empfohlene Dosis und das empfohlene Behandlungsschema von ONIVYDE pegylated liposomal sind 70 mg/m2 intravenös über 90 Minuten, gefolgt von LV 400 mg/m2 intravenös über 30 Minuten, gefolgt von 5‑FU 2 400 mg/m2 intravenös über 46 Stunden. Dieses Behandlungsschema soll alle 2 Wochen wiederholt werden.
Eine reduzierte Anfangsdosis von ONIVYDE pegylated liposomal von 50 mg/m2 sollte bei Patienten in Erwägung gezogen werden, die Träger der UGT1A1*28-Variante (UGT1A1*28-Allel-Homozygot) sind (siehe Abschnitte 4.8 und 5.1). Eine Dosissteigerung von ONIVYDE pegylated liposomal auf 70 mg/m2 sollte bei Verträglichkeit für nachfolgende Zyklen in Erwägung gezogen werden.
Prämedikation
Es wird empfohlen, Patienten eine Prämedikation mit Standarddosen von Dexamethason (oder einem gleichwertigen Kortikosteroid) in Kombination mit einem 5‑HT3‑Antagonisten (oder einem anderen Antiemetikum) mindestens 30 Minuten vor der ONIVYDE pegylated liposomal-Infusion zu verabreichen.
Dosisanpassungen
Alle Dosisanpassungen sollten auf der schwerwiegendsten vorhergehenden Toxizität beruhen. Für die LV‑Dosis ist keine Anpassung erforderlich.
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
Tabelle 1: Empfohlene Dosisänderungen für ONIVYDE pegylated liposomal + Oxaliplatin/5-FU/LV
Toxizitätsgrad (Wert) gemäß NCI CTCAE1 | Anpassung von ONIVYDE pegylated liposomal/Oxaliplatin/5‑FU | ||
Hämatologische Toxizitäten | |||
Neutropenie | Ein neuer Therapiezyklus sollte erst beginnen, wenn die absolute Neutrophilenzahl ≥ 2 000 Zellen/mm3 (2x109/L) beträgt. | ||
Grad 3 oder Grad 4 (< 1000 Zellen/mm3) oder neutropenisches Fieber | Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 80 % der Anfangsdosis | |
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 65 % der Anfangsdosis | ||
Drittes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 50 % der Anfangsdosis | ||
Viertes Auftreten | Behandlungsabbruch | ||
Thrombozytopenie Leukopenie | Ein neuer Therapiezyklus sollte erst beginnen, wenn die Thrombozytenzahl ≥ 100 000 Thrombozyten/mm3 (100x109/L) beträgt. | ||
Nicht‑hämatologische Toxizitäten2 | |||
Diarrhoe | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich die Diarrhoe auf ≤ Grad 1 (2‑3 Stühle/Tag mehr im Vergleich zur Häufigkeit vor Behandlungsbeginn) einpendelt. | ||
Grad 2 | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich die Diarrhoe auf ≤ Grad 1 (2‑3 Stühle/Tag mehr im Vergleich zur Häufigkeit vor Behandlungsbeginn) einpendelt. | ||
Grad 3 oder 4 | Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 80 % der Anfangsdosis | |
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 65 % der Anfangsdosis | ||
Drittes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 50 % der Anfangsdosis | ||
Viertes Auftreten | Behandlungsabbruch | ||
Alle weiteren Toxizitäten2 | Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 80 % der Anfangsdosis | |
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 65 % der Anfangsdosis | ||
Drittes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 50 % der Anfangsdosis | ||
Viertes Auftreten | Behandlungsabbruch | ||
Für Grad ≥ 3 Übelkeit und Erbrechen | Reduktion der Dosis nur bei Auftreten trotz optimaler antiemetischer Therapie | ||
Hand-Fuß-Syndrom Grad 3 oder 4 | Erstes Auftreten | Behandlungsabbruch | |
Neurozerebelläre Toxizität jeden Gra- des oder kardiale Toxizität ≥ Grad 2 | Erstes Auftreten | Behandlungsabbruch | |
Anaphylaktische Reaktion | Erstes Auftreten | Behandlungsabbruch | |
Interstitielle Lungenerkrankung | Erstes Auftreten | Behandlungsabbruch | |
1 | NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, in der aktuell gültigen Version (Allgemeine Terminologiekriterien von unerwünschten Ereignissen des Nationalen Krebsinstituts) | ||
2 | Ausgenommen Asthenie und Anorexie | ||
Patienten, die homozygot für das UGT1A1*28 Allel sind, sollten mit ONIVYDE pegylated liposomal in der gleichen Dosierung beginnen und es sollten die gleichen Vorgaben für die Dosisreduktion eingehalten werden.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
Für Patienten, die die Behandlung mit 50 mg/m2 ONIVYDE pegylated liposomal beginnen und die Dosis nicht auf 70 mg/m2 steigern, wird eine erste Reduktion der Dosis auf 43 mg/m2 und eine zweite Reduktion der Dosis auf 35 mg/m2 empfohlen. Patienten, die eine weitere Dosisreduktion benötigen, sollten die Behandlung abbrechen.
Bei Patienten, die Träger der UGT1A1*28-Variante (UGT1A1*28-Allel-Homozygot) sind und bei denen im ersten Therapiezyklus (reduzierte Dosis von 50 mg/m2) keine arzneimittelbezogenen Toxizitäten aufgetreten sind, kann die Dosis von ONIVYDE pegylated liposomal in den nachfolgenden Zyklen je nach individueller Patientenverträglichkeit auf eine Dosis von insgesamt 70 mg/m2 gesteigert werden.
Tabelle 2: Empfohlene Dosisänderungen für ONIVYDE pegylated liposomal +5‑FU/LV bei Grad 3–4 Toxizitäten für Patienten, die für UGT1A1*28 nicht homozygot sind
Toxizitätsgrad (Wert) gemäß NCI CTCAE 1 | Anpassung von ONIVYDE pegylated liposomal/5‑FU | ||
Hämatologische Toxizitäten | |||
Neutropenie | Ein neuer Therapiezyklus sollte erst beginnen, wenn die absolute Neutrophilenzahl ≥ 1 500 Zellen/mm3 beträgt. | ||
Grad 3 oder Grad 4 (< 1 000 Zel- len/mm3) oder neutropenisches Fieber | Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 50 mg/m2 | |
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 43 mg/m2 | ||
Drittes Auftreten | Behandlungsabbruch | ||
Thrombozytopenie Leukopenie | Ein neuer Therapiezyklus sollte erst beginnen, wenn die Thrombozytenzahl ≥ 100 000 Thrombozyten/mm3 beträgt. | ||
Nicht‑hämatologische Toxizitäten2 | |||
Diarrhoe | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich die Diarrhoe auf ≤ Grad 1 (2‑3 Stühle/Tag mehr im Vergleich zur Häufigkeit vor Behandlungsbeginn) einpendelt. | ||
Grad 2 | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich die Diarrhoe auf ≤ Grad 1 (2‑3 Stühle/Tag mehr im Vergleich zur Häufigkeit vor Behandlungsbeginn) einpendelt. | ||
Grad 3 oder 4 | Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 50 mg/m2 | |
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 43 mg/m2 | ||
Drittes Auftreten | Behandlungsabbruch | ||
Übelkeit/Erbrechen | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich Übelkeit/Erbrechen auf ≤ Grad 1 oder auf die Ausgangswerte einpendeln. | ||
Grad 3 oder 4 (trotz antiemetischer Therapie) | Erstes Auftreten | Optimieren der antiemetischen Therapie | |
Zweites Auftreten | Optimieren der antiemetischen Therapie | ||
Drittes Auftreten | Behandlungsabbruch | ||
Leber‑, Nieren‑, Atemwegs‑ oder sonstige2 Toxizitäten | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich die Nebenwirkungen auf ≤ Grad 1 einpendeln. | ||
Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 50 mg/m2 | ||
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 43 mg/m2 | ||
Drittes Auftreten | Behandlungsabbruch | ||
Anaphylaktische Reaktion | Erstes Auftreten | Behandlungsabbruch | |
Interstitielle Lungenerkrankung | Erstes Auftreten | Behandlungsabbruch | |
1 | NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, in der aktuell gültigen Version (Allgemeine Terminologiekriterien von unerwünschten Ereignissen des Nationalen Krebsinstituts) | ||
2 | Schließt Asthenie und Anorexie aus; Asthenie und Anorexie Grad 3 erfordern keine Dosisanpassung. | ||
Tabelle 3: Empfohlene Dosisänderungen für ONIVYDE pegylated liposomal +5‑FU/LV bei Grad 3–4 Toxizitäten für Patienten, die für UGT1A1*28 homozygot sind
Toxizitätsgrad (Wert) | Anpassung von ONIVYDE pegylated liposomal/5‑FU | ||
Nebenwirkungen2Grad 3 oder 4 | Ein neuer Therapiezyklus sollte erst beginnen, wenn sich das unerwünschte Ereignis auf ≤ Grad 1 einpendelt. | ||
Erstes Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 43 mg/m2 | ||
Zweites Auftreten | Reduzieren der ONIVYDE pegylated liposomal-Dosis auf 35 mg/m2 | ||
Drittes Auftreten | Behandlungsabbruch | ||
Anaphylaktische Reaktion | Erstes Auftreten | Behandlungsabbruch | |
Interstitielle Lungenerkrankung | Erstes Auftreten | Behandlungsabbruch | |
1 | NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, in der aktuell gültigen Version (Allgemeine Terminologiekriterien von unerwünschten Ereignissen des Nationalen Krebsinstituts) | ||
2 | Schließt Asthenie und Anorexie aus; Asthenie und Anorexie Grad 3 erfordern keine Dosisanpassung. | ||
3 | Im Fall einer Dosissteigerung von ONIVYDE pegylated liposomal auf 70 mg/m² bei guter Verträglichkeit in nachfolgenden Zyklen sollten die empfohlenen Dosisänderungen gemäß Tabelle 2 durchgeführt werden. | ||
Besondere Patientengruppen
Leberfunktionsstörung
Es wurde keine spezifische Studie bei Patienten mit Leberfunktionsstörung im Zusammenhang mit ONIVYDE pegylated liposomal durchgeführt. Die Anwendung von ONIVYDE pegylated liposomal sollte bei Patienten mit einem Bilirubinspiegel von > 2,0 mg/dl oder einem Anstieg der Aspartataminotransferase‑ (AST) und Alaninaminotransferasespiegel (ALT) um ein > 2,5‑Faches des oberen Limits des Normalwertes (ULN) bzw. ein > 5‑Faches des oberen Limits des Normalwertes (ULN) bei Vorliegen von Lebermetastasen vermieden werden (siehe Abschnitt 4.4).
Nierenfunktionsstörung
Es wurde keine spezifische Studie bei Patienten mit Nierenfunktionsstörung im Zusammenhang mit ONIVYDE pegylated liposomal durchgeführt. Eine Dosisanpassung wird bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung nicht empfohlen (siehe Abschnitte 4.4 und 5.2). ONIVYDE pegylated liposomal wird nicht zur Anwendung bei Patienten mit schwerer Nierenfunktionsstörung (ClKr < 30 ml/min) empfohlen.
Ältere Patienten
Neunundvierzig Prozent (49,6 %) der Patienten in NAPOLI-3 und einundvierzig Prozent (41 %) der Patienten in NAPOLI-1, die mit ONIVYDE pegylated liposomal behandelt wurden, waren 65 Jahre alt oder älter. Eine Dosisanpassung wird nicht empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von ONIVYDE pegylated liposomal bei Kindern und Jugendlichen im Alter von ≤ 18 Jahren ist bisher noch nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
ONIVYDE pegylated liposomal ist nur zur intravenösen Anwendung. Das Konzentrat muss vor Anwendung verdünnt und in einer einzigen intravenösen Infusion über 90 Minuten verabreicht werden. Ausführliche Informationen siehe Abschnitt 6.6.
Vorsichtsmaßnahmen bei der Handhabung bzw. Anwendung des Arzneimittels
ONIVYDE pegylated liposomal ist ein cytotoxisches Arzneimittel. Das Tragen von Handschuhen, Schutzbrille und Schutzkleidung wird bei der Handhabung oder Anwendung von ONIVYDE pegylated liposomal empfohlen. Schwangere Mitarbeiter sollten ONIVYDE pegylated liposomal nicht handhaben.
Schwere Überempfindlichkeit gegen Irinotecan oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile in der Anamnese.
Stillen (siehe Abschnitt 4.6).
Allgemeines
ONIVYDE pegylated liposomal ist eine liposomale Formulierung von Irinotecan mit anderen pharmakokinetischen Eigenschaften als nicht‑liposomales Irinotecan. Die Dosiskonzentration und ‑stärke unterscheiden sich von nicht‑liposomalem Irinotecan.
ONIVYDE pegylated liposomal entspricht nicht anderen nicht‑liposomalen Irinotecan-Formulierungen. Die unterschiedlichen Formulierungen sind nicht gegeneinander austauschbar.
Bei der begrenzten Anzahl an Patienten mit vorheriger Exposition gegenüber nicht‑liposomalem Irinotecan wurde der Nutzen von ONIVYDE pegylated liposomal nicht nachgewiesen.
Myelosuppression/Neutropenie
Während der Behandlung mit ONIVYDE pegylated liposomal sollte das große Blutbild überwacht werden. Patienten sollte das Risiko einer Neutropenie und die Bedeutung von Fieber bekannt sein. Eine febrile Neutropenie (Körpertemperatur > 38 °C und Neutrophilenzahl ≤ 1 000 Zellen/mm³) sollte dringend im Krankenhaus mit intravenösen Breitbandantibiotika behandelt werden. Bei Patienten mit metastasiertem Adenokarzinom des Pankreas wurde unter ONIVYDE pegylated liposomal Sepsis mit neutropenischem Fieber und anschließendem septischem Schock mit letalem Ausgang beobachtet.
Bei Patienten mit schweren hämatologischen Ereignissen wird eine Dosisreduktion oder ein Behandlungsabbruch empfohlen (siehe Abschnitt 4.2). Bei Patienten mit schwerem Knochenmarkversagen darf ONIVYDE pegylated liposomal nicht angewendet werden.
Eine Strahlentherapie im Bauchbereich in der Anamnese erhöht das Risiko einer schweren Neutropenie und febrilen Neutropenie nach der Behandlung mit ONIVYDE pegylated liposomal. Eine engmaschige Überwachung des Blutbildes wird empfohlen. Bei Patienten mit Strahlentherapie im Bauchbereich in der Anamnese sollte die Anwendung von myeloischen Wachstumsfaktoren in Erwägung gezogen werden. Bei Patienten, die während der Anwendung von ONIVYDE pegylated liposomal gleichzeitig eine Strahlentherapie erhalten, ist Vorsicht geboten.
Patienten mit mangelhafter Glukuronidierung von Bilirubin, zum Beispiel bei Gilbert‑Syndrom, unterliegen bei einer Behandlung mit ONIVYDE pegylated liposomal möglicherweise einem größeren Risiko für eine Myelosuppression.
Immunsuppressive Wirkungen und Impfstoffe
Die Verabreichung von Lebendimpfstoffen bzw. attenuierten Lebendimpfstoffen bei Patienten, die aufgrund chemotherapeutischer Arzneimittel wie ONIVYDE pegylated liposomal abwehrgeschwächt sind, kann zu schwerwiegenden oder tödlichen Infektionen führen. Von einer Impfung mit Lebendimpfstoffen sollte daher abgesehen werden. Totimpfstoffe oder inaktive Impfstoffe dürfen verabreicht werden. Die Reaktion auf solche Impfstoffe kann jedoch vermindert sein.
Wechselwirkungen mit starken CYP3A4-Induktoren
ONIVYDE pegylated liposomal sollte nicht zusammen mit starken CYP3A4-Induktoren, wie etwa Antikonvulsiva (Phenytoin, Phenobarbital oder Carbamazepin), Rifampicin, Rifabutin und Johanniskraut angewendet werden, es sei denn, es bestehen keine therapeutischen Alternativen. Die geeignete Anfangsdosis für Patienten, die diese Antikonvulsiva oder andere starke Induktoren einnehmen, wurde nicht festgelegt. Es sollte in Erwägung gezogen werden, diese Mittel mindestens 2 Wochen vor Beginn der Behandlung mit ONIVYDE pegylated liposomal durch Therapien zu ersetzen, die keine Induktion des Enzyms bewirken (siehe Abschnitt 4.5).
Wechselwirkungen mit starken CYP3A4-Inhibitoren oder mit starken UGT1A1-Inhibitoren
ONIVYDE pegylated liposomal sollte nicht zusammen mit starken Inhibitoren des Enzyms CYP3A4 (z.B. Grapefruitsaft, Clarithromycin, Indinavir, Itraconazol, Lopinavir, Nefazodon, Nelfinavir, Ritonavir, Saquinavir, Telaprevir, Voriconazol) angewendet werden. Starke CYP3A4-Inhibitoren sollten mindestens 1 Woche vor Beginn der ONIVYDE pegylated liposomal-Therapie abgesetzt werden.
ONIVYDE pegylated liposomal sollte nicht zusammen mit starken UGT1A1-Inhibitoren (z. B. Atazanavir, Gemfibrozil, Indinavir) angewendet werden, es sei denn, es bestehen keine therapeutischen Alternativen.
Diarrhoe
ONIVYDE pegylated liposomal kann schwerwiegende und lebensbedrohliche Diarrhoe verursachen. ONIVYDE pegylated liposomal darf nicht an Patienten mit Darmverschluss und chronisch entzündlichen Darmerkrankungen verabreicht werden.
Diarrhoe kann früh (≤ 24 Stunden nach Anwendung von ONIVYDE pegylated liposomal) oder spät (> 24 Stunden nach Anwendung) einsetzen (siehe Abschnitt 4.8).
Bei Patienten mit früh einsetzender Diarrhoe oder cholinergen Symptomen, sollte eine prophylaktische oder therapeutische Atropin-Behandlung in Erwägung gezogen werden, wenn diese nicht kontraindiziert ist. Patienten sollten auf das Risiko einer spät einsetzenden Diarrhoe hingewiesen werden. Diese kann entkräftend und in seltenen Fällen lebensbedrohlich sein, da ein dauerhaft lockerer oder wässriger Stuhlgang zu Dehydratation, Elektrolytstörungen, Kolitis, gastrointestinaler Ulzeration, Infektion oder Sepsis führen kann.
Sobald der erste flüssige Stuhlgang auftritt, sollte der Patient große Mengen elektrolythaltiger Getränke zu sich nehmen. Die Patienten sollten für die Behandlung spät einsetzender Diarrhoe Loperamid (oder ein vergleichbares Mittel) vorrätig haben. Loperamid ist einzunehmen, sobald ein lockerer oder ein Stuhl mit mangelhafter Konsistenz auftritt bzw. sobald die Darmentleerung häufiger als normalerweise üblich stattfindet (maximal 16 mg/Tag). Die Behandlung mit Loperamid wird fortgesetzt, bis der Patient mindestens 12 Stunden lang frei von Diarrhoe ist. Um eine schwerwiegende Diarrhoe zu vermeiden, sollten jegliche laktosehaltige Produkte weggelassen werden, für eine ausreichende Flüssigkeitszufuhr gesorgt werden und auf eine fettarme Ernährung geachtet werden.
Hält die Diarrhoe trotz Einnahme von Loperamid mehr als 24 Stunden an, werden zusätzlich orale Antibiotika empfohlen (z. B. Fluorchinolone für 7 Tage). Loperamid darf aufgrund des Risikos eines paralytischen Ileus nicht länger als 48 Stunden durchgehend eingenommen werden. Hält die Diarrhoe länger als 48 Stunden an, ist Loperamid abzusetzen. Der Elektrolytspiegel muss überwacht und ausgeglichen werden, die Behandlung mit Antibiotika ist bis zum Abklingen der Begleitsymptome fortzusetzen.
Ein neuer Therapiezyklus sollte erst beginnen, wenn sich die Diarrhoe auf ≤ Grad 1 (2‑3 Stühle/Tag mehr im Vergleich zur Häufigkeit vor Behandlungsbeginn) einpendelt.
Bei Diarrhoe Grad 3 oder 4 sollte die nachfolgende ONIVYDE pegylated liposomal-Dosis reduziert werden (siehe Abschnitt 4.2).
Cholinerge Reaktionen
Früh einsetzende Diarrhoe kann von cholinergen Symptomen begleitet sein, wie etwa Rhinitis, erhöhte Speichelbildung, Hitzegefühl, Diaphorese, Bradykardie, Miosis und Hyperperistaltik. Bei cholinergen Symptomen sollte Atropin angewendet werden.
Überempfindlichkeitsreaktion einschließlich akuter infusionsbedingter Reaktionen
Bei Patienten, die mit ONIVYDE pegylated liposomal behandelt wurden, wurde über akute Infusionsreaktionen, vor allem Ausschlag, Urtikaria, Periorbitalödem oder Pruritus, berichtet. Neue Ereignisse (alle Grad 1 oder 2) traten im Allgemeinen früh während der Behandlung mit ONIVYDE pegylated liposomal auf. Nur 2 von 10 Patienten wiesen unerwünschte Ereignisse nach der fünften Dosis auf. Es können Überempfindlichkeitsreaktionen, einschließlich akuter Reaktionen auf die Infusion, Anaphylaxie/anaphylaktoide Reaktionen und Angioödeme auftreten. ONIVYDE pegylated liposomal sollte im Falle schwerer Überempfindlichkeitsreaktionen abgesetzt werden (siehe Abschnitt 4.2).
Vorherige Whipple-Operation
Patienten mit einer Whipple-Operation in der Anamnese unterliegen einem erhöhten Risiko für schwere Infektionen nach Anwendung von ONIVYDE pegylated liposomal in Kombination mit 5‑FU und Leucovorin. Die Patienten sollten auf Zeichen einer Infektion überwacht werden.
Gefäßerkrankungen
ONIVYDE pegylated liposomal wurde mit thromboembolischen Ereignissen, wie zum Beispiel Lungenembolie, Venenthrombose und arterielle Thromboembolie assoziiert. Eine umfassende Anamnese ist erforderlich, um Patienten mit multiplen Risikofaktoren zusätzlich zu der zugrunde liegenden Neoplasie zu identifizieren. Patienten sollen über die Anzeichen und Symptome einer Thromboembolie informiert werden und angewiesen werden, sofort den behandelnden Arzt oder das medizinische Fachpersonal aufzusuchen, sobald derartige Anzeichen oder Symptome auftreten.
Lungentoxizität
Bei Patienten, die eine Behandlung mit nicht‑liposomalem Irinotecan erhielten, wurden tödlich verlaufende Ereignisse ähnlich einer interstitiellen Lungenerkrankung beobachtet. In der Studie NAPOLI-3 wurde Pneumonitis bei 0,3 % der Patienten festgestellt, die mit ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin und 5-FU/LV behandelt wurden. Risikofaktoren sind unter anderem eine vorbestehende Lungenkrankheit, die Einnahme pneumotoxischer Arzneimittel, Behandlung mit Kolonie‑stimulierenden Faktoren oder eine vorangegangene Strahlentherapie. Patienten mit Risikofaktoren sollten vor und während der Behandlung mit ONIVYDE pegylated liposomal engmaschig auf respiratorische Symptome überwacht werden. In einer klinischen Studie mit Irinotecan zeigte ein Röntgenthorax bei einem kleinen Anteil von Patienten ein retikulonoduläres Muster. Bei Dyspnoe, Husten und Fieber, sowohl neu als auch progredient, sollte die Behandlung mit ONIVYDE pegylated liposomal sofort unterbrochen und die diagnostische Beurteilung abgewartet werden. Bei Patienten mit bestätigter Diagnose einer interstitiellen Lungenerkrankung ist ONIVYDE pegylated liposomal abzusetzen (siehe Abschnitt 4.2).
Leberfunktionsstörung
Patienten mit Hyperbilirubinämie hatten höhere Konzentrationen von SN‑38 gesamt (siehe Abschnitt 5.2), und daher ist das Risiko für Neutropenie erhöht. Regelmäßige Kontrollen des großen Blutbildes sollten bei Patienten mit einem Gesamtbilirubin von 1,0‑2,0 mg/dl durchgeführt werden. Bei Patienten mit Leberfunktionsstörung (Bilirubin > 2 x ULN; Transaminasen > 5 x ULN) ist Vorsicht geboten. Vorsicht ist geboten, wenn ONIVYDE pegylated liposomal in Kombination mit anderen hepatotoxischen Arzneimitteln gegeben wird, besonders bei vorbestehender Leberfunktionsstörung.
Untergewichtige Patienten (BMI < 18,5 kg/m2)
In der Studie NAPOLI-1 traten bei 5 von 8 untergewichtigen Patienten Nebenwirkungen des Grades 3 oder 4 auf, in den meisten Fällen Myelosuppression, wobei 7 von 8 Patienten eine Dosisänderung, wie etwa eine Dosisverzögerung, eine Dosisreduktion oder eine Dosisunterbrechung, benötigten. Bei der Anwendung von ONIVYDE pegylated liposomal bei Patienten mit einem Body-Mass-Index (BMI) < 18,5 kg/m2 ist Vorsicht geboten.
Sonstige Bestandteile
Dieses Arzneimittel enthält 33,1 mg Natrium pro Durchstechflasche, entsprechend 1,65 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Die Informationen zu den Arzneimittelwechselwirkungen mit ONIVYDE pegylated liposomal beruhen auf der veröffentlichten wissenschaftlichen Literatur zu nicht‑liposomalem Irinotecan.
Die Anwendung von ONIVYDE pegylated liposomal beeinflussende Wechselwirkungen
Starke CYP3A4-Induktoren
Patienten, die gleichzeitig nicht‑liposomales Irinotecan und Antikonvulsiva wie Phenytoin, Phenobarbital oder Carbamazepin erhalten, die eine Induktion des Enzyms CYP3A4 bewirken, weisen eine wesentlich geringere Exposition gegenüber Irinotecan (Senkung der AUC um 12 % bei Johanniskraut, 57 % bis 79 % bei Phenytoin, Phenobarbital oder Carbamazepin) und SN‑38 (Senkung der AUC um 42 % bei Johanniskraut, 36 % bis 92 % bei Phenytoin, Phenobarbital oder Carbamazepin) auf. Daher kann die gleichzeitige Anwendung von ONIVYDE pegylated liposomal und CYP3A4-Induktoren die systemische Exposition von ONIVYDE pegylated liposomal senken.
Starke CYP3A4‑ und UGT1A1-Inhibitoren
Patienten, die gleichzeitig nicht‑liposomales Irinotecan und Ketoconazol, einen CYP3A4‑ und UGT1A1-Inhibitor, erhalten, haben eine um 109 % erhöhte Exposition gegenüber SN‑38. Daher kann die gleichzeitige Gabe von ONIVYDE pegylated liposomal mit anderen Inhibitoren von CYP3A4 (z. B. Grapefruitsaft, Clarithromycin, Indinavir, Itraconazol, Lopinavir, Nefazodon, Nelfinavir, Ritonavir, Saquinavir, Telaprevir, Voriconazol) die systemische Exposition gegenüber ONIVYDE pegylated liposomal erhöhen. Auf Grundlage der Arzneimittelwechselwirkung zwischen nicht‑liposomalem Irinotecan und Ketoconazol kann die gleichzeitige Gabe von ONIVYDE pegylated liposomal mit anderen Inhibitoren von UGT1A1 (z. B. Atazanavir, Gemfibrozil, Indinavir, Regorafenib) die systemische Exposition von ONIVYDE pegylated liposomal ebenfalls erhöhen.
Die gleichzeitige Gabe von ONIVYDE pegylated liposomal +5‑FU/LV – beruhend auf einer populationspharmakokinetischen Analyse – verändert nicht die Pharmakokinetik von ONIVYDE pegylated liposomal.
Antineoplastische Wirkstoffe (einschließlich Flucytosin als Prodrug von 5-Fluorouracil)
Nebenwirkungen von Irinotecan, wie z. B. Myelosuppression, können durch andere antineoplastische Wirkstoffe mit ähnlichem Nebenwirkungsprofil verstärkt werden.
Es sind keine Wechselwirkungen von ONIVYDE pegylated liposomal mit weiteren Arzneimitteln bekannt.
Frauen im gebärfähigen Alter/Kontrazeption bei Männern und Frauen
Frauen im gebärfähigen Alter müssen während und 7 Monate nach der Behandlung mit ONIVYDE pegylated liposomal eine zuverlässige Verhütungsmethode anwenden. Männer sollten während und 4 Monate nach der Behandlung mit ONIVYDE pegylated liposomal Kondome benutzen.
Schwangerschaft
Es liegen keine hinreichenden Daten für die Verwendung von ONIVYDE pegylated liposomal bei Schwangeren vor. ONIVYDE pegylated liposomal kann den Fetus schädigen, wenn es schwangeren Frauen verabreicht wird. Der Hauptwirkstoff Irinotecan wirkt bei Tieren nachweislich embryotoxisch und teratogen (siehe Abschnitt 5.3). Aufgrund der Daten aus diesen Tierstudien sowie aufgrund des Wirkmechanismus von Irinotecan sollte ONIVYDE pegylated liposomal nicht während der Schwangerschaft angewendet werden, es sei denn, dies ist unerlässlich. Wenn ONIVYDE pegylated liposomal während der Schwangerschaft angewendet wird oder die Patientin während der Behandlung schwanger wird, sollte die Patientin über die potenzielle Gefährdung des Fetus informiert werden.
Stillzeit
Es ist nicht bekannt, ob ONIVYDE pegylated liposomal oder seine Metaboliten in die Muttermilch übergehen. Aufgrund des Potenzials für schwere Nebenwirkungen von ONIVYDE pegylated liposomal bei gestillten Kindern ist ONIVYDE pegylated liposomal während der Stillzeit kontraindiziert (siehe Abschnitt 4.3). Patientinnen sollten bis einen Monat nach der letzten Dosis nicht stillen.
Fertilität
Es liegen keine Daten zu den Auswirkungen von ONIVYDE pegylated liposomal auf die menschliche Fertilität vor. Nicht‑liposomales Irinotecan führte nach mehrfachen täglichen Dosen bei Tieren nachweislich zu einer Atrophie der männlichen und weiblichen Fortpflanzungsorgane (siehe Abschnitt 5.3). Vor Beginn der Verabreichung von ONIVYDE pegylated liposomal sollten Patienten bzgl. einer Konservierung von Gameten beraten werden.
ONIVYDE pegylated liposomal hat mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Während der Behandlung sollten Patienten nur unter Beachtung aller Vorsichtsmaßnahmen Fahrzeuge führen oder Maschinen bedienen.
Zusammenfassung des Sicherheitsprofils
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin (NALIRIFOX):
Die folgenden Nebenwirkungen, die im Zusammenhang mit der Anwendung von ONIVYDE pegylated liposomal stehen, wurden bei 370 Patienten berichtet, welche in Kombination mit Oxaliplatin/5-FU/LV behandelt wurden und zuvor keine Chemotherapie gegen das metastasierte Adenokarzinom des Pankreas erhalten hatten.
Die häufigsten Nebenwirkungen (Inzidenz ≥ 20 %) waren Diarrhoe, Übelkeit, Erbrechen, verminderter Appetit, Ermüdung, Asthenie, Neutropenie, erniedrigte Neutrophilenzahl und Anämie. Die häufigsten schwerwiegenden Nebenwirkungen (≥ 5 % Grad 3 oder 4) waren Diarrhoe, Übelkeit, Erbrechen, verminderter Appetit, Ermüdung, Asthenie, Neutropenie, erniedrigte Neutrophilenzahl, Anämie und Hypokaliämie. Die häufigsten schwerwiegenden Nebenwirkungen (≥ 2 %) waren Diarrhoe, Übelkeit, Erbrechen und Dehydratation.
Nebenwirkungen von ONIVYDE pegylated liposomal, die zu einem Abbruch der Behandlung führten, traten bei 9,5 % der Patienten auf. Die am häufigsten berichtete Nebenwirkung, die zu einem Abbruch führte, war Neutropenie.
Dosisreduktionen von ONIVYDE pegylated liposomal aufgrund von Nebenwirkungen (unabhängig von der Beurteilung der Kausalität), erfolgten bei 52,4 % der Patienten. Die häufigsten Nebenwirkungen, die eine Dosisreduktion erforderlich machten (≥ 5 %), waren Diarrhoe, Übelkeit, Neutropenie und eine erniedrigte Neutrophilenzahl.
Die Behandlung mit ONIVYDE pegylated liposomal wurde aufgrund von Nebenwirkungen (unabhängig von der Beurteilung der Kausalität) bei 1,9 % der Patienten unterbrochen. Die häufigsten Nebenwirkungen, die eine Unterbrechung erforderlich gemacht haben, waren Überempfindlichkeitsreaktionen und infusionsbedingte Reaktionen, die bei 0,5 % der Patienten auftraten.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
Die folgenden Nebenwirkungen, die in Zusammenhang mit der Anwendung von ONIVYDE pegylated liposomal stehen, wurden bei 264 Patienten mit metastasiertem Adenokarzinom des Pankreas berichtet, die nach Fortschreiten der Erkrankung unter einer Gemcitabin-basierten Therapie behandelt wurden.
Die häufigsten Nebenwirkungen (Inzidenz ≥ 20 %) von ONIVYDE pegylated liposomal +5‑FU/LV waren: Diarrhoe, Übelkeit, Erbrechen, verminderter Appetit, Neutropenie, Ermüdung, Asthenie, Anämie, Stomatitis und Fieber. Die häufigsten schwerwiegenden Nebenwirkungen (≥ 2 %) der Behandlung mit ONIVYDE pegylated liposomal waren Diarrhoe, Erbrechen, febrile Neutropenie, Übelkeit, Fieber, Sepsis, Dehydratation, septischer Schock, Pneumonie, akutes Nierenversagen und Thrombozytopenie.
Die Raten der Nebenwirkungen, die zu einem permanenten Abbruch führten, lagen für den ONIVYDE pegylated liposomal +5‑FU/LV-Studienarm bei 11 %.
Die am häufigsten berichteten Nebenwirkungen, die zu einem permanenten Abbruch führten, waren für den ONIVYDE pegylated liposomal +5‑FU/LV-Studienarm Infektion und Diarrhoe.
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen, die in diesem Abschnitt beschrieben werden, wurden von Studiendaten und Post-Marketing Erfahrungen von ONIVYDE pegylated liposomal abgeleitet.
Die Nebenwirkungen, die während der Behandlung mit ONIVYDE pegylated liposomal auftreten können, sind im Folgenden zusammengefasst und nach Systemorganklasse und Häufigkeitskategorie aufgeführt (Tabelle 4). Innerhalb jeder Systemorganklasse und Häufigkeitskategorie werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Die Häufigkeitskategorien der Nebenwirkungen werden in folgende Kategorien eingeteilt: Sehr häufig (≥1/10); Häufig (≥1/100, <1/10); Gelegentlich (≥1/1 000, <1/100); Selten (≥1/10 000, <1/1 000)* und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 4: Berichtete Nebenwirkungen bei Patienten unter Behandlung mit ONIVYDE pegylated liposomal
SOK Häufigkeit* | In Kombination mit Oxaliplatin/5-FU/LV (in NAPOLI-3) | In Kombination mit 5-FU/LV | |
Infektionen und parasitäre Erkrankungen | |||
Häufig | Sepsis, Harnwegsinfektion, Candida-Infektion, Nasopharyngitis | Septischer Schock, Sepsis, Pneumonie, febrile Neutropenie, Gastroenteritis, orale Candidose | |
Gelegentlich | Divertikulitis, Pneumonie, Analabszess, febrile Infektion, Gastroenteritis, Schleimhautinfektion, orale Pilzinfektion, Clostridium difficile-Infektion, Konjunktivitis, Furunkel, Herpes simplex, Laryngitis, Parodontitis, pustulöser Ausschlag, Sinusitis, Zahninfektion, vulvovaginale Pilzinfektion | Biliärsepsis | |
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen) | |||
Gelegentlich | Peritumorales Ödem | ||
Erkrankungen des Blutes und des Lymphsystems | |||
Sehr häufig | Anämie, Neutropenie, Thrombozytopenie | Neutropenie, Leukopenie, Anämie, Thrombozytopenie | |
Häufig | Febrile Neutropenie, Leukopenie, Lymphopenie | Lymphopenie | |
Gelegentlich | Panzytopenie, hämolytische Anämie | ||
Erkrankungen des Immunsystems | |||
Gelegentlich | Überempfindlichkeit | Überempfindlichkeit | |
Nicht bekannt | Anaphylaktische/anaphylaktoide Reaktion, Angioödem | ||
Stoffwechsel‑ und Ernährungsstörungen | |||
Sehr häufig | Hypokaliämie, verminderter Appetit | Hypokaliämie, Hypomagnesiämie, Dehydratation, verminderter Appetit | |
Häufig | Dehydratation, Hyponatriämie, Hypophosphatämie, Hypomagnesiämie, Hypalbuminämie, Hypokalzämie | Hypoglykämie, Hyponatriämie, Hypophosphatämie | |
Gelegentlich | Elektrolytungleichgewicht, Hyperkalzämie, Zelltod, Hypochlorämie, Gicht, Hyperglykämie, Hyperkaliämie, Eisenmangel, Mangelernährung | ||
Psychiatrische Erkrankungen | |||
Häufig | Schlaflosigkeit | ||
Gelegentlich | Schlaflosigkeit, Verwirrtheitszustand, Depression, Neurose | ||
Erkrankungen des Nervensystems | |||
Sehr häufig | Periphere Neuropathie, Dysgeusie, Parästhesie | Schwindelgefühl | |
Häufig | Tremor, Neurotoxizität, Dysästhesie, cholinerges Syndrom, Kopfschmerzen, Schwindelgefühl | Cholinerges Syndrom, Dysgeusie | |
Gelegentlich | Krampfanfall, Hirnblutung, zerebrale Ischämie, ischämischer Schlaganfall, Anosmie, Ageusie, Gleichgewichtsstörung, Hypersomnie, Hypoästhesie, intellektuelle Behinderung, Lethargie, eingeschränktes Erinnerungsvermögen, Präsynkope, Synkope, transitorische ischämische Attacke | ||
Augenerkrankungen | |||
Häufig | Verschwommenes Sehen | ||
Gelegentlich | Augenreizung, verminderte Sehschärfe | ||
Erkrankungen des Ohrs und des Labyrinths | |||
Gelegentlich | Vertigo | ||
Herzerkrankungen | |||
Häufig | Tachykardie | Hypotonie | |
Gelegentlich | Angina pectoris, akuter Myokardinfarkt, Palpitationen | ||
Gefäßerkrankungen | |||
Häufig | Hypotension, thromboembolische Ereignisse | Lungenembolie, thromboembolische Ereignisse | |
Gelegentlich | Hypertonie, peripheres Kältegefühl, Hämatom, Phlebitis | ||
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |||
Häufig | Lungenembolie, Schluckauf, Dyspnoe, Epistaxis | Dyspnoe, Dysphonie | |
Gelegentlich | Schmerzen im Oropharynx, Husten, Hyperoxie, Nasenentzündung, Atelektase, Dysphonie, Pneumonitis | Hypoxie, interstitielle Lungenerkrankung (einschließlich Pneumonitis) | |
Erkrankungen des Gastrointestinaltrakts | |||
Sehr häufig | Diarrhoe, Übelkeit, Erbrechen, Abdominalschmerz/Beschwerden, Stomatitis | Diarrhoe, Erbrechen, | |
Häufig | Kolitis, Enterokolitis, Obstipation, Mundtrockenheit, Flatulenz, Bauch aufgetrieben, Dyspepsie, gastroösophageale Refluxerkrankung, Hämorrhoiden, Dysphagie | Kolitis, Hämorrhoiden | |
Gelegentlich | Gastrointestinale Toxizität, Duodenalobstruktion, anale Inkontinenz, aphthöses Geschwür, orale Dysästhesie, Mundschmerzen, Erkrankung der Zunge, Analfissur, Cheilitis angularis, Dyschezie, orale Parästhesie, Karies, Aufstoßen, Magenerkrankung, Gastritis, Zahnfleischerkrankung, Zahnfleischschmerz, Hämatochezie, Hyperästhesie der Zähne, paralytischer Ileus, Lippenschwellung, Mundulzeration, Ösophagusspasmus, Parodontopathie, Rektalblutung | Ösophagitis, Proktitis | |
Leber‑ und Gallenerkrankungen | |||
Häufig | Hyperbilirubinämie | Hypalbuminämie | |
Gelegentlich | Cholangitis, toxische Hepatitis, Cholestase, hepatische Zytolyse | ||
Erkrankungen der Haut und des Unterhautgewebes | |||
Sehr häufig | Alopezie | Alopezie | |
Häufig | Trockene Haut, palmar-plantares Erythrodysästhesiesyndrom, Ausschlag, Hauthyperpigmentierung | Pruritus | |
Gelegentlich | Pruritus, Hyperhidrose, bullöse Dermatitis, Dermatitis exfoliativa generalisiert, Erythem, Nageltoxizität, Papel, Petechien, Psoriasis, empfindliche Haut, Exfoliation der Haut, Hautläsion, Teleangiektasie, Urtikaria | Urtikaria, Ausschlag, Nagelverfärbung | |
Nicht bekannt | Erythem | ||
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |||
Häufig | muskuläre Schwäche, Myalgie, Muskelspasmen | ||
Gelegentlich | Arthralgie, Rückenschmerzen, Knochenschmerzen, Schmerzen in den Extremitäten, Polyarthritis | ||
Erkrankungen der Nieren und Harnwege | |||
Häufig | Akute Nierenschädigung | Akutes Nierenversagen | |
Gelegentlich | Nierenfunktionsstörung, Nierenversagen, Dysurie, Proteinurie | ||
Erkrankungen der Geschlechtsorgane und der Brustdrüse | |||
Gelegentlich | Vulvovaginale Trockenheit | ||
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |||
Sehr häufig | Asthenie, Schleimhautentzündung | Fieber, peripheres Ödem, Schleimhautentzündung, Asthenie | |
Häufig | Fieber, Ödem, Schüttelfrost | Reaktion in Zusammenhang mit der Infusion, Ödem | |
Gelegentlich | Unwohlsein, generelle Verschlechterung des physischen Gesundheitszustandes, Entzündung, Multiorgandysfunktionssyndrom, grippeähnliche Erkrankung, Thoraxschmerz nicht kardialen Ursprungs, Schmerzen in der Achselgegend, Brustkorbschmerzen, Hypothermie, Schmerz, aufgequollenes Gesicht, Temperaturintoleranz, Xerose | ||
Untersuchungen | |||
Sehr häufig | Gewicht erniedrigt | Gewicht erniedrigt | |
Häufig | Transaminasen (ALT und AST) erhöht, alkalische Phosphatase im Blut erhöht, Gamma-Glutamyltransferase erhöht, Kreatinin im Blut erhöht | Erhöhtes Bilirubin, Transaminasen (ALT und AST) erhöht, International Normalised Ratio (INR) erhöht | |
Gelegentlich | International Normalised Ratio (INR) erhöht, Gesamtprotein erniedrigt, renale Kreatininclearance vermindert, Elektrokardiogramm QT verlängert, Monozytenzahl erhöht, Troponin I erhöht | ||
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen | |||
Häufig | Reaktion in Zusammenhang mit der Infusion | ||
* | Ein seltenes Auftreten kann aufgrund der kleinen Stichprobengröße der Studie NAPOLI‑1 nicht geschätzt werden. | ||
Beschreibung ausgewählter Nebenwirkungen
Myelosuppression
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
Tödliche Ereignisse waren febrile Neutropenie oder Panzytopenie, die jeweils bei 0,3 % der Patienten im NALIRIFOX-Arm auftraten.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
Myelosuppression (Neutropenie/Leukopenie, Thrombozytopenie und Anämie) trat im ONIVYDE pegylated liposomal +5‑FU/LV-Studienarm häufiger als im 5‑FU/LV-Kontrollarm auf.
Neutropenie/Leukopenie
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
Leukopenie mit Grad 3 oder 4 trat bei 0,8 % der Patienten, die NALIRIFOX erhalten haben, auf.
In der NAPOLI-3 Studie, in der ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin/5-FU/LV (NALIRIFOX) mit Gemcitabin in Kombination mit Nab-Paclitaxel (Gem+NabP) verglichen wurde, zeigten die Sicherheitsdaten, dass der Gem+NabP-Arm eine höhere Inzidenz für Neutropenie aufwies. Neutropenie vom Grad 3 oder 4, erniedrigte Neutrophilenzahl und febrile Neutropenie traten bei 14,1 %, 9,7 % und bei 1,9 % der Patienten auf, die NALIRIFOX erhielten.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
Neutropenie/Leukopenie gehörten zu den wichtigsten beobachteten hämatologischen Toxizitäten. Neutropenie Grad 3 oder höher trat häufiger bei den mit ONIVYDE pegylated liposomal +5‑FU/LV behandelten Patienten (27,4 %) als bei den mit 5‑FU/LV behandelten Patienten (1,5 %) auf. Neutropenisches Fieber/Sepsis trat häufiger im Kombinationsarm ONIVYDE pegylated liposomal +5‑FU/LV [bei 4 Patienten (3,4 %)] als im Kontrollarm 5‑FU/LV [bei 1 Patient (0,7 %)] auf.
Die mediane Zeit bis zum Nadir für Neutropenie ≥ Grad 3 beträgt 23 (Bereich: 8-104) Tage nach der ersten Dosis der Behandlung mit ONIVYDE pegylated liposomal.
Thrombozytopenie
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
Thrombozytopenie vom Grad 3 oder 4 trat bei 0,5 % der Patienten auf, die NALIRIFOX erhielten.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
Thrombozytopenie Grad 3 und höher trat bei 2,6 % der Patienten, die mit ONIVYDE pegylated liposomal +5‑FU/LV behandelt wurden, und bei 0 % der mit 5‑FU/LV behandelten Patienten auf.
Anämie
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
Anämie vom Grad 3 oder 4 trat bei 7,3 % der Patienten auf, die NALIRIFOX erhielten.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
Anämie Grad 3 und höher trat bei 10,3 % der mit ONIVYDE pegylated liposomal +5‑FU/LV behandelten Patienten und bei 6,7 % der mit 5‑FU/LV behandelten Patienten auf.
Akutes Nierenversagen
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
In NAPOLI-3 traten Nierenfunktionsstörungen vom Grad 3 oder 4 bei 0,3 % der Patienten auf, Nierenversagen vom Grad 1 bis 4 trat bei 0,5 % der Patienten auf, darunter 0,3 % vom Grad 3 oder 4, akute Nierenschädigung vom Grad 1 bis 4 trat bei 1,1 % der Patienten auf, darunter 0,8 % vom Grad 3 oder 4 bei Patienten, die NALIRIFOX erhielten. Erhöhtes Kreatinin im Blut trat bei allen Graden 1 bis 4 bei 1,4 % der Patienten auf, davon 0,3 % vom Grad 3 oder 4, eine verminderte renale Kreatininclearance vom Grad 1 oder 2 trat bei 0,3 % der Patienten auf, die NALIRIFOX erhielten. Es gab einen Fall (0,3 %) von Nierenversagen im NALIRIFOX-Arm, der einen tödlichen Ausgang hatte.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
In NAPOLI-1 wurden Nierenfunktionsstörungen und akutes Nierenversagen beobachtet, gewöhnlich bei Patienten, bei denen aufgrund schwerer Übelkeit/schweren Erbrechens und/oder schwerer Diarrhoe ein Volumenmangel entstand. Akutes Nierenversagen wurde bei 6 von 117 Patienten (5,1 %) im ONIVYDE pegylated liposomal +5‑FU/LV-Studienarm beobachtet.
Diarrhoe und damit in Zusammenhang stehende Nebenwirkungen
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
In NAPOLI-3 zeigten die Sicherheitsdaten eine höhere Inzidenz von Diarrhoe im NALIRIFOX-Arm für alle Grade und für Grad 3 oder 4. Diarrhoe mit Grad 1 bis 4 trat bei 64,3 % der Patienten auf und Diarrhoe Grad 3 oder 4 trat bei 19,5 % der Patienten auf, die den NALIRIFOX-Arm erhielten. Auf cholinerge Reaktionen zurückzuführende Erscheinungen wie Rhinitis, Rhinorrhoe, Hypersalivation, Rötungen, Hitzewallung und verstärkte Tränensekretion wurden bei Patienten berichtet, die NALIRIFOX erhielten.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
In NAPOLI-1 trat Diarrhoe Grad 3 oder 4 bei 12,8 % der Patienten, die ONIVYDE pegylated liposomal +5‑FU/LV erhalten hatten, auf. Bei Patienten mit einer spät einsetzenden Diarrhoe betrug die Durchschnittszeit bis zum Einsetzen der späten Diarrhoe 8 Tage nach vorangegangener ONIVYDE pegylated liposomal-Dosis. Eine früh einsetzende Diarrhoe, in der Regel ≤ 24 Stunden nach Verabreichung der Dosis, kann auftreten und ist gewöhnlich vorübergehend. Früh einsetzende Diarrhoe kann von cholinergen Symptomen begleitet sein, wie Rhinitis, erhöhte Speichelbildung, Hitzegefühl, Diaphorese, Bradykardie, Miosis und Hyperperistaltik, die abdominale Krämpfe auslösen kann. Früh einsetzende Diarrhoe trat bei 29,9 % und cholinerge Ereignisse bei 3,4 % der Patienten auf, die ONIVYDE pegylated liposomal +5‑FU/LV erhalten hatten.
Infusionsreaktion
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
In NAPOLI-3 traten Reaktionen in Zusammenhang mit einer Infusion bei 1,4 % der Patienten auf, die NALIRIFOX erhielten. Alle Reaktionen waren leicht oder mittel (Grad 1 und 2).
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
In NAPOLI-1 wurden akute Infusionsreaktionen bei 6,8 % der Patienten im ONIVYDE pegylated liposomal +5‑FU/LV-Studienarm beobachtet.
Andere besondere Patientengruppen
Ältere Patienten
Insgesamt wurden keine größeren klinischen Unterschiede bezüglich der Sicherheit zwischen Patienten im Alter von ≥ 65 Jahren und Patienten im Alter von < 65 Jahren berichtet.
ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin:
In NAPOLI-3 betrug das mediane Alter 65 Jahre (im Bereich von 20 bis 85), 50,1 % der Patienten waren mindestens 65 Jahre alt, davon 6,9 % der Patienten 75 Jahre oder älter. Die Sicherheitsdaten nach Altersgruppen entsprachen den Daten des NALIRIFOX-Arms in der Gesamtpopulation.
ONIVYDE pegylated liposomal in Kombination mit 5-Fluorouracil und Leucovorin:
In NAPOLI‑1 wurde für Patienten zwischen ≥ 65 Jahren und < 65 Jahren, die mit ONIVYDE pegylated liposomal +5‑FU/LV behandelt wurden, eine höhere Rate an Behandlungsabbrüchen festgestellt (14,8 % vs. 7,9 %) und in einigen Fällen haben sich die Nebenwirkungen nicht zurückgebildet. Nebenwirkungen von Grad 3 oder höher sowie schwere behandlungsbedingte Nebenwirkungen traten häufiger bei Patienten im Alter von < 65 Jahren (84,1 % und 50,8 %) als bei Patienten im Alter von ≥ 65 Jahren (68,5 % und 44,4 %) auf. Im Gegenzug zeigten Patienten im Alter von > 75 Jahren (n=12) bei Behandlung mit ONIVYDE pegylated liposomal +5‑FU/LV in der Studie zu Adenokarzinomen des Pankreas häufiger schwere Nebenwirkungen, Dosisverzögerungen, Dosisreduktionen und Behandlungsabbrüche als Patienten im Alter von ≤ 75 Jahren (n=105).
Asiatische Patienten
In NAPOLI-1 wurde bei asiatischen Patienten im Vergleich zu Kaukasiern eine niedrigere Inzidenz von Diarrhoe [14 (19,2 %) von 73 Kaukasiern und 1 von 33 (3,3 %) Asiaten litten an Diarrhoe ≥ Grad 3], jedoch eine höhere Inzidenz und ein höherer Schweregrad von Neutropenie beobachtet. Bei Patienten, die ONIVYDE pegylated liposomal +5‑FU/LV erhalten hatten, war die Inzidenz von Neutropenie Grad 3 und höher unter den asiatischen Patienten [18 von 33 (55 %)] höher als unter den kaukasischen Patienten [13 von 73 (18 %)]. Über neutropenisches Fieber/neutropenische Sepsis wurde bei 6 % der asiatischen Patienten im Vergleich zu 1 % der kaukasischen Patienten berichtet. Dies stimmt mit der populationspharmakokinetischen Analyse überein, die bei Asiaten eine niedrigere Exposition gegenüber Irinotecan und eine höhere Exposition gegenüber seinem aktiven Metaboliten SN‑38 als bei Kaukasiern zeigte.
Patienten mit Leberfunktionsstörung
In klinischen Studien mit nicht‑liposomalem Irinotecan, das nach einem wöchentlichen Dosierungsschema verabreicht wurde, hatten Patienten mit mäßig erhöhtem Serumbilirubingesamtspiegel (1,0 bis 2,0 mg/dl) zur Baseline eine deutlich höhere Wahrscheinlichkeit einer Neutropenie Grad 3 oder 4 im ersten Zyklus als Patienten mit einem Bilirubinspiegel unter 1,0 mg/dl.
Patienten mit UGT1A1-Allel
Personen, die für das UGT1A1*28-Allel homozygot sind (Genotyp 7/7), unterliegen einem erhöhten Risiko für Neutropenie durch nicht‑liposomales Irinotecan. In NAPOLI-1 war die Häufigkeit von Neutropenie Grad 3 und höher bei diesen Patienten [2 von 7 (28,6 %)] ähnlich der Häufigkeit bei Patienten, die für das UGT1A1*28-Allel nicht homozygot waren und eine Anfangsdosis von ONIVYDE pegylated liposomal von 70 mg/m2 erhalten hatten [30 von 110 (27,3 %)] (siehe Abschnitt 5.1). Diese Beobachtung wurde in NAPOLI-3 nicht untersucht.
Untergewichtige Patienten (BMI < 18,5 kg/m2)
In NAPOLI-1 trat bei 5 von 8 untergewichtigen Patienten eine Nebenwirkung des Grades 3 oder 4 auf, in den meisten Fällen Myelosuppression, wobei 7 von 8 Patienten eine Dosisänderung, wie etwa eine Dosisverzögerung, eine Dosisreduktion oder eine Dosisunterbrechung, benötigten (siehe Abschnitt 4.4). Diese Beobachtung wurde in NAPOLI-3 nicht untersucht.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
In klinischen Studien wurde ONIVYDE pegylated liposomal in Dosen von bis zu 210 mg/m2 an Patienten mit verschiedenen Arten von Krebs verabreicht. Die Nebenwirkungen bei diesen Patienten waren ähnlich den Nebenwirkungen, die im Rahmen der empfohlenen Dosierung und des empfohlenen Behandlungsschemas berichtet wurden.
Es wurde über Überdosierungen mit nicht‑liposomalem Irinotecan berichtet, bei denen die Dosierung ungefähr zweimal so hoch wie die empfohlene therapeutische Dosis von Irinotecan war. Dies kann tödlich sein. Zu den wichtigsten berichteten Nebenwirkungen gehören schwere Neutropenie und schwere Diarrhoe.
Ein Antidot bei Überdosierung mit ONIVYDE pegylated liposomal ist nicht bekannt. Es sollten maximal mögliche unterstützende Therapiemaßnahmen ergriffen werden, um eine Dehydratation aufgrund von Diarrhoe zu verhindern und um infektiöse Komplikationen zu behandeln.
Pharmakotherapeutische Gruppe: Topoisomerase-I (TOP-I)-Inhibitoren, ATC‑Code: L01CE02
Wirkmechanismus
Der Wirkstoff von ONIVYDE pegylated liposomal ist Irinotecan (Topoisomerase‑I-Inhibitor), das in einem Liposom oder Vehikel mit Lipiddoppelschicht verkapselt ist.
Irinotecan ist ein Camptothecin-Derivat. Camptothecine sind spezifische Inhibitoren des Enzyms DNA-Topoisomerase‑I. Irinotecan und sein aktiver Metabolit SN‑38 binden reversibel an den Topoisomerase‑I-DNA-Komplex und induzieren Einzelstrang-DNA-Brüche, die die Replikationsgabel der DNA blockieren und für die Cytotoxizität verantwortlich sind. Irinotecan wird durch Carboxylesterase zu SN‑38 metabolisiert. SN‑38 hemmt ca. tausendmal stärker als Irinotecan eine aus menschlichen und Nagetier-Tumorzelllinien gereinigte Topoisomerase I.
Pharmakodynamische Wirkungen
ONIVYDE pegylated liposomal erhöhte in Tiermodellen die Plasmaspiegel von Irinotecan und verlängerte damit die Exposition gegenüber dem aktiven Metaboliten SN‑38 am Ort des Tumors.
Klinische Wirksamkeit und Sicherheit
NAPOLI-3:
Die Sicherheit und Wirksamkeit von ONIVYDE pegylated liposomal in Kombination mit Oxaliplatin, 5-Fluorouracil und Leucovorin (NALIRIFOX) wurde in NAPOLI-3, einer randomisierten, multizentrischen, offenen, aktiv-kontrollierten Studie, untersucht, die 770 Patienten mit metastasiertem Adenokarzinom des Pankreas einschloss, die zuvor keine Chemotherapie zur Behandlung von Metastasen erhalten hatten. Die Randomisierung wurde nach Region, Lebermetastasen und ECOG-Leistungsstatus vorgenommen. Die Patienten wurden randomisiert (1:1) einem der folgenden Behandlungsarme zugeteilt:
NALIRIFOX: ONIVYDE pegylated liposomal 50mg/m2 als intravenöse Infusion über 90 Minuten, gefolgt von einer intravenösen Infusion von Oxaliplatin 60 mg/m2 über 120 Minuten, gefolgt von Leucovorin 400 mg/m2 intravenös über 30 Minuten, gefolgt von 5-FU intravenös 2 400 mg/m2 über 46 Stunden, verabreicht alle 2 Wochen.
Gem+NabP: Nab-Paclitaxel 125 mg/m2 als intravenöse Infusion über 35 Minuten, gefolgt von Gemcitabin 1 000 mg/m2 intravenös über 30 Minuten am 1., 8., und 15. Tag eines jeden 28-Tage Zyklus.
Patienten, die homozygot für das UGT1A1*28 Allel sind, erhielten die gleiche Dosis ONIVYDE pegylated liposomal (50 mg/m2 ONIVYDE pegylated liposomal) und wurden engmaschig auf ihre Sicherheit überwacht.
Die Behandlung wurde bis zum Fortschreiten der Krankheit, definiert gemäß RECIST V1.1, oder bis zum Auftreten einer inakzeptablen Toxizität fortgesetzt. Die Bewertungen des Tumorstatus wurden zu Beginn (Baseline) und danach alle 8 Wochen vom Prüfarzt gemäß RECIST V1.1 durchgeführt.
Die wichtigsten Messgrößen für die Wirksamkeit waren das Gesamtüberleben (Overall Survival, OS), progressionsfreies Überleben (Progression Free Survival, PFS) und objektive Ansprechrate (Objective Response Rate, ORR).
Demografische Ausgangsdaten und Patientencharakteristika waren: medianes Alter 65 Jahre (Altersbereich 20-85); 50 % waren 65 Jahre oder älter; 56 % männlich; 83 % weiß; 5 % asiatisch; 3 % schwarz oder afroamerikanisch; ECOG-Performance-Status war 0 bei 43 % oder 1 bei 57 % der Patienten; 87 % Lebermetastasen.
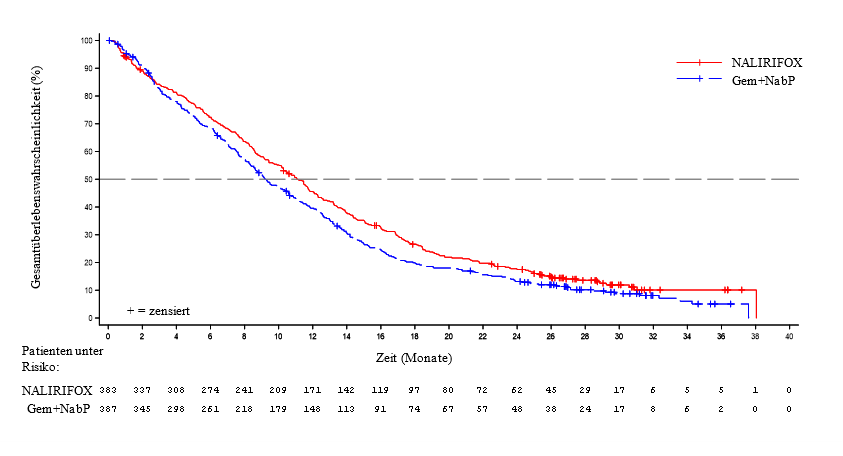
NAPOLI-3 zeigte eine statistisch signifikante Verbesserung des OS und PFS für den NALIRIFOX-Arm gegenüber dem Gem+NabP-Arm gemäß der ursprünglichen Stratendefinition im statistischen Analyseplan. Das mediane OS betrug 11,1 Monate (95% KI: 10,0, 12,1; HR 0,84 (95% KI: 0,71, 0,99); p=0,04) für den NALIRIFOX-Arm und 9,2 Monate (95% KI: 8,3, 10,6) für den Gem+NabP-Arm zum Zeitpunkt der finalen Analyse. Die Ergebnisse einer aktualisierten OS-Analyse sind in Tabelle 5 und Abbildung 1 (OS) dargestellt.
Tabelle 5: Wirksamkeitsergebnisse aus der klinischen Studie NAPOLI‑3
NALIRIFOX | Gem+NabP | ||
Aktualisiertes Gesamtüberleben (OS), cut-off = 03. Oktober 2023 | |||
Anzahl Todesfälle, n (%) | 328 (85,6) | 345 (89,1) | |
Medianes OS (Monate) | 11,1 | 9,2 | |
(95% Konfidenzintervall (KI)) | (10,0; 12,1) | (8,3; 10,6) | |
Hazard Ratio (95% KI) * | 0,85 (0,73; 0,99) | ||
Progressionsfreies Überleben (PFS), cut-off = 23. Juli 2022** | |||
Tod oder Progression, n (%) | 249 (65) | 259 (67) | |
Medianes PFS (Monate) | 7,4 | 5,6 | |
(95% Konfidenzintervall (KI)) | (6,0; 7,7) | (5,3; 5,8) | |
Hazard Ratio (95% KI) * | 0,70 (0,59; 0,84) | ||
p-Wert † | 0,0001 | ||
Objektive Ansprechrate (ORR), cut-off = 23. Juli 2022 | |||
ORR (95% KI) | 41,8 (36,8; 46,9) | 36,2 (31,4; 41,2) | |
CR, n (%) | 1 (0,3) | 1 (0,3) | |
PR, n (%) | 159 (41,5) | 139 (35,9) | |
NALIRIFOX= ONIVYDE pegylated liposomal +Oxaliplatin/5-Fluorouracil/Leucovorin; Gem+NabP=Gemcitabin+Nab-Paclitaxel | |||
* | Basierend auf dem stratifizierten Cox-Proportional-Hazard-Modell nach ECOG-Performance-Status, Region (Nordamerika, Ostasien und Rest der Welt) und Lebermetastasen | ||
** | Die Patienten wurden zensiert, wenn eine nachfolgende Krebstherapie eingeleitet oder die Zustimmung zur Studie zurückgezogen wurde, oder wenn die Nachuntersuchungen nicht mehr durchgeführt wurden, oder wenn 2 aufeinanderfolgende Tumorbeurteilungen verpasst wurden und danach ein Fortschreiten der Erkrankung oder der Tod eintrat. | ||
† | Basierend auf dem stratifizierten Log-Rank-Test. | ||
Abkürzungen: CR=complete response, PR=partial response; KI=Konfidenzintervall | |||
Abbildung 1: Kaplan-Meier Kurve für das aktualisierte Gesamtüberleben, cut-off = 03. Oktober 2023 in NAPOLI-3
NAPOLI-1:
Die Sicherheit und Wirksamkeit von ONIVYDE pegylated liposomal wurde in einer multinationalen, randomisierten, offenen, kontrollierten klinischen Studie (NAPOLI‑1) untersucht, in der zwei Behandlungsschemata für Patienten mit metastasiertem Adenokarzinom des Pankreas getestet wurden. Die Patienten hatten eine dokumentierte Progression der Erkrankung nach Behandlung mit Gemcitabin oder Gemcitabin-Kombinationstherapien. Die Studie beurteilte die klinische Wirksamkeit und Sicherheit einer ONIVYDE pegylated liposomal-Monotherapie bzw. von ONIVYDE pegylated liposomal +5‑FU/LV im Vergleich zu einem aktiven Kontrollarm mit 5‑FU/LV.
Patienten, die in den ONIVYDE pegylated liposomal +5‑FU/LV-Arm randomisiert wurden, erhielten alle zwei Wochen ONIVYDE pegylated liposomal 70 mg/m2 als intravenöse Infusion über 90 Minuten, gefolgt von LV 400 mg/m2 intravenös über 30 Minuten, gefolgt von 5‑FU 2 400 mg/m2 intravenös über 46 Stunden. Patienten mit homozygotem UGT1A1*28-Genotyp erhielten eine geringere Anfangsdosis ONIVYDE pegylated liposomal (siehe Abschnitt 4.2). Patienten, die in den 5‑FU/LV-Arm randomisiert wurden, erhielten an den Tagen 1, 8, 15 und 22 eines sechswöchigen Zyklus Leucovorin 200 mg/m2 intravenös über 30 Minuten, gefolgt von 5‑FU 2 000 mg/m2 intravenös über 24 Stunden. Patienten, die in die ONIVYDE pegylated liposomal-Monotherapie randomisiert wurden, erhielten alle 3 Wochen 100 mg/m2 als intravenöse Infusion über 90 Minuten.
Die wichtigsten Einschlusskriterien für Patienten mit metastasiertem Adenokarzinom des Pankreas in der klinischen Studie NAPOLI‑1 waren ein Karnofsky-Index (Karnofsky Performance Status, KPS) von ≥ 70, ein normaler Bilirubinspiegel, ein Transaminaseanstieg um ≤ 2,5 x ULN bzw. ≤ 5 x ULN bei Patienten mit Lebermetastasen und ein Albuminwert von ≥ 3,0 g/dl.
Insgesamt wurden 417 Patienten in die Studienarme ONIVYDE pegylated liposomal +5‑FU/LV (N=117), ONIVYDE pegylated liposomal-Monotherapie (N=151) und 5‑FU/LV (N=149) randomisiert. Patientendemographie und Krankheitsmerkmale bei Studieneintritt waren zwischen allen Studienarmen ausgewogen.
In der Intent‑to‑treat-Population (randomisiert) betrug das mediane Alter 63 Jahre (Altersbereich 31‑87 Jahre), 57 % waren Männer, 61 % waren Kaukasier und 33 % Asiaten. Zur Baseline betrug der durchschnittliche Albuminwert 3,6 g/dl und der Karnofsky-Index 90‑100 bei 55 % der Patienten. Die Patienten zeigten folgende Krankheitsmerkmale: 68 % wiesen Lebermetastasen und 31 % Lungenmetastasen auf, 12 % hatten zuvor keine Therapielinien bei metastasierter Erkrankung, 56 % hatten zuvor 1 Therapielinie bei metastasierter Erkrankung, 32 % hatten zuvor mindestens 2 Therapielinien bei Metastasen.
Die Patienten wurden bis zur Progression der Erkrankung oder bis zu unzumutbarer Toxizität behandelt. Primärer Endpunkt war das Gesamtüberleben (Overall survival, OS). Zusätzliche Endpunkte waren progressionsfreies Überleben (Progression free survival, PFS) und objektive Ansprechrate (Objective response rate, ORR). Die Ergebnisse sind in Tabelle 6 dargestellt. Das Gesamtüberleben ist in Abbildung 2 dargestellt.
Tabelle 6: Wirksamkeitsergebnisse aus der klinischen Studie NAPOLI‑1
ONIVYDE pegylated liposomal +5‑FU/LV | 5‑FU/LV | ||
Gesamtüberleben1 | |||
Anzahl Todesfälle, n (%) | 75 (64) | 80 (67) | |
Medianes OS (Monate) | 6,1 | 4,2 | |
(95 % Konfidenzintervall (KI)) | (4,8; 8,9) | (3,3; 5,3) | |
Hazard Ratio (95 % KI)3 | 0,67 (0,49‑0,92) | ||
p‑Wert4 | 0,0122 | ||
Progressionsfreies Überleben1,2 | |||
Tod oder Progression, n (%) | 83 (71) | 92 (77) | |
Medianes PFS (Monate) | 3,1 | 1,5 | |
(95 % KI) | (2,7; 4,2) | (1,4; 1,8) | |
Hazard Ratio (95 % KI)3 | 0,56 (0,41‑0,75) | ||
p‑Wert4 | 0,0001 | ||
Objektive Ansprechrate2 | |||
N | 19 | 1 | |
ORR (%) | 16,2 | 0,8 | |
95 % KI der Rate5 | 9,6; 22,9 | 0,0; 2,5 | |
Differenz in der Rate (95 % KI)5 | 15,4 (8,5; 22,3) | ||
p‑Wert6 | < 0,0001 | ||
1 | Median ist der Kaplan-Meier-Schätzer für die mediane Überlebenszeit | ||
2 | Gemäß RECIST-Richtlinien, Version 1.1. | ||
3 | Cox-Modell-Analyse | ||
4 | Unstratifizierter Log‑rank-Test | ||
5 | Basierend auf Normalannäherung | ||
6 | Exakter Test nach Fisher | ||
Abkürzungen: 5‑FU/LV=5‑Fluorouracil/Leucovorin; KI=Konfidenzintervall | |||
Abbildung 2: Kaplan-Meier Kurve für das Gesamtüberleben in NAPOLI-1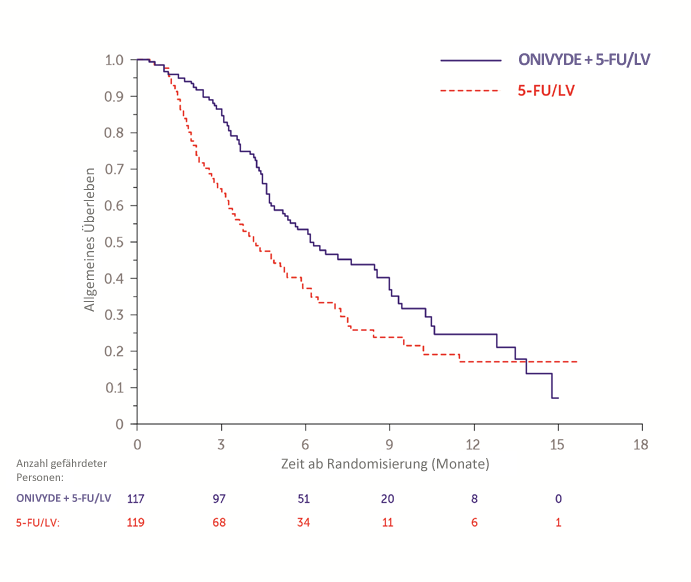
Bei der begrenzten Anzahl an Patienten mit vorheriger Exposition gegenüber nicht‑liposomalem Irinotecan wurde der Nutzen von ONIVYDE pegylated liposomal nicht nachgewiesen.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für ONIVYDE pegylated liposomal eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen in der Behandlung von Pankreaskrebs gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Resorption
Die Liposom-Einkapselung von Irinotecan verlängert die Zirkulation und begrenzt die Verteilung im Verhältnis zu jenen von nicht‑liposomalem Irinotecan.
Die Plasma-Pharmakokinetik von Irinotecan gesamt und SN‑38 gesamt wurde bei 1058 Krebspatienten, die ONIVYDE pegylated liposomal als Monotherapie oder im Zuge einer Kombinationschemotherapie in Dosen zwischen 35 und 155 mg/m² erhielten, anhand einer populationspharmakokinetischen Analyse untersucht. Die pharmakokinetischen Eigenschaften von Irinotecan gesamt und der SN‑38-Analyten nach einer Anwendung von 70 mg/m² ONIVYDE pegylated liposomal als Monotherapie oder als Teil einer Kombinationschemotherapie und 50 mg/m2 im NALIRIFOX Regimen (ONIVYDE pegylated liposomal/Oxaliplatin/5-FU/LV) sind in Tabelle 7 dargestellt.
Tabelle 7: Zusammenfassung des geometrischen Mittels (geometrischer CV) Irinotecan gesamt und SN‑38 gesamt
Anfangsdosis (mg/m2) | Deskriptive | Irinotecan gesamt | SN-38 gesamt | |||
Cmax | AUCSS | t1/2 | Cmax | AUCSS | ||
50* | N | 360 | 360 | 360 | 360 | 360 |
Geometrisches Mittel | 25,1 | 37,8 | 1,93 | 2,09 | 12,1 | |
Geometrischer CV (%) | 18,5 | 73,6 | 14 | 42,1 | 46,6 | |
70** | N | 116 | 116 | 116 | 116 | 116 |
Geometrisches Mittel | 29,0 | 46,6 | 1,91 | 2,50 | 14,5 | |
Geometrischer CV (%) | 17,6 | 60,3 | 8,4 | 57,3 | 45,0 | |
AUCSS: | Area under the plasma concentration curve at steady-state (Fläche unter der Konzentrations-Zeit-Kurve bei steady-state) für 2 Wochen | |||||
t1/2: | Terminale Eliminationshalbwertszeit | |||||
Cmax = | maximale Plasmakonzentration | |||||
CV = | coefficient of variation (Variationskoeffizient) | |||||
* | ONIVYDE pegylated liposomal/Oxaliplatin/5-FU/Leucovorin (NAPOLI-3) | |||||
** | ONIVYDE pegylated liposomal/5-FU/Leucovorin (NAPOLI-1) | |||||
Verteilung
Direkte Messungen von liposomalem Irinotecan zeigen, dass Irinotecan während der Zirkulation zu 95 % im Liposom verkapselt bleibt. Nicht‑liposomales Irinotecan zeigte ein größeres Verteilungsvolumen (138 l/m2). Das Verteilungsvolumen von ONIVYDE pegylated liposomal ist 4 L (aus der pharmakokinetischen Analyse der Population ermittelt). Dies deutet darauf hin, dass ONIVYDE pegylated liposomal größtenteils auf vaskuläre Flüssigkeit begrenzt ist.
ONIVYDE pegylated liposomal bindet sich nur unwesentlich an Plasmaproteine (< 0,44 % von Irinotecan gesamt in ONIVYDE pegylated liposomal). Nicht‑liposomales Irinotecan bindet sich mäßig an Plasmaproteine (30 % bis 68 %) und SN‑38 bindet sich stark an menschliche Plasmaproteine (ungefähr 95 %).
Biotransformation
Irinotecan, das aus der Liposom-Verkapselung freigesetzt wird, folgt einer ähnlichen Verstoffwechselung wie bei nicht‑liposomalem Irinotecan berichtet.
Irinotecan wird durch Carboxylesterasen-Enzyme in den aktiven Metaboliten SN‑38 überführt. In‑vitro-Studien lassen darauf schließen, dass Irinotecan, SN‑38 und der Metabolit Aminopentancarbonsäure (APC) die Cytochrom‑P450-Isoenzyme nicht hemmen. SN‑38 wird anschließend in erster Linie von dem Enzym UDP-Glucuronosyltransferase 1A1 (UGT1A1) zu einem glukuronidierten Metaboliten konjugiert. Die UGT1A1-Aktivität ist bei Personen mit genetischen Polymorphismen, die die Enzymaktivität reduzieren, wie zum Beispiel dem UGT1A1*28-Polymorphismus, reduziert. In der populationspharmakokinetischen Analyse wurde kein signifikanter Zusammenhang zwischen dem UGT1A1*28-Polymorphismus (7/7 homozygot (8%) vs. nicht 7/7 homozygot) und der SN-38-Clearance festgestellt.
Elimination
Die Disposition von ONIVYDE pegylated liposomal und nicht‑liposomalem Irinotecan ist beim Menschen noch nicht vollständig untersucht.
Nicht‑liposomales Irinotecan wird zu 11 % bis 20 % über den Urin ausgeschieden; SN‑38 zu < 1 % und SN‑38-Glukuronid zu 3 %. Bei einer Anwendung von nicht-liposomalem Irinotecan an zwei Patienten betrug nach einem Zeitraum von 48 Stunden die kumulative Ausscheidung von Irinotecan und seinen Metaboliten (SN‑38 und SN‑38-Glukuronid) über die Galle und den Urin ungefähr 25 % (100 mg/m2) bis 50 % (300 mg/m2).
Nierenfunktionsstörung
Es wurde keine pharmakokinetische Studie bei Patienten mit Nierenfunktionsstörung durchgeführt. Die Kreatininclearance wurde nicht als eine signifikante Einflussgröße für die SN‑38 Clearance identifiziert. Es lagen keine hinreichenden Daten zu Patienten mit schwerer Nierenfunktionsstörung (ClKr < 30 ml/min) vor, um die Auswirkungen auf die Pharmakokinetik beurteilen zu können (siehe Abschnitte 4.2 und 4.4).
Leberfunktionsstörung
Es wurde keine pharmakokinetische Studie bei Patienten mit Leberfunktionsstörung durchgeführt. In einer populationspharmakokinetischen Studie wurde ein erhöhter Bilirubinspiegel mit einer niedrigeren SN-38 Clearance assoziiert. Ein Bilirubinlevel von 1,14 mg/dl (95. Perzentile der Gesamtpopulation) führt zu einer Erhöhung der SN-38 AUC um 32 % im Vergleich zum medianen Bilirubinlevel von 0,44 mg/dl (von den 1055 Patienten, die in diesem Modell betrachtet wurden, hatten 54 Bilirubinlevel ≥ 1,14 mg/dl). Es liegen keine Daten zu Patienten mit einem Bilirubinlevel von mehr als 2,8 mg/dl vor. Erhöhte ALT/AST-Konzentrationen hatten keinen Effekt auf die SN‑38 Gesamtkonzentration. Zu Patienten mit einem Gesamtbilirubin von mehr als 2 x ULN stehen keine Daten zur Verfügung.
Andere besondere Patientengruppen
Alter und Geschlecht
Die populationspharmakokinetische Analyse von Patienten im Alter von 20 bis 87 Jahren, von denen 11 % in früheren Studien und 6,9 % in NAPOLI-3 ≥ 75 Jahre alt waren, weist darauf hin, dass das Alter keine klinisch bedeutenden Auswirkungen auf die Exposition gegenüber Irinotecan und SN‑38 hat.
Das Geschlecht erwies sich als signifikante Einflussgröße in der Analyse der pharmakokinetischen Population mit einem Anstieg der Irinotecan AUC um 28 % und einem klinisch bedeutenden SN-38 AUC Anstieg von 38 % bei Frauen, wenn nicht an andere Einflussgrößen angepasst wurde.
Ethnische Zugehörigkeit
Die Analyse der pharmakokinetischen Population zeigt, dass die Irinotecan AUC bei Teilnehmern mit asiatischer Herkunft um 32 % niedriger ist, was klinisch bedeutsam ist, als bei Teilnehmern anderer Ethnien.
Pharmakokinetische/pharmakodynamische Zusammenhänge
NAPOLI-3:
In der Expositions-Sicherheits-Analyse, die sich auf die Daten von 360 Probanden aus der NAPOLI-3-Studie konzentriert, die mit 50 mg/m2 ONIVYDE pegylated liposomal in Kombination mit 5-FU, LV und Oxaliplatin behandelt wurden, schien sich die Wahrscheinlichkeit für Diarrhoe vom Grad 3 und höher oder Neutropenie vom Grad 3 oder höher bei zunehmender Exposition sowohl von Irinotecan als auch SN-38 zu erhöhen. Die Beziehung zwischen Exposition und Wirksamkeit erwies sich als statistisch nicht signifikant.
NAPOLI-1:
Die Analyse gepoolter Daten von 353 Patienten zeigte, dass bei einer höheren SN‑38-Plasma‑Cmax die Wahrscheinlichkeit einer Neutropenie höher war. Bei einer höheren Plasma‑Cmax von Irinotecan gesamt war die Wahrscheinlichkeit einer Diarrhoe höher.
In NAPOLI-1, waren höhere Plasmakonzentrationen von Irinotecan gesamt und SN‑38 bei Patienten im ONIVYDE pegylated liposomal +5‑FU/LV-Behandlungsarm mit längerem OS und PFS sowie einer höheren ORR (objektive Ansprechrate) assoziiert.
In Einfach‑ und Mehrfachdosis‑Toxizitätsstudien an Mäusen, Ratten und Hunden waren die Zielorgane der Toxizität der Gastrointestinaltrakt und das hämatologische System. Die Intensität dieser Wirkungen war dosisabhängig und reversibel. Der NOAEL-Wert bei Ratten und Hunden nach intravenöser Infusion von ONIVYDE pegylated liposomal über 90 Minuten einmal alle 3 Wochen über einen Zeitraum von 18 Wochen betrug 155 mg/m2.
In pharmakologischen Sicherheitsstudien bei Hunden hatte ONIVYDE pegylated liposomal in Dosen von bis zu 18 mg/kg oder 360 mg/m2 keine Auswirkungen auf die kardiovaskulären, hämodynamischen, elektrokardiographischen oder respiratorischen Parameter. In den Mehrfachdosis-Toxizitätsstudien an Ratten gab es keine Befunde, die auf eine Toxizität im Zusammenhang mit dem ZNS hinweisen.
Genotoxische Wirkung und karzinogenes Potenzial
Mit ONIVYDE pegylated liposomal wurden keine Studien zur Genotoxizität durchgeführt. Nicht‑liposomales Irinotecan und SN‑38 erwiesen sich im In‑vitro-Chromosomenaberrationstest bei CHO-Zellen sowie im In‑vivo-Mikronukleustest bei Mäusen als genotoxisch. Bei anderen klinischen Studien mit Irinotecan hat sich jedoch im Ames-Test kein mutagenes Potential gezeigt.
Mit ONIVYDE pegylated liposomal wurden keine Studien zur Karzinogenität durchgeführt. Bei Ratten, die über einen Zeitraum von 13 Wochen einmal pro Woche eine maximale Dosis von nicht‑liposomalem Irinotecan von 150 mg/m² erhielten, wurden 91 Wochen nach Ende der Behandlung keine behandlungsbedingten Tumore berichtet. Unter diesen Bedingungen bestand eine signifikante lineare Tendenz bei der Dosis für die kombinierte Inzidenz von Polypen des Uterushornes des Endometriumstroma und Sarkomen des Endometriumstroma. Aufgrund des Wirkmechanismus gilt Irinotecan als potenziell karzinogen.
Reproduktionstoxizität
Mit ONIVYDE pegylated liposomal wurden keine Studien zur Reproduktions‑ und Entwicklungstoxizität durchgeführt.
Nicht‑liposomales Irinotecan erwies sich bei Ratten und Kaninchen in Dosierungen unterhalb der therapeutischen Dosis für Menschen als teratogen. Jungtiere von behandelten Ratten und mit externen Anomalitäten zeigten eine verminderte Fertilität. Dies wurde bei morphologisch normalen Jungtieren nicht beobachtet. Bei trächtigen Ratten verringerte sich das Gewicht der Plazenta und die Nachkommen zeigten eine verminderte fetale Lebensfähigkeit sowie vermehrte Verhaltensauffälligkeiten.
Nicht‑liposomales Irinotecan führte nach täglichen Mehrfachdosen von 20 mg/kg bzw. 0,4 mg/kg zu Atrophien der Fortpflanzungsorgane von Männchen sowohl bei Ratten als auch bei Hunden. Diese Wirkungen waren nach Beenden der Behandlung reversibel.
Vesikelbildende Lipide
Colfoscerilstearat (DSPC)
Cholesterol
α‑{2‑[1,2-Distearoyl-sn-glycero(3)phosphooxy]ethylcarbamoyl}-ω‑methoxypoly(oxyethylen)-2000 (MPEG‑2000‑DSPE)
Sonstige Bestandteile
Sucrosofat
2‑[4‑(2‑Hydroxyethyl)piperazin‑1‑yl]ethansulfonsäure (HEPES Puffer)
Natriumchlorid
Wasser für Injektionszwecke
ONIVYDE pegylated liposomal darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
Ungeöffnete Durchstechflasche
3 Jahre
Nach der Verdünnung
Die chemische und physikalische Stabilität der verdünnten Infusionsdispersion wurde bei 15 ‑ 25 °C für bis zu 6 Stunden oder im Kühlschrank (2 °C ‑ 8 °C) für bis zu 24 Stunden nachgewiesen.
Aus mikrobiologischer Sicht sollte das Arzneimittel unmittelbar verwendet werden. Wenn es nicht unmittelbar verwendet wird, liegen die Lagerungsdauer und ‑bedingungen nach dem Öffnen in der Verantwortung des Anwenders.
Im Kühlschrank lagern (2 °C ‑ 8 °C).
Nicht einfrieren.
Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
Durchstechflasche aus Typ‑I-Glas mit grauem Chlorbutyl-Stopfen und Aluminium-Versiegelung mit Flip‑off-Schnappdeckel; sie enthält 10 ml Konzentrat.
Jede Packung enthält eine Durchstechflasche.
ONIVYDE pegylated liposomal ist ein cytotoxisches Arzneimittel und sollte mit Vorsicht gehandhabt werden. Das Tragen von Handschuhen, Schutzbrille und Schutzkleidung wird bei der Handhabung oder Anwendung von ONIVYDE pegylated liposomal empfohlen. Wenn die Dispersion mit der Haut in Berührung kommt, die Haut sofort gründlich mit Wasser und Seife waschen. Wenn die Dispersion mit Schleimhäuten in Berührung kommt, diese sofort gründlich mit Wasser spülen. Schwangere Mitarbeiter sollten ONIVYDE pegylated liposomal aufgrund der cytotoxischen Eigenschaften des Arzneimittels nicht handhaben.
Vorbereitung der Dispersion und Verabreichung
ONIVYDE pegylated liposomal wird als sterile liposomale Dispersion mit einer Konzentration von 4,3 mg/ml geliefert und muss vor Anwendung unter Verwendung einer Nadel mit einer Stärke von höchstens 21 Gauge verdünnt werden. Mit einer 5%igen Glucoselösung oder isotonischen Natriumchloridlösung (0,9 %) für Injektionszwecke soweit verdünnen, dass die entsprechende Dosis ONIVYDE pegylated liposomal in einem endgültigen Volumen von 500 ml gelöst ist. Die verdünnte Dispersion vorsichtig durch Umdrehen mischen. Die verdünnte Dispersion ist klar bis leicht weiß bis leicht opaleszent und frei von sichtbaren Partikeln.
In der Erstlinienbehandlung erwachsener Patienten mit metastasiertem Adenokarzinom des Pankreas, sollte ONIVYDE pegylated liposomal vor Oxaliplatin verabreicht werden, gefolgt von LV, gefolgt von 5-FU.
Bei der Behandlung von erwachsenen Patienten mit metastasiertem Adenokarzinom des Pankreas, deren Erkrankung unter einer Gemcitabin‑basierten Therapie fortgeschritten ist, muss ONIVYDE pegylated liposomal vor LV verabreicht werden, gefolgt von 5‑FU. ONIVYDE pegylated liposomal darf nicht als Bolusinjektion oder unverdünnte Dispersion verabreicht werden.
Die Vorbereitung der Infusion muss unter sterilen Bedingungen erfolgen. ONIVYDE pegylated liposomal ist nur zum einmaligen Gebrauch bestimmt.
Es sollte darauf geachtet werden, dass ein Extravasat vermieden wird, und die Infusionsstelle sollte auf Anzeichen einer Entzündung überwacht werden. Sollte es zu einem Extravasat kommen, wird empfohlen, die Stelle mit isotonischer Natriumchloridlösung (0,9 %) für Injektionszwecke und/oder sterilem Wasser zu spülen und mit Eis zu kühlen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Frankreich
EU/1/16/1130/001
Datum der Erteilung der Zulassung: 14. Oktober 2016
Datum der letzten Verlängerung der Zulassung: 16. Juli 2021
September 2024
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
Servier Deutschland GmbH
Elsenheimerstr. 53
D-80687 München
Tel: +49 (0)89 57095-01
Fax: +49 (0)89 57095-126
E-mail: info-de@servier.com