Steglatro® 5 mg Filmtabletten
Steglatro® 15 mg Filmtabletten
Steglatro 5 mg Filmtabletten
Jede Tablette enthält Ertugliflozin-Pidolsäure, entsprechend 5 mg Ertugliflozin.
Sonstiger Bestandteil mit bekannter Wirkung
Jede Tablette enthält 28 mg Lactose (als Monohydrat).
Steglatro 15 mg Filmtabletten
Jede Tablette enthält Ertugliflozin-Pidolsäure, entsprechend 15 mg Ertugliflozin.
Sonstiger Bestandteil mit bekannter Wirkung
Jede Tablette enthält 85 mg Lactose (als Monohydrat).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette (Tablette)
Steglatro 5 mg Filmtabletten
Rosa, 6,4 x 6,6 mm große, dreieckige Filmtabletten mit der Prägung „701“ auf einer Seite und glatt auf der anderen Seite.
Steglatro 15 mg Filmtabletten
Rote, 9,0 x 9,4 mm große, dreieckige Filmtabletten mit der Prägung „702“ auf einer Seite und glatt auf der anderen Seite.
Steglatro ist zur Behandlung von Erwachsenen mit unzureichend kontrolliertem Typ‑2 Diabetes mellitus als Ergänzung zu Diät und Bewegung angezeigt:
Als Monotherapie, wenn Metformin aufgrund von Unverträglichkeit oder Gegenanzeigen nicht geeignet ist.
Zusätzlich zu anderen Arzneimitteln zur Behandlung von Diabetes.
Zu Studienergebnissen im Hinblick auf die Kombinationen von Therapien, die Wirkung auf die Blutzuckerkontrolle, die kardiovaskulären Ereignisse und die untersuchten Populationen, siehe Abschnitte 4.4, 4.5 und 5.1.
Dosierung
Die empfohlene Anfangsdosis für Ertugliflozin beträgt 5 mg einmal täglich. Sofern eine zusätzliche Blutzuckersenkung notwendig ist, kann die Dosis bei Patienten, die 5 mg Ertugliflozin einmal täglich vertragen, auf 15 mg einmal täglich erhöht werden.
Wenn Ertugliflozin in Kombination mit Insulin oder mit einem Insulin-Sekretagogum (einem Arzneimittel zur Anregung der Insulinsekretion) angewendet wird, kann es notwendig sein, die Dosis des Insulins oder des Insulin-Sekretagogums zu verringern, um das Risiko einer Hypoglykämie zu reduzieren (siehe Abschnitte 4.4, 4.5 und 4.8).
Bei Patienten mit einer Hypovolämie wird empfohlen, diese vor Beginn der Behandlung mit Ertugliflozin entsprechend zu korrigieren (siehe Abschnitt 4.4).
Ausgelassene Dosis
Falls eine Einnahme vergessen wurde, sollte diese nachgeholt werden, sobald der Patient daran denkt. Die Patienten sollten nicht die doppelte Dosis Steglatro am selben Tag einnehmen.
Besondere Patientengruppen
Eingeschränkte Nierenfunktion
Die Überprüfung der Nierenfunktion wird vor Beginn der Behandlung mit Steglatro und in regelmäßigen Abständen danach empfohlen (siehe Abschnitt 4.4).
Der Beginn einer Behandlung mit diesem Arzneimittel wird bei Patienten mit einer geschätzten glomerulären Filtrationsrate (eGFR) unter 45 ml/min/1,73 m2 oder einer Kreatinin-Clearance (CrCl) unter 45 ml/min nicht empfohlen (siehe Abschnitt 4.4).
Bei Patienten mit einer eGFR ≥ 45 bis < 60 ml/min/1,73 m2 sollte eine Steglatro Behandlung mit 5 mg begonnen und zur Blutzuckerkontrolle bei Bedarf auf 15 mg hochtitriert werden.
Da die blutzuckersenkende Wirkung von Ertugliflozin bei Patienten mit moderater Einschränkung der Nierenfunktion verringert und bei Patienten mit schwerer Einschränkung der Nierenfunktion wahrscheinlich nicht vorhanden ist, sollte, falls eine weitere Blutzuckerkontrolle erforderlich ist, die zusätzliche Gabe anderer antihyperglykämischer Arzneimittel in Betracht gezogen werden (siehe Abschnitt 4.4).
Bei einer eGFR anhaltend unter 30 ml/min/1,73 m2 oder einer CrCl anhaltend unter 30 ml/min sollte die Behandlung mit Steglatro abgebrochen werden.
Steglatro sollte bei Patienten mit schwerer Einschränkung der Nierenfunktion, mit terminaler Niereninsuffizienz (end stage renal disease, ESRD) oder bei dialysepflichtigen Patienten nicht angewendet werden, da keine klinischen Daten vorliegen, welche die Wirksamkeit bei diesen Patienten belegen.
Eingeschränkte Leberfunktion
Bei Patienten mit leichter oder moderater Einschränkung der Leberfunktion ist eine Dosisanpassung für Ertugliflozin nicht erforderlich. Die Anwendung von Ertugliflozin wurde bei Patienten mit schwerer Einschränkung der Leberfunktion nicht untersucht und wird für diese Patienten nicht empfohlen (siehe Abschnitt 5.2).
Ältere Patienten
Eine altersabhängige Dosisanpassung für Ertugliflozin wird nicht empfohlen. Die Nierenfunktion und das Risiko einer Hypovolämie sollten beachtet werden (siehe Abschnitte 4.4 und 4.8).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Ertugliflozin bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Steglatro sollte einmal täglich am Morgen unabhängig von den Mahlzeiten eingenommen werden. Bei Schluckbeschwerden kann die Tablette zerteilt oder zermahlen werden, da es sich um eine Darreichungsform mit sofortiger Wirkstofffreisetzung handelt.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Allgemeines
Steglatro sollte nicht bei Patienten mit Typ‑1 Diabetes mellitus angewendet werden. Es kann das Risiko einer diabetischen Ketoazidose (DKA) bei diesen Patienten erhöhen.
Hypotonie/Hypovolämie
Ertugliflozin verursacht eine osmotische Diurese, die zu einem intravaskulären Volumenmangel führen kann. Demzufolge kann eine symptomatische Hypotonie nach Beginn der Behandlung mit Steglatro (siehe Abschnitt 4.8), insbesondere bei Patienten mit eingeschränkter Nierenfunktion (eGFR unter 60 ml/min/1,73 m2 oder CrCl unter 60 ml/min), bei älteren Patienten (≥ 65 Jahre), bei Patienten, die Diuretika einnehmen, oder bei Patienten unter Antihypertonika mit einer Hypotonie in der Vorgeschichte, auftreten. Vor Beginn der Behandlung mit Steglatro sollte der Volumenstatus überprüft und, sofern angezeigt, korrigiert werden. Die Patienten sind auf entsprechende Anzeichen und Symptome einer Hypotonie/Hypovolämie nach Therapiebeginn zu überwachen.
Aufgrund des Wirkmechanismus induziert Ertugliflozin eine osmotische Diurese und führt zu einem Anstieg des Serumkreatinins und einer Abnahme der eGFR. Anstieg des Serumkreatinins und Abnahme der eGFR waren bei Patienten mit moderater Einschränkung der Nierenfunktion stärker ausgeprägt (siehe Abschnitt 4.8).
Im Fall von Erkrankungen, die zu einem Flüssigkeitsverlust führen können (z. B. gastrointestinale Erkrankungen), wird empfohlen, die Patienten, die Ertugliflozin erhalten, sorgfältig hinsichtlich ihres Volumenstatus (z. B. körperliche Untersuchung, Blutdruckmessung, Laboruntersuchungen einschließlich Bestimmung des Hämatokriten) und ihrer Elektrolytwerte zu überwachen. Eine vorübergehende Unterbrechung der Behandlung mit Ertugliflozin sollte in Betracht gezogen werden, bis der Flüssigkeitsverlust korrigiert wurde.
Diabetische Ketoazidose
Seltene Fälle von DKA, einschließlich lebensbedrohlicher und tödlicher Fälle, wurden in klinischen Studien und nach Markteinführung bei Patienten berichtet, die eine Behandlung mit Natrium-Glucose-Co-Transporter 2(SGLT2)-Inhibitoren einschließlich Ertugliflozin erhielten. In einer Reihe von Fällen zeigte sich ein untypisches Krankheitsbild mit nur mäßig erhöhtem Blutzuckerspiegel unter 14 mmol/l (250 mg/dl). Ob eine DKA mit größerer Wahrscheinlichkeit bei höheren Dosen von Ertugliflozin auftritt, ist nicht bekannt.
Das Risiko einer DKA muss beim Auftreten von unspezifischen Symptomen wie Übelkeit, Erbrechen, Anorexie, Bauchschmerzen, übermäßigem Durst, Schwierigkeiten beim Atmen, Verwirrtheit, ungewöhnlicher Müdigkeit oder Schläfrigkeit in Betracht gezogen werden. Unabhängig vom Blutzuckerspiegel sollten Patienten beim Auftreten dieser Symptome unverzüglich auf eine Ketoazidose hin untersucht werden.
Bei Patienten, bei denen ein Verdacht auf eine DKA besteht oder eine DKA diagnostiziert wurde, ist die Behandlung mit Ertugliflozin sofort abzusetzen.
Die Behandlung sollte bei Patienten unterbrochen werden, die aufgrund größerer chirurgischer Eingriffe oder akuter schwerer Erkrankungen in ein Krankenhaus kommen. Bei diesen Patienten wird eine Überwachung der Ketonkörperkonzentration empfohlen. Die Ermittlung der Ketonkörperkonzentration im Blut ist der Ermittlung der Konzentration im Urin vorzuziehen. Die Behandlung mit Ertugliflozin kann erneut aufgenommen werden, wenn die Ketonkörperkonzentration normal ist und der Zustand des Patienten sich stabilisiert hat.
Vor Beginn einer Behandlung mit Ertugliflozin sind Faktoren in der Anamnese des Patienten, die ihn für eine Ketoazidose prädisponieren könnten, abzuwägen.
Zu den Patienten, für die ein erhöhtes Risiko einer DKA bestehen könnte, gehören Patienten mit einer geringen Funktionsreserve der Beta-Zellen (z. B. Patienten mit Typ‑2 Diabetes und niedrigem C‑Peptid oder latentem Autoimmundiabetes bei Erwachsenen [LADA] oder Patienten mit anamnestisch bekannter Pankreatitis), Patienten mit Erkrankungen, die zu eingeschränkter Nahrungsaufnahme oder schwerer Dehydratation führen, Patienten, bei denen die Insulindosis herabgesetzt wird, und Patienten mit erhöhtem Insulinbedarf infolge einer akuten Krankheit, einer Operation oder Alkoholmissbrauchs. Bei diesen Patienten sind SGLT2-Inhibitoren mit Vorsicht anzuwenden.
Die Wiederaufnahme der Behandlung mit einem SGLT2-Inhibitor wird bei Patienten nicht empfohlen, die unter der Behandlung mit einem SGLT2-Inhibitor zuvor eine DKA entwickelt hatten, es sei denn, es wurde ein anderer eindeutiger auslösender Faktor ermittelt und beseitigt.
Die Sicherheit und Wirksamkeit von Ertugliflozin bei Patienten mit Typ‑1 Diabetes ist bisher nicht belegt und Ertugliflozin sollte nicht zur Behandlung von Patienten mit Typ‑1 Diabetes angewendet werden. Auf der Grundlage begrenzter Daten aus klinischen Studien scheint eine DKA häufig aufzutreten, wenn Patienten mit Typ‑1 Diabetes mit SGLT2-Inhibitoren behandelt werden.
Amputationen der unteren Gliedmaßen
Im Rahmen der Langzeitstudie zur Untersuchung der kardiovaskulären Endpunkte (cardiovasular outcome) VERTIS-CV (eValuation of ERTugliflozin effIcacy and Safety, CardioVascular), einer Studie bei Patienten mit Typ-2 Diabetes mellitus und bestehender atherosklerotischer kardiovaskulärer Erkrankung, wurden hinsichtlich nicht-traumatischer Amputationen der unteren Gliedmaßen (in erster Linie von Zehen) mit einer Inzidenz von 2 % (0,57 Ereignisse pro 100 Patientenjahre), 2,1 % (0,60 Ereignisse pro 100 Patientenjahre) bzw. 1,6 % (0,47 Ereignisse pro 100 Patientenjahre) für die Ertugliflozin 5 mg-, Ertugliflozin 15 mg- bzw. Placebogruppen beobachtet. Die Ereignisraten für Amputationen der unteren Gliedmaßen waren 0,75 bzw. 0,96 versus 0,74 Ereignisse pro 100 Patientenjahre für Ertugliflozin 5 mg bzw. Ertugliflozin 15 mg versus Placebo. Eine erhöhte Anzahl von Amputationen der unteren Gliedmaßen (in erster Linie von Zehen) ist in klinischen Langzeitstudien bei Patienten mit Typ-2 Diabetes mellitus mit SGLT2-Inhibitoren beobachtet worden. Es ist nicht bekannt, ob dies einen Klasseneffekt darstellt. Daher ist es wichtig, Patienten mit Diabetes eine routinemäßige vorbeugende Fußpflege zu empfehlen.
Eingeschränkte Nierenfunktion
Die Wirksamkeit von Ertugliflozin hinsichtlich der Blutzuckerkontrolle hängt von der Nierenfunktion ab, sodass die glykämische Wirksamkeit bei Patienten mit moderater Einschränkung der Nierenfunktion verringert ist, und wahrscheinlich bei Patienten mit schwerer Einschränkung der Nierenfunktion ausbleibt (siehe Abschnitt 4.2).
Der Beginn einer Behandlung mit Steglatro wird bei Patienten mit einer eGFR unter 45 ml/min/1,73 m2 oder einer CrCl unter 45 ml/min nicht empfohlen. Bei einer eGFR anhaltend unter 30 ml/min/1,73 m2 oder einer CrCl anhaltend unter 30 ml/min sollte die Behandlung mit Steglatro aufgrund einer verringerten Wirksamkeit abgebrochen werden.
Die Überwachung der Nierenfunktion wird wie folgt empfohlen:
Vor Beginn der Behandlung mit Ertugliflozin und in regelmäßigen Abständen während der Behandlung (siehe Abschnitt 4.2).
Häufiger bei Patienten mit einer eGFR unter 60 ml/min/1,73 m2 oder einer CrCl unter 60 ml/min.
Hypoglykämie bei gemeinsamer Anwendung mit Insulin und Insulin-Sekretagoga
Ertugliflozin kann das Risiko einer Hypoglykämie erhöhen, wenn es gemeinsam mit Insulin und/oder einem Insulin-Sekretagogum angewendet wird, da diese bekanntlich Hypoglykämien verursachen (siehe Abschnitt 4.8). Demzufolge kann es bei gemeinsamer Anwendung mit Ertugliflozin notwendig sein, die Dosis des Insulins oder des Insulin-Sekretagogums zu verringern, um das Risiko für eine Hypoglykämie zu minimieren (siehe Abschnitte 4.2 und 4.5).
Genitale Pilzinfektionen
Ertugliflozin erhöht das Risiko für genitale Pilzinfektionen. In klinischen Studien mit SGLT2-Inhibitoren kam es bei Patienten mit Pilzinfektionen in der Vorgeschichte und bei Männern ohne Beschneidung mit höherer Wahrscheinlichkeit zu genitalen Pilzinfektionen (siehe Abschnitt 4.8). Diese Patienten sollten entsprechend überwacht und ggf. behandelt werden.
Harnwegsinfektionen
Die Glucoseausscheidung über den Urin kann mit einem erhöhten Risiko für Harnwegsinfektionen einhergehen (siehe Abschnitt 4.8). Bei der Behandlung einer Pyelonephritis oder einer Urosepsis sollte eine zeitweise Unterbrechung der Behandlung mit Ertugliflozin in Betracht gezogen werden.
Nekrotisierende Fasziitis des Perineums (Fournier-Gangrän)
Nach dem Inverkehrbringen wurden Fälle von nekrotisierender Fasziitis des Perineums (auch als Fournier-Gangrän bezeichnet) bei weiblichen und männlichen Patienten gemeldet, die SGLT2-Hemmer einnahmen. Hierbei handelt es sich um ein seltenes, aber schwerwiegendes und potenziell lebensbedrohliches Ereignis, das einen dringenden chirurgischen Eingriff und eine Behandlung mit Antibiotika erfordert.
Den Patienten sollte empfohlen werden, sich an einen Arzt zu wenden, wenn bei ihnen die Symptome Schmerzen, Berührungsempfindlichkeit, Erythem oder Schwellungen im Bereich der Genitalien oder des Perineums gleichzeitig mit Fieber oder Unwohlsein auftreten. Beachten Sie, dass im Vorfeld einer nekrotisierenden Fasziitis Infektionen des Urogenitaltrakts oder Perinealabszesse auftreten können. Bei Verdacht auf Fournier-Gangrän ist Steglatro abzusetzen und unverzüglich eine Behandlung (u. a. die Gabe von Antibiotika und chirurgisches Debridement) einzuleiten.
Ältere Patienten
Ältere Patienten können ein erhöhtes Risiko für eine Hypovolämie und eine eingeschränkte Nierenfunktion haben. Patienten über 65 Jahre, die mit Ertugliflozin behandelt wurden, hatten eine höhere Inzidenz für Nebenwirkungen im Zusammenhang mit einer Hypovolämie als jüngere Patienten. In der Langzeitstudie zur Untersuchung der kardiovaskulären Endpunkte VERTIS-CV waren Sicherheit und Wirksamkeit ähnlich bei Patienten, die 65 Jahre oder älter waren, verglichen mit Patienten unter 65 Jahren (siehe Abschnitte 4.2 und 4.8).
Herzinsuffizienz
Es liegen keine Erfahrungen aus klinischen Studien mit Ertugliflozin bei Patienten mit Herzinsuffizienz der New York Heart Association (NYHA) Klasse IV vor.
Urin-Laboruntersuchungen
Aufgrund des Wirkmechanismus von Ertugliflozin fallen Urintests auf Glucose bei mit Steglatro behandelten Patienten positiv aus. Zur Blutzuckerkontrolle sollten andere Methoden angewendet werden.
Einfluss auf den 1,5-Anhydroglucitol (1,5‑AG) Assay
Die Überwachung der Blutzuckerkontrolle mit Hilfe des 1,5‑AG Assays wird aufgrund unzuverlässiger Messergebnisse des 1,5‑AG Assays bei Patienten, die Arzneimittel einnehmen, die SGLT2-Inhibitoren enthalten, nicht empfohlen. Zur Blutzuckerkontrolle sollten andere Methoden angewendet werden.
Lactose
Steglatro enthält Lactose-Monohydrat. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d. h., es ist nahezu „natriumfrei“.
Pharmakodynamische Wechselwirkungen
Diuretika
Ertugliflozin kann die diuretische Wirkung von Diuretika verstärken und so das Risiko für eine Dehydratation und Hypotonie erhöhen (siehe Abschnitt 4.4).
Insulin und Insulin-Sekretagoga
Insulin und Insulin-Sekretagoga wie Sulfonylharnstoffe verursachen Hypoglykämien. Ertugliflozin kann das Risiko für eine Hypoglykämie erhöhen, sofern es gemeinsam mit Insulin oder einem Insulin-Sekretagogum angewendet wird. Demzufolge kann es bei gemeinsamer Anwendung mit Ertugliflozin notwendig sein, die Dosis des Insulins oder des Insulin-Sekretagogums zu verringern, um das Risiko für eine Hypoglykämie zu reduzieren (siehe Abschnitte 4.2, 4.4 und 4.8).
Pharmakokinetische Wechselwirkungen
Wirkungen anderer Arzneimittel auf die Pharmakokinetik von Ertugliflozin
Ertugliflozin wird hauptsächlich mittels Metabolisierung durch UGT1A9 und UGT2B7 ausgeschieden.
Arzneimittelwechselwirkungsstudien bei gesunden Probanden deuten darauf hin, dass die Pharmakokinetik von Ertugliflozin durch Sitagliptin, Metformin, Glimepirid oder Simvastatin nach Einmalgabe nicht beeinflusst wird.
Die mehrfache Gabe von Rifampicin (ein Uridin-5´-trihydrogendiphosphat-Glukuronosyltransferase [UGT]- und Cytochrom P450 [CYP]-Induktor) führt zu einer Reduktion der Fläche unter der Konzentrations-Zeit-Kurve (Area under the curve, AUC) und der maximalen Plasmakonzentration (Cmax) von Ertugliflozin um 39 % bzw. 15 %. Diese Reduktion der Exposition wird als klinisch nicht relevant erachtet, sodass keine Dosisanpassung empfohlen wird. Ein klinisch relevanter Einfluss durch andere Enzyminduktoren (z. B. Carbamazepin, Phenytoin, Phenobarbital) ist nicht zu erwarten.
Der Einfluss von UGT-Inhibitoren auf die Pharmakokinetik von Ertugliflozin wurde klinisch nicht untersucht. Ein möglicher Anstieg der Exposition von Ertugliflozin durch Hemmung von UGT wird nicht als klinisch relevant angesehen.
Wirkungen von Ertugliflozin auf die Pharmakokinetik anderer Arzneimittel
Arzneimittelwechselwirkungsstudien bei gesunden Probanden deuten darauf hin, dass Ertugliflozin keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Sitagliptin, Metformin und Glimepirid hat.
Die gemeinsame Anwendung von Simvastatin mit Ertugliflozin führte zu einem Anstieg der AUC und Cmax von Simvastatin um 24 % bzw. 19 % und zu einem Anstieg der AUC und Cmax von Simvastatinsäure um 30 % bzw. 16 %. Der Mechanismus für den leichten Anstieg von Simvastatin und Simvastatinsäure ist nicht bekannt und wird nicht durch eine Hemmung vom Organo-Anion-Transporter (OATP) durch Ertugliflozin verursacht. Diese Anstiege werden als klinisch nicht relevant erachtet.
Schwangerschaft
Bisher liegen nur begrenzte Erfahrungen zur Anwendung von Ertugliflozin bei Schwangeren vor. Basierend auf den Ergebnissen tierexperimenteller Studien kann Ertugliflozin die Entwicklung und Reifung der Nieren beeinflussen (siehe Abschnitt 5.3). Deshalb sollte Steglatro während der Schwangerschaft nicht angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Ertugliflozin in die Muttermilch übergeht, oder Auswirkungen auf gestillte Neugeborene/Kinder oder auf die Milchbildung hat. Ertugliflozin geht in die Milch von laktierenden Ratten über und hatte Auswirkungen auf deren Nachkommen. Bei juvenilen Ratten wurden pharmakologisch vermittelte Auswirkungen beobachtet (siehe Abschnitt 5.3). Da die Reifung der Nieren beim Menschen in der Gebärmutter und während der ersten 2 Lebensjahre bei möglicher Exposition durch das Stillen stattfindet, kann ein Risiko für Neugeborene/Kinder nicht ausgeschlossen werden. Steglatro sollte während der Stillzeit nicht angewendet werden.
Fertilität
Die Auswirkung von Ertugliflozin auf die menschliche Fertilität wurde nicht untersucht. In tierexperimentellen Studien wurden keine Auswirkungen auf die Fertilität beobachtet (siehe Abschnitt 5.3).
Ertugliflozin hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Die Patienten sollten darauf aufmerksam gemacht werden, dass bei Anwendung von Steglatro in Kombination mit Insulin oder einem Insulin-Sekretagogum das Risiko für eine Hypoglykämie besteht und das Risiko für Nebenwirkungen im Zusammenhang mit einer Hypovolämie wie z. B. orthostatischer Schwindel erhöht ist (siehe Abschnitte 4.2, 4.4 und 4.8).
Zusammenfassung des Sicherheitsprofils
Die Sicherheit und Verträglichkeit von Ertugliflozin wurde in 7 placebo- oder aktivkontrollierten Studien bei insgesamt 3 409 Patienten mit Typ-2 Diabetes mellitus untersucht, die mit Ertugliflozin 5 mg oder 15 mg behandelt wurden. Zusätzlich wurde im Rahmen der VERTIS-CV Studie (siehe Abschnitt 5.1) die Sicherheit und Verträglichkeit von Ertugliflozin bei insgesamt 5 493 Patienten mit Typ-2 Diabetes und bestehender atherosklerotischer kardiovaskulärer Erkrankung untersucht, die mit Ertugliflozin 5 mg oder 15 mg über einen mittleren Behandlungszeitraum von 2,9 Jahren behandelt wurden.
Gepoolte placebokontrollierte Studien mit Steglatro 5 mg und 15 mg
Die primäre Sicherheitsbewertung erfolgte anhand von drei gepoolten placebokontrollierten Studien über jeweils 26 Wochen. Ertugliflozin wurde in einer der Studien als Monotherapie und in zwei der Studien als Add-on-Therapie angewendet (siehe Abschnitt 5.1). Diese Daten umfassen die Exposition von 1 029 Patienten mit Ertugliflozin mit einer mittleren Expositionsdauer von ca. 25 Wochen. Die Patienten erhielten 5 mg Ertugliflozin (N = 519), 15 mg Ertugliflozin (N = 510) oder Placebo (N = 515) einmal täglich.
Die am häufigsten berichteten Nebenwirkungen über das klinische Entwicklungsprogramm hinweg waren Harnwegsinfektionen, vulvovaginale Pilzinfektionen und andere genitale Pilzinfektionen bei Frauen. Schwerwiegende DKA traten selten auf (siehe Abschnitt 4.4).
Tabellarische Auflistung der Nebenwirkungen
Die unten angegebenen Nebenwirkungen sind gemäß ihrer Häufigkeit und der zugehörigen Systemorganklasse (SOC) eingeteilt, innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen nach absteigendem Schweregrad aufgeführt. Die Häufigkeiten sind wie folgt definiert:
sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1 000, <1/100), selten (≥1/10 000, <1/1 000), sehr selten (<1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 1: Nebenwirkungen aus placebo- und aktivkontrollierten klinischen Studien und Erfahrungen nach Markteinführung
Systemorganklasse | Nebenwirkung |
Infektionen und parasitäre Erkrankungen | |
Sehr häufig | Harnwegsinfektionen† |
Häufig | Candida-Balanitis und andere genitale Pilzinfektionen bei Männern*,† |
Nicht bekannt | Nekrotisierende Fasziitis des Perineums (Fournier-Gangrän)*,a |
Stoffwechsel- und Ernährungsstörungen | |
Häufig | Hypoglykämie*,† |
Selten | DKA*,† |
Gefäßerkrankungen | |
Häufig | Hypovolämie*,† |
Erkrankungen der Haut und des Unterhautgewebes | |
Nicht bekannt | Ausschlaga |
Erkrankungen der Nieren und Harnwege | |
Häufig | Erhöhter Harndrang‡ |
Gelegentlich | Dysurie, Kreatinin im Blut erhöht/glomeruläre Filtrationsrate vermindert† |
Erkrankungen der Geschlechtsorgane und der Brustdrüse | |
Häufig | Vulvovaginaler Pruritus |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
Häufig | Durst§ |
Untersuchungen | |
Häufig | Serumlipide verändert¶, Hämoglobin erhöht**, BUN erhöht¶¶ |
* Siehe Abschnitt 4.4. | |
Beschreibung ausgewählter Nebenwirkungen
Hypovolämie
Ertugliflozin induziert eine osmotische Diurese, die zu einer intravaskulären Volumenkontraktion und zu Nebenwirkungen in Zusammenhang mit einer Hypovolämie führen kann. Auf Datenbasis der gepoolten placebokontrollierten Studien war die Inzidenz von unerwünschten Ereignissen in Zusammenhang mit einer Hypovolämie (Dehydratation, orthostatischer Schwindel, Präsynkope, Synkope, Hypotonie und orthostatische Hypotonie) gering (< 2 %) und zwischen den Patientengruppen unter Ertugliflozin oder Placebo nicht nennenswert unterschiedlich. Anhand des umfangreicheren Datenpools der Phase III Studien zeigte sich in den Subgruppenanalysen, dass Patienten mit einer eGFR < 60 ml/min/1,73 m2, Patienten im Alter von ≥ 65 Jahren und Patienten, die Diuretika einnahmen, in den Ertugliflozingruppen im Vergleich zu den Kontrollgruppen eine höhere Inzidenz für eine Hypovolämie hatten (siehe Abschnitte 4.2 und 4.4). Bei Patienten mit einer eGFR < 60 ml/min/1,73 m2 lag die Inzidenz bei 5,1 %, 2,6 % und 0,5 % in den Gruppen unter 5 mg Ertugliflozin, 15 mg Ertugliflozin bzw. in der Kontrollgruppe. Bei Patienten mit einer eGFR von 45 bis < 60 ml/min/1,73 m2 lag die Inzidenz bei 6,4 %, 3,7 % und 0 % in den Gruppen unter 5 mg Ertugliflozin, 15 mg Ertugliflozin bzw. in der Kontrollgruppe.
Hypoglykämie
Auf Datenbasis der gepoolten placebokontrollierten Studien war die Häufigkeit bestätigter Hypoglykämien bei Patienten unter Ertugliflozin 5 mg und 15 mg (5 % bzw. 4,5 %) im Vergleich zu Placebo (2,9 %) erhöht. In dieser Population betrug die Inzidenz schwerer Hypoglykämien in jeder Subgruppe 0,4 %. Bei Anwendung von Ertugliflozin als Monotherapie lag die Inzidenz von hypoglykämischen Ereignissen in beiden Ertugliflozingruppen bei 2,6 % und in der Placebogruppe bei 0,7 %. Bei Anwendung als Add-on zu Metformin lag die Inzidenz von hypoglykämischen Ereignissen in der Gruppe unter 5 mg Ertugliflozin bei 7,2 %, in der Gruppe unter 15 mg Ertugliflozin bei 7,8 % und in der Placebogruppe bei 4,3 %.
Bei Anwendung von Ertugliflozin oder Sulfonylharnstoff als Add-on zu Metformin war die Inzidenz von Hypoglykämien bei den Patienten unter Sulfonylharnstoff (27 %) höher als im Vergleich zu Ertugliflozin (5,6 % und 8,2 % für Ertugliflozin 5 mg bzw. 15 mg).
Im Rahmen der VERTIS-CV Substudien, bei denen Ertugliflozin als Add-on zu Insulin mit oder ohne Metformin gegeben wurde, lag die Inzidenz einer dokumentierten Hypoglykämie bei den Patienten unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo bei 39,4 %, 38,9 % bzw. 37,5 %. Bei Gabe von Ertugliflozin als Add-on zu Sulfonylharnstoffen lag die Inzidenz für eine Hypoglykämie bei Patienten unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo bei 7,3 %, 9,3 % bzw. 4,2 %. Bei Gabe von Ertugliflozin als Add-on zu Metformin und einem Sulfonylharnstoff lag die Inzidenz für eine Hypoglykämie bei Patienten unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo bei 20 %, 26,5 % bzw. 14,5 %.
Bei Patienten mit moderater Einschränkung der Nierenfunktion, die Insuline, Sulfonylharnstoffe oder Glinide als Hintergrundarzneimittel einnahmen, wurden bestätigte Hypoglykämien bei 36 %, 27 % und 36 % der Patienten unter 5 mg Ertugliflozin, 15 mg Ertugliflozin bzw. Placebo beobachtet (siehe Abschnitte 4.2, 4.4 und 4.5).
Diabetische Ketoazidose
Im Rahmen der VERTIS-CV Studie wurde eine Ketoazidose bei 19 (0,3 %) Patienten unter Ertugliflozin und bei 2 (0,1 %) Patienten unter Placebo festgestellt. Über 7 andere Phase III Studien des klinischen Ertugliflozin-Entwicklungsprogramms hinweg wurde eine Ketoazidose bei 3 (0,1 %) Patienten unter Ertugliflozin und bei 0 (0 %) der Patienten unter Vergleichsmedikation festgestellt (siehe Abschnitt 4.4).
Erhöhtes Kreatinin im Blut/Verminderte glomeruläre Filtrationsrate und renale Ereignisse
Initiale Erhöhungen des mittleren Kreatinins und Abnahmen der mittleren eGFR waren bei Patienten unter Ertugliflozin bei durchgängiger Behandlung im Allgemeinen vorübergehend. Patienten mit moderater Einschränkung der Nierenfunktion zu Studienbeginn hatten größere mittlere Abweichungen, welche bis Woche 26 nicht wieder auf das Ausgangsniveau zurückgingen, sich nach Absetzen der Behandlung aber wieder normalisierten.
Im Rahmen der VERTIS-CV Studie war die Behandlung mit Ertugliflozin mit einer initialen Abnahme der mittleren eGFR verbunden (in Woche 6 –2,7, –3,8 bzw. –0,4 ml/min/1,73 m2 bei Patienten unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo) gefolgt von einer Rückkehr zum Ausgangswert. Im Zusammenhang mit einer kontinuierlichen Langzeitbehandlung mit Ertugliflozin kam es zu einer langsameren Abnahme der mittleren eGFR im Vergleich zu Placebo (über einen Zeitraum von bis zu 260 Wochen).
Im Rahmen der VERTIS-CV Studie lag die Inzidenz von renalen Nebenwirkungen (z. B. akute Nierenschädigung, eingeschränkte Nierenfunktion, akute prärenale Insuffizienz) bei den Patienten in der Gesamtpopulation unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo bei 4,2 %, 4,3 % bzw. 4,7 % und betrug bei den Patienten mit einer eGFR von 30 bis kleiner 60 ml/min/1,73 m2 unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo 9,7 %, 10 % bzw. 10,2 %.
Genitale Pilzinfektionen
Auf Datenbasis der drei gepoolten placebokontrollierten klinischen Studien wurden genitale Pilzinfektionen bei Frauen (z. B. genitale Candidose, genitale Pilzinfektion, Vaginalinfektion, Vulvitis, vulvovaginale Candidose, vulvovaginale Pilzinfektion, Vulvovaginitis) bei 9,1 %, 12 % bzw. 3 % der Patientinnen unter 5 mg Ertugliflozin, 15 mg Ertugliflozin bzw. Placebo beobachtet. Die Behandlung wurde bei Frauen aufgrund von genitalen Pilzinfektionen unter Ertugliflozin und Placebo bei 0,6 % bzw. 0 % der Patientinnen abgebrochen (siehe Abschnitt 4.4).
Auf gleicher Datenbasis lag die Inzidenz von genitalen Pilzinfektionen bei Männern (z. B. Candida-Balanitis, Balanoposthitis, Genitalinfektion, genitale Pilzinfektion) unter 5 mg Ertugliflozin, 15 mg Ertugliflozin und Placebo bei 3,7 %, 4,2 % bzw. 0,4 %. Genitale Pilzinfektionen traten bei Männern ohne Beschneidung häufiger auf. Die Behandlung wurde bei Männern aufgrund von genitalen Pilzinfektionen unter Ertugliflozin und Placebo bei 0,2 % bzw. 0 % der Patienten abgebrochen. In seltenen Fällen wurde eine Phimose berichtet und in manchen Fällen wurde eine Beschneidung durchgeführt (siehe Abschnitt 4.4).
Harnwegsinfektionen
Im Rahmen der VERTIS-CV Studie traten Harnweginfektionen in 12,2 %, 12 % bzw. 10,2 % der Patienten unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo auf. Die Inzidenz von schweren Harnwegsinfektionen betrug 0,9 %, 0,4 % bzw. 0,8 % unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo.
Über 7 andere klinische Phase III Studien aus dem Ertugliflozin-Entwicklungsprogramm hinweg betrug die Inzidenz für Harnwegsinfektionen 4 %, 4,1 % bzw. 3,9 % unter Ertugliflozin 5 mg, Ertugliflozin 15 mg bzw. Placebo. Die meisten Ereignisse waren leicht bis moderat und keine schweren Fälle wurden berichtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: www.bfarm.de, anzuzeigen.
Bei gesunden Probanden gab es keinerlei Anzeichen von Toxizität bei der Einnahme von Ertugliflozin in Einzeldosen von bis zu 300 mg sowie Mehrfachdosen von bis zu 100 mg täglich über 2 Wochen. Es wurden keine potentiell akuten Symptome oder Anzeichen einer Überdosierung beobachtet.
Im Fall einer Überdosierung sollten die üblichen unterstützenden Maßnahmen (z. B. Elimination von noch nicht aufgenommenem Arzneimittel aus dem Gastrointestinaltrakt, klinische Überwachung des Patienten und Einleiten unterstützender Maßnahmen) gemäß dem klinischen Allgemeinzustand des Patienten ergriffen werden. Die Elimination von Ertugliflozin mittels Hämodialyse wurde nicht untersucht.
Pharmakotherapeutische Gruppe: Antidiabetika, Natrium-Glucose-Cotransporter-2-(SGLT2)-Inhibitoren, ATC-Code: A10BK04.
Wirkmechanismus
SGLT2 ist der Haupttransporter, der für die Rückresorption von Glucose aus dem glomerulären Filtrat in den Kreislauf verantwortlich ist. Ertugliflozin ist ein potenter, selektiver und reversibler Inhibitor von SGLT2. Durch die Hemmung von SGLT2 verringert Ertugliflozin die Rückresorption von renal filtrierter Glucose und senkt die Nierenschwelle für Glucose ab und steigert somit die Glucoseausscheidung im Urin.
Pharmakodynamische Wirkungen
Glucoseausscheidung im Urin und Urinvolumen
Bei gesunden Probanden und bei Patienten mit Typ‑2 Diabetes mellitus konnte eine dosisabhängige Steigerung der Glucoseausscheidung im Urin nach Einzel- und Mehrfachgabe von Ertugliflozin beobachtet werden. Dosis-Wirkungs-Modelle zeigen, dass 5 mg und 15 mg Ertugliflozin bei Patienten mit Typ‑2 Diabetes mellitus zu einer annähernd maximalen Glucoseausscheidung im Urin führen, was 87 % bzw. 96 % der maximalen Hemmung entspricht.
Klinische Wirksamkeit und Sicherheit
Sowohl die Verbesserung der Blutzuckerkontrolle als auch eine Reduktion der kardiovaskulären Morbidität und Mortalität sind wesentliche Bestandteile bei der Behandlung des Typ-2 Diabetes mellitus.
Ertugliflozin wurde als Monotherapie und in Kombination mit Metformin, Sitagliptin, einem Sulfonylharnstoff, Insulin (mit oder ohne Metformin), Metformin plus Sitagliptin, Metformin plus ein Sulfonylharnstoff und im Vergleich mit einem Sulfonylharnstoff (Glimepirid) untersucht. Des Weiteren wurde Ertugliflozin bei Patienten mit Typ-2 Diabetes mellitus und moderater Einschränkung der Nierenfunktion untersucht.
Die glykämische Wirksamkeit und Sicherheit von Ertugliflozin wurde im Rahmen von 7 multizentrischen, randomisierten, doppelblinden, placebo- oder aktivkontrollierten, klinischen Phase III Studien an insgesamt 4 863 Patienten mit Typ‑2 Diabetes untersucht, darunter eine Studie mit 468 Patienten mit moderater Einschränkung der Nierenfunktion. Von den eingeschlossenen Patienten waren 76,8 % kaukasischer, 13,3 % asiatischer, 5,0 % schwarzafrikanischer und 4,8 % sonstiger ethnischer Herkunft. Patienten mit hispanischer oder lateinamerikanischer Herkunft waren in der Gesamtpopulation zu 24,2 % vertreten. Die Patienten hatten ein Durchschnittsalter von 57,8 Jahren (Spanne 21 Jahre bis 87 Jahre), 25,8 % der Patienten waren ≥ 65 Jahre und 4,5 % der Patienten waren ≥ 75 Jahre alt.
Außerdem wurde eine Studie zur Untersuchung der kardiovaskulären Endpunkte (VERTIS-CV) durchgeführt. Die VERTIS-CV Studie schloss 8 246 Patienten mit Typ-2 Diabetes mellitus und bestehender atherosklerotischer kardiovaskulärer Erkrankung, einschließlich 1 776 Patienten mit moderater Einschränkung der Nierenfunktion, ein. Des Weiteren umfasst die VERTIS-CV Studie Substudien zur Untersuchung der glykämischen Wirksamkeit und Sicherheit von Ertugliflozin als Add-on zu anderen blutzuckersenkenden Therapien.
Blutzuckerkontrolle
Monotherapie
Insgesamt 461 Patienten mit Typ‑2 Diabetes, deren Blutzucker durch Diät und Bewegung nicht ausreichend kontrolliert werden konnte, wurden im Rahmen einer randomisierten, doppelblinden, multizentrischen, 26‑wöchigen, placebokontrollierten Studie zur Untersuchung der Wirksamkeit und Sicherheit von Ertugliflozin als Monotherapie eingeschlossen. Die Patienten erhielten ohne antidiabetische Hintergrundtherapie randomisiert einmal täglich Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Placebo (siehe Tabelle 2).
Tabelle 2: Ergebnisse einer placebokontrollierten Studie über 26 Wochen zur Untersuchung von Ertugliflozin als Monotherapie*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Placebo | |
HbA1c (%) | N = 156 | N = 151 | N = 153 |
Ausgangswert (Mittelwert) | 8,2 | 8,4 | 8,1 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –0,8 | –1,0 | 0,2 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –1,0‡ (–1,2; –0,8) | –1,2‡ (–1,4; –0,9) | |
Patienten [N (%)] mit HbA1c < 7 % | 44 (28,2)§ | 54 (35,8)§ | 20 (13,1) |
Körpergewicht (kg) | N = 156 | N = 152 | N = 153 |
Ausgangswert (Mittelwert) | 94,0 | 90,6 | 94,2 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –3,2 | –3,6 | –1,4 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –1,8‡ (–2,6; –0,9) | –2,2‡ (–3,0; –1,3) | |
* N beinhaltet alle randomisiert behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Ertugliflozin als Add-on-Kombinationstherapie mit Metformin
Insgesamt 621 Patienten mit Typ‑2 Diabetes, deren Blutzucker durch eine Metformin-Monotherapie (≥ 1 500 mg/Tag) nicht ausreichend kontrolliert werden konnte, wurden im Rahmen einer randomisierten, doppelblinden, multizentrischen, 26‑wöchigen, placebokontrollierten Studie zur Untersuchung der Wirksamkeit und Sicherheit von Ertugliflozin in Kombination mit Metformin eingeschlossen. Die Patienten erhielten zusätzlich zu einer fortgesetzten Hintergrundtherapie mit Metformin randomisiert einmal täglich Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Placebo (siehe Tabelle 3).
Tabelle 3: Ergebnisse einer placebokontrollierten Studie über 26 Wochen zur Untersuchung von Ertugliflozin in Kombination mit Metformin*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Placebo | |
HbA1c (%) | N = 207 | N = 205 | N = 209 |
Ausgangswert (Mittelwert) | 8,1 | 8,1 | 8,2 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –0,7 | –0,9 | –0,0 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –0,7‡ (–0,9; –0,5) | –0,9‡ (–1,1; –0,7) | |
Patienten [N (%)] mit HbA1c < 7 % | 73 (35,3)§ | 82 (40,0)§ | 33 (15,8) |
Körpergewicht (kg) | N = 207 | N = 205 | N = 209 |
Ausgangswert (Mittelwert) | 84,9 | 85,3 | 84,5 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –3,0 | –2,9 | –1,3 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –1,7‡ (–2,2; –1,1) | –1,6‡ (–2,2; –1,0) | |
* N beinhaltet alle randomisiert behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Aktivkontrollierte Studie zur Untersuchung von Ertugliflozin im Vergleich zu Glimepirid als Add-on-Kombinationstherapie mit Metformin
Insgesamt 1 326 Patienten mit Typ‑2 Diabetes, deren Blutzucker durch eine Metformin-Monotherapie nicht ausreichend kontrolliert werden konnte, wurden im Rahmen einer randomisierten, doppelblinden, multizentrischen, 52‑wöchigen, aktivkontrollierten Studie zur Untersuchung der Wirksamkeit und Sicherheit von Ertugliflozin in Kombination mit Metformin eingeschlossen. Die Patienten erhielten zusätzlich zu einer fortgesetzten Hintergrundtherapie mit Metformin (≥ 1 500 mg/Tag) randomisiert einmal täglich Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Glimepirid. Die Behandlung mit Glimepirid wurde mit 1 mg/Tag initiiert und bis zu einer Maximaldosis von 6 bzw. 8 mg/Tag (abhängig von der im jeweiligen Land zugelassenen Maximaldosis) oder der maximal verträglichen Dosis nach oben bzw. nach unten titriert, um Hypoglykämien zu vermeiden oder zu kontrollieren. Die mittlere Tagesdosis lag bei 3,0 mg Glimepirid (siehe Tabelle 4).
Tabelle 4: Ergebnisse einer aktivkontrollierten Studie über 52 Wochen zur Untersuchung von Ertugliflozin im Vergleich zu Glimepirid als Add-on-Therapie bei unzureichend kontrollierten Patienten unter Metformin*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Glimepirid | |
HbA1c (%) | N = 448 | N = 440 | N = 437 |
Ausgangswert (Mittelwert) | 7,8 | 7,8 | 7,8 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –0,6 | –0,6 | –0,7 |
Differenz zu Glimepirid (LS‑Mittelwert†, 95 % KI) | 0,2 (0,1; 0,3) | 0,1‡ (–0,0; 0,2) | |
Patienten [N (%)] mit HbA1c < 7 % | 154 (34,4) | 167 (38,0) | 190 (43,5) |
Körpergewicht (kg) | N = 448 | N = 440 | N = 437 |
Ausgangswert (Mittelwert) | 87,9 | 85,6 | 86,8 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –3,0 | –3,4 | 0,9 |
Differenz zu Glimepirid (LS‑Mittelwert†, 95 % KI) | –3,9 (–4,4; –3,4) | –4,3§ (–4,8; –3,8) | |
* N beinhaltet alle randomisiert behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Faktorielle Studie zur Untersuchung von Ertugliflozin und Sitagliptin als Add-on-Kombinationstherapie mit Metformin
Insgesamt 1 233 Patienten mit Typ‑2 Diabetes wurden im Rahmen einer randomisierten, doppelblinden, multizentrischen, 26‑wöchigen, aktivkontrollierten Studie zur Untersuchung der Wirksamkeit und Sicherheit von Ertugliflozin 5 mg oder 15 mg in Kombination mit 100 mg Sitagliptin im Vergleich zu den jeweiligen Einzelkomponenten eingeschlossen. Die Patienten mit Typ‑2 Diabetes, deren Blutzucker durch eine Metformin-Monotherapie (≥ 1 500 mg/Tag) nicht ausreichend kontrolliert werden konnte, wurden randomisiert einem der fünf aktiven Behandlungsarme zugeteilt: Ertugliflozin 5 mg oder 15 mg, 100 mg Sitagliptin oder 100 mg Sitagliptin in Kombination mit Ertugliflozin 5 mg oder 15 mg, jeweils zur einmal täglichen Einnahme zusätzlich zur Fortsetzung einer Hintergrundtherapie mit Metformin (siehe Tabelle 5).
Tabelle 5: Ergebnisse einer faktoriellen Studie über 26 Wochen zur Untersuchung von Ertugliflozin und Sitagliptin als Add-on-Kombinationstherapie mit Metformin im Vergleich zu den jeweiligen Einzelkomponenten*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Sitagliptin 100 mg | Ertugliflozin 5 mg + Sitagliptin 100 mg | Ertugliflozin 15 mg + Sitagliptin 100 mg | ||
HbA1c (%) | N = 250 | N = 248 | N = 247 | N = 243 | N = 244 | |
Ausgangswert | 8,6 | 8,6 | 8,5 | 8,6 | 8,6 | |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –1,0 | –1,1 | –1,1 | –1,5 | –1,5 | |
Differenz zu | ||||||
Sitagliptin | –0,4‡ (–0,6; –0,3) | –0,5‡ (–0,6; –0,3) | ||||
Ertugliflozin 5 mg | –0,5‡ (–0,6; –0,3) | |||||
Ertugliflozin 15 mg | –0,4‡ (–0,6; –0,3) | |||||
(LS‑Mittelwert†, 95 % KI) | ||||||
Patienten [N (%)] mit HbA1c < 7 % | 66 (26,4) | 79 (31,9) | 81 (32,8) | 127 (52,3)§ | 120 (49,2)§ | |
Körpergewicht (kg) | N = 250 | N = 248 | N = 247 | N = 243 | N = 244 | |
Ausgangswert | 88,6 | 88,0 | 89,8 | 89,5 | 87,5 | |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –2,7 | –3,7 | –0,7 | –2,5 | –2,9 | |
Differenz zu Sitagliptin | –1,8‡ (–2,5; –1,2) | –2,3‡ (–2,9; –1,6) | ||||
* N beinhaltet alle randomisiert behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | ||||||
Ertugliflozin als Add-on-Kombinationstherapie mit Metformin und Sitagliptin
Insgesamt 463 Patienten mit Typ‑2 Diabetes, deren Blutzucker durch eine Therapie mit Metformin (≥ 1 500 mg/Tag) und einmal täglich 100 mg Sitagliptin nicht ausreichend kontrolliert werden konnte, wurden im Rahmen einer randomisierten, doppelblinden, multizentrischen, 26‑wöchigen, placebokontrollierten Studie zur Untersuchung der Wirksamkeit und Sicherheit von Ertugliflozin eingeschlossen. Die Patienten erhielten zusätzlich zu einer fortgesetzten Hintergrundtherapie mit Metformin und Sitagliptin randomisiert einmal täglich Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Placebo (siehe Tabelle 6).
Tabelle 6: Ergebnisse einer Add-on Studie über 26 Wochen zur Untersuchung von Ertugliflozin in Kombination mit Metformin und Sitagliptin*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Placebo | |
HbA1c (%) | N = 156 | N = 153 | N = 153 |
Ausgangswert (Mittelwert) | 8,1 | 8,0 | 8,0 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –0,8 | –0,9 | –0,1 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –0,7‡ (–0,9; –0,5) | –0,8‡ (–0,9; –0,6) | |
Patienten [N (%)] mit HbA1c < 7 % | 50 (32,1)§ | 61 (39,9)§ | 26 (17,0) |
Körpergewicht (kg) | N = 156 | N = 153 | N = 153 |
Ausgangswert (Mittelwert) | 87,6 | 86,6 | 86,5 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –3,3 | –3,0 | –1,3 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –2,0‡ (–2,6; –1,4) | –1,7‡ (–2,3; –1,1) | |
* N beinhaltet alle randomisiert behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Kombinationstherapie mit Ertugliflozin und Sitagliptin
Insgesamt 291 Patienten mit Typ‑2 Diabetes, deren Blutzucker durch Diät und Bewegung nicht ausreichend kontrolliert werden konnte, wurden im Rahmen einer randomisierten, doppelblinden, multizentrischen, placebokontrollierten, 26‑wöchigen Studie zur Untersuchung der Wirksamkeit und Sicherheit von Ertugliflozin in Kombination mit Sitagliptin eingeschlossen. Die Patienten erhielten ohne antidiabetische Hintergrundtherapie randomisiert einmal täglich Ertugliflozin 5 mg oder Ertugliflozin 15 mg in Kombination mit Sitagliptin (100 mg) oder Placebo (siehe Tabelle 7).
Tabelle 7: Ergebnisse einer Studie über 26 Wochen zur Untersuchung von Ertugliflozin und Sitagliptin als Kombinationstherapie*
Ertugliflozin 5 mg + Sitagliptin | Ertugliflozin 15 mg + Sitagliptin | Placebo | |
HbA1c (%) | N = 98 | N = 96 | N = 96 |
Ausgangswert (Mittelwert) | 8,9 | 9,0 | 9,0 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –1,6 | –1,7 | –0,4 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –1,2‡ (–1,5; –0,8) | –1,2‡ (–1,6; –0,9) | |
Patienten [N (%)] mit HbA1c < 7 % | 35 (35,7)§ | 30 (31,3)§ | 8 (8,3) |
Körpergewicht (kg) | N = 98 | N = 96 | N = 97 |
Ausgangswert (Mittelwert) | 90,8 | 91,3 | 95,0 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –2,9 | –3,0 | –0,9 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –2,0‡ (–3,0; –1,0) | –2,1‡ (–3,1; –1,1) | |
* N beinhaltet alle Patienten, die mindestens eine Dosis der Studienmedikation erhalten haben und mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Ertugliflozin als Add-on-Kombinationstherapie mit Insulin (mit oder ohne Metformin)
Im Rahmen einer 18-wöchigen randomisierten, doppelblinden, multizentrischen, placebokontrollierten glykämischen Substudie der VERTIS-CV Studie wurden insgesamt 1 065 Patienten mit Typ-2 Diabetes mellitus und bestehender atherosklerotischer kardiovaskulärer Erkrankung und unzureichender Blutzuckerkontrolle (Hämoglobin A1c [HbA1c] zwischen 7 % und 10,5 %) mit einer Hintergrundtherapie mit Insulin ≥ 20 Einheiten/Tag (59 % der Patienten erhielten ebenfalls Metformin ≥ 1 500 mg/Tag) eingeschlossen und erhielten randomisiert einmal täglich Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Placebo (siehe Tabelle 8).
Tabelle 8: Ergebnisse einer Add-on Studie über 18 Wochen zur Untersuchung von Ertugliflozin in Kombination mit Insulin (mit oder ohne Metformin) bei Patienten mit Typ-2 Diabetes mellitus*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Placebo | |
HbA1c (%) | N = 348 | N = 370 | N = 347 |
Ausgangswert (Mittelwert) | 8,4 | 8,4 | 8,4 |
Abweichung vom Ausgangswert (LS-Mittelwert†) | –0,8 | –0,8 | –0,2 |
Differenz zu Placebo (LS-Mittelwert†, 95 % KI) | –0,6‡ (–0,7; –0,4) | –0,6‡ (–0,8; –0,5) | |
Patienten [N (%)] mit HbA1c < 7 % | 72 (20,7)§ | 78 (21,1)§ | 37 (10,7) |
Körpergewicht (kg) | N = 348 | N = 370 | N = 347 |
Ausgangswert (Mittelwert) | 93,8 | 92,1 | 93,3 |
Abweichung vom Ausgangswert (LS-Mittelwert†) | –1,9 | –2,1 | –0,2 |
Differenz zu Placebo (LS-Mittelwert†, 95 % KI) | –1,6‡ (–2,1; –1,1) | –1,9‡ (–2,4; –1,4) | |
* N beinhaltet alle randomisierten, behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Ertugliflozin als Add-on-Kombinationstherapie mit Metformin und Sulfonylharnstoff
Im Rahmen einer 18-wöchigen randomisierten, doppelblinden, multizentrischen, placebokontrollierten, glykämischen Substudie der VERTIS-CV Studie wurden insgesamt 330 Patienten mit Typ-2 Diabetes mellitus und bestehender atherosklerotischer kardiovaskulärer Erkrankung und unzureichender Blutzuckerkontrolle (HbA1c zwischen 7 % und 10,5 %) mit einer Hintergrundtherapie mit Metformin ≥ 1 500 mg/Tag und einem Sulfonylharnstoff eingeschlossen und erhielten randomisiert einmal täglich Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Placebo (siehe Tabelle 9).
Tabelle 9: Ergebnisse einer Add-on Studie über 18 Wochen zur Untersuchung von Ertugliflozin in Kombination mit Metformin und einem Sulfonylharnstoff bei Patienten mit Typ-2 Diabetes mellitus*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Placebo | |
HbA1c (%) | N = 100 | N = 113 | N = 117 |
Ausgangswert (Mittelwert) | 8,4 | 8,3 | 8,3 |
Abweichung vom Ausgangswert (LS-Mittelwert†) | –0,9 | –1,0 | –0,2 |
Differenz zu Placebo (LS-Mittelwert†, 95 % KI) | -0,7‡ (-0,9; -0,4) | -0,8‡ (-1,0; -0,5) | |
Patienten [N (%)] mit HbA1c < 7 % | 37 (37,0)§ | 37 (32,7)§ | 15 (12,8) |
Körpergewicht (kg) | N = 100 | N = 113 | N = 117 |
Ausgangswert (Mittelwert) | 92,1 | 92,9 | 90,5 |
Abweichung vom Ausgangswert (LS-Mittelwert†) | –2,0 | –2,4 | –0,5 |
Differenz zu Placebo (LS-Mittelwert†, 95 % KI) | –1,6‡ (–2,3; –0,8) | –1,9‡ (–2,6; –1,2) | |
* N beinhaltet alle randomisierten, behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
Moderate Einschränkung der Nierenfunktion
26-wöchige placebokontrollierte Studie
Die Wirksamkeit von Ertugliflozin wurde ebenfalls im Rahmen einer gesonderten Studie mit Diabetikern mit moderat eingeschränkter Nierenfunktion untersucht (468 Patienten mit einer eGFR ≥ 30 bis < 60 ml/min/1,73 m2).
Die Abweichungen des Least Square (LS)‑Mittelwerts (95 % KI) für HbA1c vom Ausgangswert betrugen für die Gruppen unter Ertugliflozin 5 mg, Ertugliflozin 15 mg und Placebo –0,29 (–0,44; –0,14), ‑0,41 (–0,56; 0,27) bzw. –0,26 (–0,42; –0,11). Die Senkung der HbA1c‑Werte in den Ertugliflozin-Behandlungsarmen unterschied sich nicht signifikant von Placebo. Die präspezifizierte Analyse der glykämischen Wirksamkeit war durch die gleichzeitige Anwendung unzulässiger antihyperglykämischer Arzneimittel verzerrt. Eine nachträgliche Analyse, in der Patienten, welche die unzulässigen Arzneimittel einnahmen, ausgeschlossen waren, ergab für Ertugliflozin 5 mg und 15 mg eine Senkung der HbA1c‑Werte in Differenz zu Placebo von –0,14 (–0,36; 0,08) bzw. –0,33 (–0,55; –0,11).
18-wöchige placebokontrollierte Studie
In der VERTIS-CV Studie waren 1.776 Patienten mit Typ-2 Diabetes mellitus und bestehender atherosklerotischer kardiovaskulärer Erkrankung und mit moderat eingeschränkter Nierenfunktion (eGFR ≥ 30 bis < 60 ml/min/1,73 m2) eingeschlossen. Davon hatten 1 319 Patienten eine eGFR ≥ 45 bis < 60 ml/min/1,73 m2, von welchen 879 Patienten Ertugliflozin erhielten (siehe Tabelle 10) und 457 Patienten eine eGFR ≥ 30 bis < 45 ml/min/1,73 m2, von welchen 299 Patienten Ertuglilfozin erhielten.
Tabelle 10: Ergebnisse einer Studie über 18 Wochen zur Untersuchung von Ertugliflozin in Patienten mit Typ-2 Diabetes mellitus und einer kardiovaskulären Erkrankung mit einem eGFR-Ausgangswert ≥ 45 bis < 60 ml/min/1,73 m2*
Ertugliflozin 5 mg | Ertugliflozin 15 mg | Placebo | |
HbA1c (%) | N = 465 | N = 413 | N = 439 |
Ausgangswert (Mittelwert) | 8,2 | 8,2 | 8,2 |
Abweichung vom Ausgangswert (LS-Mittelwert†) | -0,5 | -0,6 | -0,3 |
Differenz zu Placebo (LS-Mittelwert†, 95 % KI) | –0,3‡ (–0,4; –0,1) | –0,3‡ (–0,4; –0,2) | |
Körpergewicht (kg) | N = 465 | N = 413 | N = 439 |
Ausgangswert (Mittelwert) | 92,1 | 92,5 | 92,3 |
Abweichung vom Ausgangswert (LS‑Mittelwert†) | –1,8 | –1,9 | –0,5 |
Differenz zu Placebo (LS‑Mittelwert†, 95 % KI) | –1,3‡ (–1,7; –0,9) | –1,4‡ (–1,8; –1,0) | |
* N beinhaltet alle randomisierten, behandelten Patienten mit mindestens einer Messung der jeweiligen Zielgröße. | |||
In Patienten mit einer eGFR ≥ 30 bis < 45 ml/min/1,73 m2 unterschied sich die Senkung der HbA1c-Werte nach 18 Wochen signifikant gegenüber dem Ausgangswert zwischen Placebo und Ertugliflozin 5 mg, jedoch nicht signifikant zwischen Placebo und Ertugliflozin 15 mg.
Nüchternplasmaglucosespiegel
Im Rahmen von drei placebokontrollierten Studien führte die Behandlung mit Ertugliflozin zu einer statistisch signifikanten Senkung der Nüchternplasmaglucosespiegel (fasting plasma glucose, FPG). Die jeweilige Senkung der FPG lag für Ertugliflozin 5 mg und 15 mg in Differenz zu Placebo in der Monotherapie bei 1,92 bzw. 2,44 mmol/l, bei Anwendung als Add-on zu Metformin bei 1,48 bzw. 2,12 mmol/l und bei Anwendung als Add-on zu Metformin und Sitagliptin bei 1,40 bzw. 1,74 mmol/l.
Die Behandlung mit Ertugliflozin in Kombination mit Sitagliptin führte im Vergleich zur alleinigen Anwendung von Sitagliptin, Ertugliflozin oder Placebo zu einer signifikant stärkeren Senkung der FPG. Die Behandlung mit Ertugliflozin 5 mg oder 15 mg in Kombination mit Sitagliptin führte im Vergleich zur alleinigen Anwendung von Ertugliflozin zu einer schrittweisen Senkung der FPG um 0,46 mmol/l bis 0,65 mmol/l bzw. im Vergleich zur alleinigen Anwendung von Sitagliptin um 1,02 mmol/l bis 1,28 mmol/l. Die Behandlung mit Ertugliflozin 5 mg oder 15 mg in Kombination mit Sitagliptin führte in Differenz zu Placebo zu einer Senkung der FPG um 2,16 mmol/l bzw. 2,56 mmol/l.
Wirksamkeit bei Patienten mit einem HbA1c‑Ausgangswert ≥ 8 %
Im Rahmen der Studie zur Untersuchung von Steglatro als Monotherapie zusätzlich zu Diät und Bewegung bei Patienten mit HbA1c‑Ausgangswerten von 7 – 10,5 % betrug die Senkung der HbA1c‑Werte in der Subgruppe der Patienten mit einem Ausgangswert von ≥ 8 % unter Behandlung mit Ertugliflozin 5 mg oder 15 mg in Differenz zu Placebo 1,11 % bzw. 1,52 %.
Im Rahmen der Studie zur Untersuchung von Ertugliflozin als Add-on zu Metformin bei Patienten mit HbA1c‑Ausgangswerten von 7 – 10,5 % betrug die Senkung der HbA1c‑Werte in der Subgruppe der Patienten mit einem Ausgangswert von ≥ 9 % unter Behandlung mit Ertugliflozin 5 mg oder 15 mg in Differenz zu Placebo 1,31 % bzw. 1,43 %.
Im Rahmen der Studie bei Patienten mit HbA1c‑Ausgangswerten von 7,5 – 11 %, deren Blutzucker durch eine Therapie mit Metformin nicht ausreichend kontrolliert werden konnte, betrug die Senkung der HbA1c‑Werte in der Subgruppe der Patienten mit einem Ausgangswert von ≥ 10 % unter Behandlung mit Ertugliflozin 5 mg oder 15 mg in Kombination mit Sitagliptin 2,35 % bzw. 2,66 %, im Vergleich zu 2,10 %, 1,30 % und 1,82 % unter Behandlung mit den Einzelkomponenten Ertugliflozin 5 mg, 15 mg bzw. Sitagliptin.
Postprandiale Plasmaglucosespiegel
Im Rahmen der Monotherapiestudie führte die Behandlung mit Ertugliflozin 5 mg und 15 mg in Differenz zu Placebo zu einer statistisch signifikanten Senkung der postprandialen 2‑Stunden-Plasmaglucosespiegel (PPG) um 3,83 mmol/l bzw. 3,74 mmol/l.
Blutdruck
Im Rahmen von drei 26‑wöchigen, placebokontrollierten Studien konnte der systolische Blutdruck durch Ertugliflozin gesenkt werden. Die statistisch signifikante Senkung des systolischen Blutdrucks lag für Ertugliflozin 5 mg und Ertugliflozin 15 mg in Differenz zu Placebo im Bereich von 2,9 mmHg bis 3,7 mmHg bzw. 1,7 mmHg bis 4,5 mmHg.
Im Rahmen einer 52-wöchigen, aktivkontrollierten Studie vs. Glimepirid lag die Senkung des systolischen Blutdrucks im Vergleich zum Ausgangswert für Ertugliflozin 5 mg und Ertugliflozin 15 mg bei 2,2 mmHg bzw. 3,8 mmHg, während die Patienten unter Glimepirid einen Anstieg des systolischen Blutdrucks im Vergleich zum Ausgangswert um 1,0 mmHg hatten.
Subgruppenanalyse
Eine klinisch relevante Senkung der HbA1c‑Werte konnte bei Patienten mit Typ‑2 Diabetes unter Ertugliflozin über verschiedene Subgruppen hinweg, definiert nach Alter, Geschlecht, ethnischer und geographischer Herkunft, Body Mass Index (BMI)-Ausgangswert, HbA1c-Ausgangswert und Dauer der Typ‑2 Diabeteserkrankung beobachtet werden.
Kardiovaskuläre Endpunkte
Die Wirkung von Ertugliflozin auf das kardiovaskuläre Risiko bei erwachsenen Patienten mit Typ-2 Diabetes mellitus und bestehender atherosklerotischer kardiovaskulärer Erkrankung wurde im Rahmen der VERTIS-CV Studie, einer multizentrischen, multinationalen, randomisierten, doppelblinden, placebokontrollierten, endpunktbezogenen Studie, untersucht. Die Studie verglich das Risiko für das Auftreten von schweren kardiovaskulären Ereignissen (major adverse cardiovascular event, MACE) unter Ertugliflozin im Vergleich zu Placebo als Add-on zu Standardtherapien zur Behandlung von Diabetes und atherosklerotischen kardiovaskulären Erkrankungen.
Insgesamt wurden 8 246 Patienten randomisiert (Placebo N = 2 747, Ertugliflozin 5 mg N = 2 752, Ertugliflozin 15 mg N = 2 747) und im Median über 3 Jahre beobachtet. Das mittlere Alter lag bei 64 Jahren und ca. 70 % waren Männer.
Alle in der Studie eingeschlossenen Patienten hatten zu Studienbeginn einen unzureichend kontrollierten Typ-2 Diabetes mellitus (HbA1c ≥ 7 %). Die mittlere Dauer der Typ-2 Diabetes mellitus Erkrankung lag bei 13 Jahren, der mittlere HbA1c-Ausgangswert betrug 8,2 % und die mittlere eGFR lag bei 76 ml/min/1,73 m2. Zu Studienbeginn wurden die Patienten mit einem (32 %) oder mehreren (67 %) blutzuckersenkenden Arzneimitteln einschließlich Metformin (76 %), Insulin (47 %), Sulfonylharnstoff (41 %), Dipeptidylpeptidase-4 (DPP‑4) Inhibitoren (11 %) und Glucagon-like-Peptid-1 (GLP‑1) Rezeptoragonisten (3 %) behandelt.
Nahezu alle Patienten (99 %) hatten zu Studienbeginn eine bestehende atherosklerotische kardiovaskuläre Erkrankung. Ca. 24 % der Patienten hatten eine Herzinsuffizienz in der Vorgeschichte. Der primäre Endpunkt der VERTIS-CV Studie war die Zeit bis zum erstmaligen Auftreten eines MACE (kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt [MI] oder nicht-tödlicher Schlaganfall).
Ertugliflozin zeigte Nichtunterlegenheit im Vergleich zu Placebo hinsichtlich MACE (siehe Tabelle 11). Die Ergebnisse der Gruppen unter 5 mg und 15 mg Ertugliflozin waren konsistent mit den Ergebnissen der kombinierten Dosis-Gruppen.
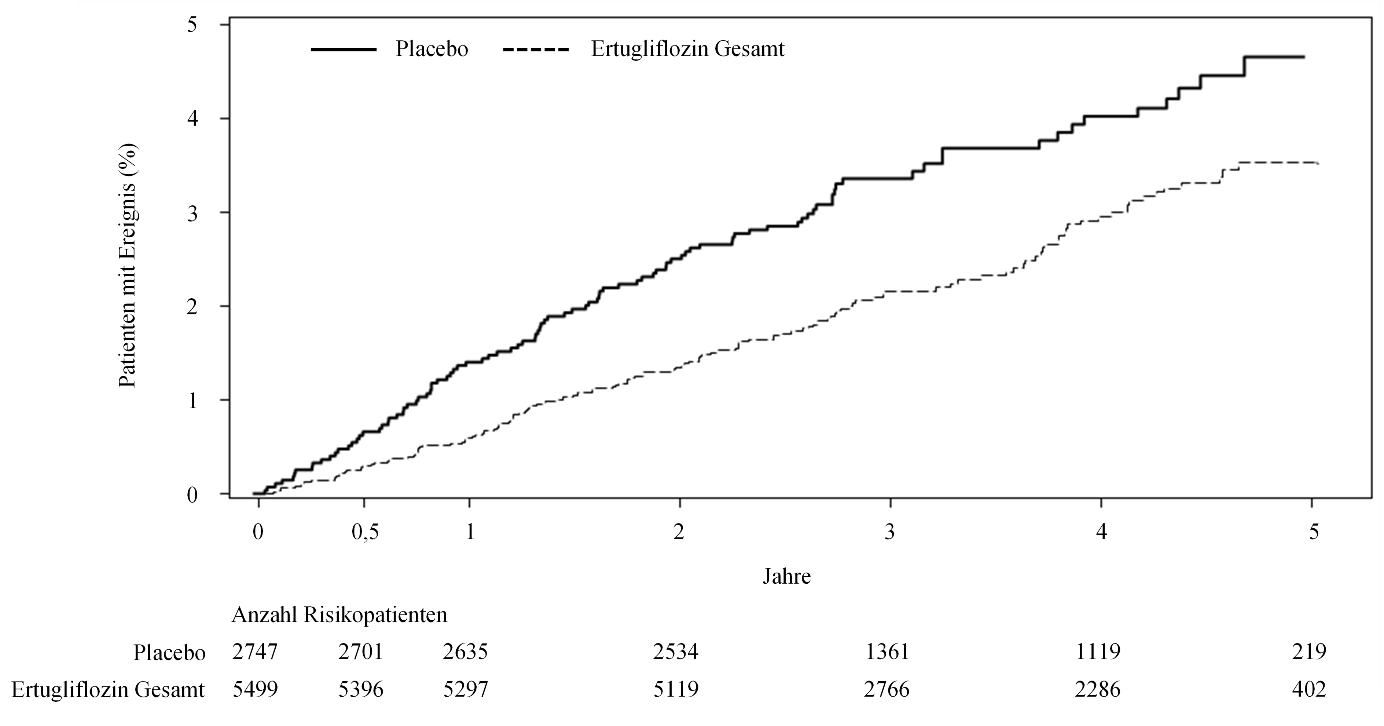
Bei Patienten, die mit Ertugliflozin behandelt wurden, war die Hospitalisierungsrate aufgrund einer Herzinsuffizienz geringer als bei Patienten, die mit Placebo behandelt wurden (siehe Tabelle 11 und Abbildung 1).
Tabelle 11: Auswertung der VERTIS-CV Studie bezüglich MACE, deren Komponenten und Hospitalisierung aufgrund einer Herzinsuffizienz*
Endpunkt† | Placebo (N = 2 747) | Ertugliflozin (N = 5 499) | |||
N (%) | Ereignisrate (pro 100 Patientenjahre) | N (%) | Ereignisrate (pro 100 Patientenjahre) | Hazard Ratio vs. Placebo | |
MACE (CV Tod, nicht-tödlicher MI oder nicht-tödlicher Schlaganfall) | 327 (11,9) | 4,0 | 653 (11,9) | 3,9 | 0,97 |
Nicht-tödlicher MI | 148 (5,4) | 1,6 | 310 (5,6) | 1,7 | 1,04 |
Nicht-tödlicher Schlaganfall | 78 (2,8) | 0,8 | 157 (2,9) | 0,8 | 1,00 |
CV Tod | 184 (6,7) | 1,9 | 341 (6,2) | 1,8 | 0,92 |
Hospitalisierung aufgrund einer Herzinsuffizienz# | 99 (3,6) | 1,1 | 139 (2,5) | 0,7 | 0,70 |
N = Anzahl der Patienten, KI = Konfidenzintervall, CV = kardiovaskulär, MI = Myokardinfarkt. | |||||
Abbildung 1: Zeit bis zum erstmaligen Auftreten des Ereignisses Hospitalisierung aufgrund einer Herzinsuffizienz
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Ertugliflozin eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen bei Typ‑2 Diabetes mellitus gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Allgemeine Einführung
Die Pharmakokinetik von Ertugliflozin ist bei gesunden Probanden und Patienten mit Typ‑2 Diabetes vergleichbar. Die mittlere Steady-State-Plasma-AUC und Cmax lagen bei einmal täglicher Behandlung mit Ertugliflozin 5 mg bei 398 ng·h/ml bzw. 81 ng/ml und bei einmal täglicher Behandlung mit Ertugliflozin 15 mg bei 1 193 ng·h/ml bzw. 268 ng/ml. Der Steady State wird bei einmal täglicher Gabe von Ertugliflozin nach 4 bis 6 Tagen erreicht. Ertugliflozin zeigt keine zeitabhängige Pharmakokinetik und akkumuliert im Plasma bis zu 10 – 40 % nach Mehrfachgabe.
Resorption
Maximale Plasmaspiegel (mediane Zeit bis zur maximalen Plasmakonzentration [Tmax]) treten nüchtern 1 Stunde nach einmaliger oraler Gabe von 5 mg und 15 mg Ertugliflozin auf. Plasma Cmax und AUC steigen dosisproportional für Ertugliflozin bei einmaliger Gabe im Bereich von 0,5 mg bis 300 mg und bei Mehrfachgabe im Bereich von 1 mg bis 100 mg. Die absolute orale Bioverfügbarkeit von Ertugliflozin nach Gabe von 15 mg liegt bei annähernd 100 %.
Die Einnahme von Ertugliflozin zu einer fettreichen und kalorienreichen Mahlzeit senkt die Cmax von Ertugliflozin um 29 % und verlängert die Tmax von Ertugliflozin um 1 Stunde. Die AUC bleibt jedoch im Vergleich zum Nüchternzustand unverändert. Der beobachtete Einfluss von Mahlzeiten auf die Pharmakokinetik von Ertugliflozin wird als klinisch nicht relevant erachtet, so dass Ertugliflozin unabhängig von den Mahlzeiten eingenommen werden kann. Im Rahmen der klinischen Phase III Studien wurde Ertugliflozin unabhängig von den Mahlzeiten eingenommen.
Ertugliflozin ist ein Substrat des P‑Glykoproteins (P‑gp) und des Brustkrebs-Resistenz-Protein (BCRP) Transporters.
Verteilung
Das mittlere Verteilungsvolumen im Steady State für Ertugliflozin liegt nach intravenöser Gabe bei 86 Liter. Die Plasmaproteinbindung von Ertugliflozin liegt bei 93,6 % und ist unabhängig von der Ertugliflozin-Plasmakonzentration. Die Plasmaproteinbindung ist bei Patienten mit eingeschränkter Nieren- oder Leberfunktion nicht nennenswert verändert. Das Blut-Plasma-Konzentrationsverhältnis von Ertugliflozin liegt bei 0,66.
Ertugliflozin ist kein Substrat von organischen Anionen-Transportern (OAT1, OAT3), organischen Kationen-Transportern (OCT1, OCT2) oder organischen Anionen-transportierenden Polypeptiden (OATP1B1, OATP1B3) in vitro.
Biotransformation
Ertugliflozin wird primär mittels Metabolisierung ausgeschieden. Ertugliflozin wird hauptsächlich durch UGT1A9- und UGT2B7-vermittelte O‑Glucuronidierung verstoffwechselt. Die zwei dabei entstehenden Glucuronide sind bei klinisch relevanten Konzentrationen pharmakologisch inaktiv. Die CYP-vermittelte (oxidative) Verstoffwechselung von Ertugliflozin ist minimal (12 %).
Elimination
Die mittlere systemische Plasma-Clearance nach intravenöser Gabe von 100 µg lag bei 11 Liter/h. Die mittlere Eliminationshalbwertszeit bei Typ‑2 Diabetikern mit normaler Nierenfunktion wurde auf Basis einer pharmakokinetischen Populationsanalyse ermittelt und beträgt 17 Stunden. Bei gesunden Probanden wurden nach der oralen Gabe einer [14C]‑Ertugliflozin Lösung ca. 41 % und 50 % der wirkstoffbezogenen Radioaktivität über die Fäzes bzw. Urin ausgeschieden. Nur 1,5 % der gegebenen Dosis wurden unverändert als Ertugliflozin über den Urin und 34 % unverändert als Ertugliflozin über die Fäzes ausgeschieden. Dies ist wahrscheinlich auf die biliäre Exkretion der Glucuronidmetaboliten mit nachfolgender Hydrolyse zum ursprünglichen Wirkstoff zurückzuführen.
Besondere Patientengruppen
Eingeschränkte Nierenfunktion
Im Rahmen einer Phase I Studie zur Untersuchung der klinischen Pharmakologie bei Patienten mit Typ‑2 Diabetes und leichter, moderater oder schwerer Einschränkung der Nierenfunktion (mittels eGFR bestimmt) betrug nach Einmalgabe von 15 mg Ertugliflozin der mittlere Anstieg der AUC von Ertugliflozin das ≤ 1,7‑Fache im Vergleich zu Patienten mit normaler Nierenfunktion. Dieser Anstieg der AUC von Ertugliflozin wird als klinisch nicht relevant erachtet. Zwischen den Patientengruppen mit unterschiedlicher Nierenfunktion gab es keine klinisch relevanten Unterschiede bzgl. der Cmax von Ertugliflozin. Die Glucoseausscheidung im Urin über 24 Stunden nahm mit zunehmendem Schweregrad der Einschränkung der Nierenfunktion ab (siehe Abschnitt 4.4). Die Plasmaproteinbindung von Ertugliflozin war bei Patienten mit eingeschränkter Nierenfunktion unverändert.
Eingeschränkte Leberfunktion
Eine moderate Einschränkung der Leberfunktion (gemäß Child-Pugh-Klassifikation) führte zu keinem Anstieg der Exposition von Ertugliflozin. Die AUC und Cmax von Ertugliflozin nahm um ca. 13 % bzw. ca. 21 % im Vergleich zu Patienten mit normaler Leberfunktion ab. Diese Abnahme der Exposition von Ertugliflozin wird als klinisch nicht relevant erachtet. Es liegen keine klinischen Erfahrungen bei Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh-Klasse C) vor. Die Plasmaproteinbindung von Ertugliflozin war bei Patienten mit moderater Einschränkung der Leberfunktion unverändert.
Kinder und Jugendliche
Es wurden keine Studien mit Ertugliflozin bei Kindern und Jugendlichen durchgeführt.
Auswirkungen von Alter, Körpergewicht, Geschlecht und ethnischer Herkunft
Basierend auf den Ergebnissen einer pharmakokinetischen Populationsanalyse haben Alter, Körpergewicht, Geschlecht und ethnische Herkunft keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Ertugliflozin.
Arzneimittelwechselwirkungen
In vitro Untersuchungen von Ertugliflozin
Im Rahmen von in vitro Studien zeigten Ertugliflozin und Ertugliflozin-Glucuronide weder eine Hemmung oder Inaktivierung von CYP1A2, 2C9, 2C19, 2C8, 2B6, 2D6 oder 3A4 noch eine Induktion von CYP1A2, 2B6 oder 3A4. Ertugliflozin und Ertugliflozin-Glucuronide zeigten keine Hemmung der Aktivität von UGT1A6, 1A9 oder 2B7 in vitro. Ertugliflozin zeigte in höheren, klinisch nicht relevanten Konzentrationen eine leichte Hemmung von UGT1A1 und 1A4 in vitro. Ertugliflozin-Glucuronide hatten keinen Einfluss auf diese Isoformen. Insgesamt ist es unwahrscheinlich, dass Ertugliflozin die Pharmakokinetik von gemeinsam angewendeten Arzneimitteln, welche über diese Enzyme eliminiert werden, beeinflusst.
Ertugliflozin oder Ertugliflozin-Glucuronide zeigen in klinisch relevanten Konzentrationen keine relevante Hemmung von P‑gp, OCT2-, OAT1- oder OAT3-Transportern oder von transportierenden Polypeptiden OATP1B1 und OATP1B3 in vitro. Insgesamt ist es unwahrscheinlich, dass Ertugliflozin die Pharmakokinetik von gemeinsam angewendeten Arzneimitteln, welche Substrate dieser Transporter sind, beeinflusst.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, akuten Toxizität, Toxizität bei wiederholter Verabreichung, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Toxizität allgemein
Toxizitätsstudien mit wiederholter oraler Verabreichung wurden an Mäusen, Ratten und Hunden über einen Zeitraum von 13, 26 bzw. 39 Wochen durchgeführt. Anzeichen von unerwünschter Toxizität wurden im Allgemeinen bei Expositionen beobachtet, die mindestens 77‑fach höher waren als beim Menschen (AUC) bei einer für den Menschen empfohlenen Maximaldosis (maximum recommended human dose, MRHD) von 15 mg/Tag. Die meisten Fälle von Toxizität entsprachen der Pharmakologie und standen im Zusammenhang mit renalem Glucoseverlust. Dazu zählten vermindertes Körpergewicht und Körperfett, gesteigerte Nahrungsaufnahme, Diarrhö, Dehydratation, erniedrigte Serumglucosespiegel und Anstieg anderer Serumparameter, die auf einen erhöhten Proteinstoffwechsel hindeuten, Gluconeogenese und Elektrolytungleichgewichte und Veränderungen des Urins wie Polyurie, Glucosurie und Hypercalciurie. Mikroskopische Veränderungen bzgl. Glucosurie und/oder Hypercalciurie wurden nur bei Nagetieren beobachtet und schlossen eine Dilatation der renalen Tubuli, Hypertrophie der Zona glomerulosa in den Nebennieren (Ratten) und einer Zunahme der trabekulären Strukturen im Knochen (Ratten) ein. Außer Erbrechen gab es keine Anzeichen unerwünschter Toxizität bei Hunden bei einer 379‑fach höheren, ungebundenen Exposition als beim Menschen (AUC) bei einer MRHD von 15 mg/Tag.
Kanzerogenität
Im Rahmen der 2‑jährigen Studie zur Untersuchung der Kanzerogenität bei Mäusen wurde Ertugliflozin in Dosen von 5, 15 und 40 mg/kg/Tag oral per Sonde verabreicht. Es gab keine Ertugliflozin-bedingten neoplastischen Befunde bei Dosen bis zu 40 mg/kg/Tag (was basierend auf der AUC einer ca. 41‑fach höheren ungebundenen Exposition als beim Menschen bei einer MRHD von 15 mg/Tag entspricht). Im Rahmen der 2‑jährigen Studie zur Untersuchung der Kanzerogenität bei Ratten wurde Ertugliflozin in Dosen von 1,5, 5 und 15 mg/kg/Tag oral per Sonde verabreicht. Bei männlichen Ratten kam es bei einer Dosis von 15 mg/kg/Tag zu Ertugliflozin-bedingten neoplastischen Befunden wie einem Anstieg der Inzidenz benigner Phäochromozytome im Nebennierenmark. Dieser Befund wurde auf eine unzureichende Kohlehydrataufnahme mit einhergehender veränderter Calciumhomöostase zurückgeführt und wurde als nicht relevantes Risiko für den Menschen erachtet. Die maximale nicht wirksame Dosis (no observed effect level, NOEL) für Neoplasien betrug 5 mg/kg/Tag (ca. 16‑fach höhere ungebundene Exposition als beim Menschen bei einer MRHD von 15 mg/Tag).
Mutagenität
Ertugliflozin war sowohl mit als auch ohne metabolische Aktivierung weder in der mikrobiellen Rückmutation, noch in zytogenetischen in vitro Tests (humane Lymphozyten) oder in in vivo Mikronukleustests an Ratten mutagen oder clastogen.
Reproduktionstoxizität
Im Rahmen der Studie zur Untersuchung der Fertilität und embryonalen Entwicklung bei männlichen und weiblichen Ratten, wurde Ertugliflozin in Dosen von 5, 25 und 250 mg/kg/Tag verabreicht. Es wurden keine Auswirkungen auf die Fertilität bei einer Dosis von 250 mg/kg/Tag beobachtet (was basierend auf der AUC einer ca. 386‑fach höheren ungebundenen Exposition als beim Menschen bei einer MRHD von 15 mg/Tag entspricht). Die Entwicklung von Ratten und Kaninchen wurde durch Ertugliflozin nach maternaler Exposition, die basierend auf der AUC 239‑ bzw. 1 069‑fach höher war als die maximale klinische Dosis beim Menschen von 15 mg/Tag, nicht nachteilig beeinflusst. Bei einer für Ratten maternal toxischen Dosis (250 mg/kg/Tag), welche 510‑fach höher als die maximale klinische Dosis von 15 mg/Tag war, wurden eine verringerte fötale Lebensfähigkeit und eine erhöhte Inzidenz von viszeralen Fehlbildungen beobachtet.
Im Rahmen der Studie zur Untersuchung der prä- und postnatalen Entwicklung bei Ratten wurde nach Verabreichung von Ertugliflozin ≥ 100 mg/kg/Tag (was basierend auf der AUC einer ca. 239‑fach höheren Exposition als beim Menschen bei einer maximalen klinischen Dosis von 15 mg/Tag entspricht) von Tag 6 der Trächtigkeit bis zu Tag 21 der Säugezeit ein verringertes postnatales Wachstum und eine verminderte Entwicklung beobachtet. Bei einer Dosis von 250 mg/kg/Tag war die Geschlechtsreife bei beiden Geschlechtern verzögert (was basierend auf der AUC einer ca. 620‑fach höheren Exposition als beim Menschen bei einer MRHD von 15 mg/Tag entspricht).
Bei der Verabreichung von Ertugliflozin an juvenile Ratten postnatal nach 21 bis 90 Tagen, einem Zeitraum, in dem die Entwicklung der Nieren stattfindet und welcher dem späten zweiten und dritten Trimester der Schwangerschaft beim Menschen entspricht, wurden bei einer Exposition, die basierend auf der AUC 13‑fach höher als die maximale klinische Dosis beim Menschen von 15 mg/Tag war, erhöhtes Gewicht der Nieren, Dilatation der Nierenbecken und Nierentubuli und Mineralisation der Nierentubuli beobachtet. Auswirkungen auf die Knochenentwicklung (Verkürzung des Oberschenkelknochens und Erhöhung des trabekulären Knochenanteils im Oberschenkelknochen) sowie verzögerte Geschlechtsreife wurden bei einer Exposition, die basierend auf der AUC 817‑fach höher als beim Menschen bei einer MRHD von 15 mg/Tag war, beobachtet. Die Auswirkungen auf Nieren- und Knochenentwicklung waren innerhalb der einmonatigen Erholungsphase nicht vollständig reversibel.
Tablettenkern
Mikrokristalline Cellulose (E460)
Lactose-Monohydrat
Carboxymethylstärke-Natrium (Typ A) (Ph.Eur.)
Magnesiumstearat (E470b)
Filmüberzug
Hypromellose 2910/6 (E464)
Lactose-Monohydrat
Macrogol 3350 (E1521)
Triacetin (E1518)
Titandioxid (E171)
Eisen(III)-oxid (E172)
Nicht zutreffend.
2 Jahre
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Aluminium/PVC/PA/Aluminium Blisterpackung.
Packungen zu 14, 28, 30, 84, 90 und 98 Filmtabletten in nicht perforierten Blisterpackungen.
Packungen zu 30 x 1 Filmtabletten in perforierten Einzeldosis-Blisterpackungen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Merck Sharp & Dohme B.V.
Waarderweg 39
2031 BN Haarlem
Niederlande
Steglatro 5 mg Filmtabletten
EU/1/18/1267/001
EU/1/18/1267/002
EU/1/18/1267/003
EU/1/18/1267/004
EU/1/18/1267/005
EU/1/18/1267/006
EU/1/18/1267/013
Steglatro 15 mg Filmtabletten
EU/1/18/1267/007
EU/1/18/1267/008
EU/1/18/1267/009
EU/1/18/1267/010
EU/1/18/1267/011
EU/1/18/1267/012
EU/1/18/1267/014
Datum der Erteilung der Zulassung: 21. März 2018
Datum der letzten Verlängerung der Zulassung: 15. November 2022
September 2024
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
Für weitere Informationen zu diesem Präparat wenden Sie sich bitte an die deutsche Vertretung des Zulassungsinhabers:
MSD Sharp & Dohme GmbH
Levelingstr. 4a
81673 München
Tel.: 0800/673 673 673
Fax: 0800/673 673 329
E-Mail: e-mail@msd.de
Steglatro-GPC/Type II WS-2729
RCN: 000027005-DE
FACH-9000353-0002