▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
Tibsovo 250 mg Filmtabletten
Jede Filmtablette enthält 250 mg Ivosidenib.
Sonstiger Bestandteil mit bekannter Wirkung:
Jede Filmtablette enthält Lactose-Monohydrat, entsprechend 9,5 mg Lactose (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette (Tablette).
Blaue, ovale Filmtabletten mit einer Länge von ca. 18 mm, mit der Prägung "IVO" auf der einen Seite und "250" auf der anderen Seite.
Tibsovo in Kombination mit Azacitidin wird angewendet zur Behandlung von erwachsenen Patienten mit neu diagnostizierter akuter myeloischer Leukämie (AML) mit einer Isocitrat-Dehydrogenase-1 (IDH1)-R132-Mutation, die für eine Standard-Induktionschemotherapie nicht geeignet sind (siehe Abschnitt 5.1).
Tibsovo als Monotherapie wird angewendet zur Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem Cholangiokarzinom mit einer IDH1-R132-Mutation, die zuvor bereits mit mindestens einer systemischen Therapie behandelt worden sind (siehe Abschnitt 5.1).
Die Behandlung soll unter Aufsicht von Ärzten eingeleitet werden, die Erfahrung in der Anwendung von Arzneimitteln gegen Krebs haben.
Vor der Einnahme von Tibsovo muss bei den Patienten eine IDH1-R132-Mutation durch einen geeigneten diagnostischen Test nachgewiesen werden.
Dosierung
Akute myeloische Leukämie
Die empfohlene Dosis beträgt 500 mg Ivosidenib (2 x 250 mg Tabletten), die einmal täglich oral eingenommen werden.
Die Behandlung mit Ivosidenib sollte am Tag 1 des ersten Zyklus begonnen werden, in Kombination mit Azacitidin in einer Dosierung von 75 mg/m2 Körperoberfläche, intravenös oder subkutan, einmal täglich an den Tagen 1-7 eines jeden 28-Tage-Zyklus. Der erste Behandlungszyklus mit Azacitidin sollte mit 100 % der Dosis durchgeführt werden. Es wird empfohlen, dass die Patienten mindestens sechs Zyklen lang behandelt werden.
Die Dosierung und die Art der Verabreichung von Azacitidin entnehmen Sie bitte der vollständigen Produktinformation für Azacitidin.
Die Behandlung sollte bis zum Fortschreiten der Krankheit bzw. bis die Behandlung vom Patienten nicht mehr vertragen wird, fortgesetzt werden.
Cholangiokarzinom
Die empfohlene Dosis beträgt 500 mg Ivosidenib (2 x 250 mg Tabletten), die einmal täglich oral eingenommen werden.
Die Behandlung sollte fortgesetzt werden bis zum Fortschreiten der Erkrankung oder bis die Behandlung vom Patienten nicht mehr vertragen wird.
Verpasste oder verspätete Einnahme
Wenn eine Dosis ausgelassen oder nicht zur üblichen Zeit eingenommen wurde, sollen die Tabletten so bald wie möglich innerhalb von 12 Stunden nach der verpassten Dosis eingenommen werden. Zwei Dosen dürfen nicht innerhalb von 12 Stunden eingenommen werden. Die Tabletten sollen am folgenden Tag wie gewohnt eingenommen werden.
Wenn eine Dosis erbrochen wird, sollen keine Tabletten als Ersatz eingenommen werden. Die Tabletten sollen am folgenden Tag wie gewohnt eingenommen werden.
Vorsichtsmaßnahmen vor Verabreichung und Überwachung
Vor Beginn der Behandlung muss ein Elektrokardiogramm (EKG) erstellt werden. Das herzfrequenzkorrigierte QT-Intervall (QTc-Intervall) soll vor Beginn der Behandlung weniger als 450 Millisekunden (ms) betragen. Bei einem anormalen QT-Intervall soll der Arzt das Nutzen-Risiko-Verhältnis eines Behandlungsbeginns mit Ivosidenib gründlich abwägen. Liegt die QTc-Intervall-Verlängerung zwischen 480 ms und 500 ms, soll die Behandlung mit Ivosidenib nur ausnahmsweise erfolgen und nur unter engmaschiger Überwachung stattfinden.
Vor Behandlungsbeginn sowie danach mindestens einmal wöchentlich während der ersten 3 Wochen der Therapie muss ein EKG erstellt werden. Anschließend muss dies monatlich erfolgen, sofern das QTc-Intervall bei ≤ 480 ms bleibt. QTc-Intervall-Anomalien sollen umgehend behandelt werden (siehe Tabelle 1 und Abschnitt 4.4). Sofern klinisch angezeigt, soll im Falle einer suggestiven Symptomatik ein EKG erstellt werden.
Die gleichzeitige Einnahme von Arzneimitteln, die bekanntermaßen das QTc-Intervall verlängern, sowie die gleichzeitige Einnahme von moderaten oder starken CYP3A4-Inhibitoren kann das Risiko einer QTc-Intervall-Verlängerung erhöhen und soll während der Behandlung mit Tibsovo nach Möglichkeit vermieden werden. Wenn die Anwendung einer geeigneten Alternative nicht möglich ist, soll Tibsovo bei diesen Patienten mit Vorsicht angewendet und eine engmaschige Kontrolle auf eine QTc-Intervall-Verlängerung durchgeführt werden. Vor einer gleichzeitigen Anwendung soll ein EKG erstellt werden, eine wöchentliche Überwachung soll über mindestens 3 Wochen erfolgen und danach, wenn es klinisch angezeigt ist (siehe unten und Abschnitte 4.4, 4.5 und 4.8).
Das komplette Blutbild und die Blutchemie sollen vor Beginn der Behandlung mit Tibsovo, mindestens einmal wöchentlich während des ersten Therapiemonats, einmal alle zwei Wochen während des zweiten Therapiemonats und, sofern klinisch angezeigt, bei jedem Arztbesuch während der gesamten Therapiedauer untersucht werden.
Dosisanpassung bei gleichzeitiger Verabreichung von moderaten oder starken CYP3A4- Inhibitoren
Wenn die Anwendung von moderaten oder starken CYP3A4-Inhibitoren nicht vermieden werden kann, soll die empfohlene Dosis von Ivosidenib auf einmal täglich 250 mg (1 x 250 mg Tablette) reduziert werden. Wenn der moderate oder starke CYP3A4-Inhibitor abgesetzt wird, soll die Dosis von Ivosidenib nach mindestens 5 Halbwertszeiten des CYP3A4-Inhibitors auf 500 mg erhöht werden (siehe oben und Abschnitte 4.4 und 4.5).
Dosisanpassungen und Empfehlungen zum Umgang mit Nebenwirkungen
Tabelle 1 - Empfohlene Dosisanpassungen bei Nebenwirkungen
Nebenwirkung | Empfohlene Maßnahme |
Differenzierungssyndrom |
|
Leukozytose (Anzahl der weißen Blutkörperchen > 25 x 109/l oder ein absoluter Anstieg der Gesamtanzahl der weißen Blutkörperchen > 15 x 109/l gegenüber dem Ausgangswert, siehe Abschnitte 4.4 und 4.8) |
|
QTc-Intervall-Verlängerung ˃ 480 bis 500 ms |
|
QTc-Intervall-Verlängerung ˃ 500 ms |
|
QTc-Intervall-Verlängerung mit Anzeichen/Symptomen einer lebensbedrohlichen ventrikulären Arrhythmie |
|
Andere Nebenwirkungen des Grades 3 oder höher |
|
Grad 1 ist leicht, Grad 2 ist moderat, Grad 3 ist schwer und Grad 4 ist lebensbedrohlich.
Besondere Patientengruppen
Ältere Patienten
Bei älteren Patienten (≥ 65 Jahre) ist keine Dosisanpassung erforderlich (siehe Abschnitte 4.8 und 5.2). Für Patienten im Alter von 85 Jahren oder älter liegen keine Daten vor.
Nierenfunktionsstörung
Bei Patienten mit leichter (eGFR ≥ 60 bis ˂ 90 ml/min/1,73 m2) oder mäßiger (eGFR ≥ 30 bis ˂ 60 ml/min/1,73 m2) Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Eine empfohlene Dosis für Patienten mit schwerer Nierenfunktionsstörung (eGFR ˂ 30 ml/min/1,73 m2) wurde nicht ermittelt. Tibsovo muss daher bei Patienten mit schwerer Nierenfunktionsstörung mit Vorsicht und unter engmaschiger Überwachung angewendet werden (siehe Abschnitte 4.4 und 5.2).
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klasse A) ist keine Dosisanpassung erforderlich. Eine empfohlene Dosis für Patienten mit mäßiger bzw. schwerer Leberfunktionsstörung (Child-Pugh-Klassen B und C) wurde nicht ermittelt. Tibsovo muss daher bei Patienten mit mäßiger bzw. schwerer Leberfunktionsstörung mit Vorsicht und unter engmaschiger Überwachung angewendet werden (siehe Abschnitte 4.4 und 5.2).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Tibsovo bei Kindern und Jugendlichen ˂ 18 Jahren ist bisher nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Tibsovo ist zur oralen Anwendung bestimmt.
Die Tabletten werden einmal täglich etwa zur gleichen Zeit eingenommen. Die Patienten sollten 2 Stunden vor und bis 1 Stunde nach der Einnahme der Tabletten nichts essen (siehe Abschnitt 5.2). Die Tabletten sollen im Ganzen mit Wasser geschluckt werden.
Die Patienten sollen darauf hingewiesen werden, Grapefruit und Grapefruitsaft während der Behandlung zu vermeiden (siehe Abschnitt 4.5). Ferner sollen sie darauf aufmerksam gemacht werden, das im Tablettenbehältnis enthaltene Silicagel-Trockenmittel nicht zu schlucken (siehe Abschnitt 6.5).
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Gleichzeitige Gabe von starken CYP3A4-Induktoren oder Dabigatran (siehe Abschnitt 4.5).
Angeborenes Long-QT-Syndrom.
Plötzlicher Tod oder polymorphe ventrikuläre Arrhythmie in der Familienanamnese.
QT/QTc-Intervall > 500 ms, unabhängig von der Korrekturmethode (siehe Abschnitte 4.2 und 4.4).
Differenzierungssyndrom bei Patienten mit akuter myeloischer Leukämie
Unter der Behandlung mit Ivosidenib wurden Fälle des Differenzierungssyndroms berichtet (siehe Abschnitt 4.8). Wenn unbehandelt, kann dies lebensbedrohlich oder tödlich sein (siehe unten und Abschnitt 4.2). Das Differenzierungssyndrom geht mit einer schnellen Proliferation und Differenzierung von myeloischen Zellen einher. Zu den Symptomen gehören: nichtinfektiöse Leukozytose, peripheres Ödem, Pyrexie, Dyspnoe, Pleuraerguss, Hypotonie, Hypoxie, Lungenödem, Pneumonie, Perikarderguss, Hautausschlag, Hyperhydratation, Tumorlysesyndrom und ein erhöhter Kreatininwert.
Patienten müssen über die Anzeichen und Symptome des Differenzierungssyndroms informiert und darauf hingewiesen werden, dass sie sich bei Auftreten dieser Symptome unverzüglich an ihren Arzt wenden müssen und dass sie die Patientenkarte zur sicheren Anwendung stets bei sich tragen müssen.
Bei Verdacht auf ein Differenzierungssyndrom sind bis zum Abklingen der Symptome und für mindestens 3 Tage systemische Kortikosteroide zu verabreichen und eine hämodynamische Überwachung einzuleiten.
Wenn eine Leukozytose beobachtet wird, ist eine Behandlung mit Hydroxycarbamid gemäß den Behandlungsstandards/ Leitlinien und, sofern klinisch angezeigt, eine Leukapherese einzuleiten (siehe Abschnitt 4.5).
Kortikosteroide und Hydroxycarbamid sind erst nach Abklingen der Symptome auszuschleichen. Die Symptome des Differenzierungssyndroms können bei vorzeitigem Absetzen der Kortikosteroid- und/oder Hydroxycarbamid-Behandlung erneut auftreten. Wenn schwere Symptome nach Beginn der systemischen Kortikosteroid-Gabe mehr als 48 Stunden anhalten, ist die Behandlung mit Tibsovo zu unterbrechen. Die Behandlung kann mit einmal täglich 500 mg Ivosidenib wieder aufgenommen werden, wenn die Symptome mäßig sind oder sich verringern und sich der klinische Zustand des Patienten gebessert hat.
QTc-Intervall-Verlängerung
Unter der Behandlung mit Ivosidenib wurde eine Verlängerung des QTc-Intervalls berichtet (siehe Abschnitt 4.8).
Ein EKG muss vor Beginn der Behandlung, mindestens einmal wöchentlich während der ersten 3 Therapiewochen und danach, wenn das QTc-Intervall ≤ 480 ms bleibt, monatlich durchgeführt werden (siehe Abschnitt 4.2). Alle Anomalien sollen umgehend behandelt werden (siehe Abschnitt 4.2). Sofern klinisch angezeigt, soll im Falle einer suggestiven Symptomatik ein EKG durchgeführt werden. Bei schwerem Erbrechen und/oder Durchfall muss eine Bewertung der Serumelektrolytanomalien, insbesondere der Hypokaliämie und des Magnesiums, durchgeführt werden.
Die Patienten sind über das Risiko einer QT-Verlängerung und die damit verbundenen Anzeichen und Symptome (Herzklopfen, Schwindel, Synkope oder sogar Herzstillstand) zu informieren und darauf hinzuweisen, dass sie sich bei Auftreten dieser Symptome unverzüglich an ihren Arzt wenden müssen.
Die gleichzeitige Gabe von QTc-Intervall-verlängernden Arzneimitteln sowie von moderaten oder starken CYP3A4-Inhibitoren kann das Risiko einer QTc-Intervall-Verlängerung erhöhen und soll während der Behandlung mit Tibsovo nach Möglichkeit vermieden werden. Wenn die Anwendung einer geeigneten Alternative nicht möglich ist, ist Tibsovo bei diesen Patienten mit Vorsicht anzuwenden und eine engmaschige Kontrolle auf eine QTc-Intervall-Verlängerung durchzuführen. Vor einer gleichzeitigen Anwendung soll ein EKG durchgeführt werden, für mindestens 3 Wochen soll eine wöchentliche Überwachung stattfinden und danach je nach klinischer Indikation. Die empfohlene Dosis von Ivosidenib soll auf einmal täglich 250 mg reduziert werden, wenn die Anwendung von moderaten oder starken CYP3A4-Inhibitoren nicht vermieden werden kann (siehe Abschnitte 4.2 und 4.5).
Wenn die Gabe von Furosemid (ein OAT3-Substrat) klinisch indiziert ist, um Anzeichen/Symptome des Differenzierungssyndroms zu behandeln, sind die Patienten engmaschig auf Elektrolytstörungen und auf eine QTc-Intervall-Verlängerung zu überwachen.
Patienten mit kongestiver Herzinsuffizienz oder Elektrolytanomalien sind während der Behandlung mit Ivosidenib engmaschig unter Durchführung regelmäßiger EKG- und Elektrolyt-Kontrollen zu überwachen.
Tibsovo ist dauerhaft abzusetzen, wenn bei Patienten eine QTc-Intervall-Verlängerung mit Anzeichen oder Symptomen einer lebensbedrohlichen Arrhythmie auftritt (siehe Abschnitt 4.2).
Ivosidenib sollte bei Patienten mit Albuminwerten unterhalb des Normbereichs oder bei untergewichtigen Patienten mit Vorsicht angewendet werden.
Schwere Nierenfunktionsstörung
Die Sicherheit und Wirksamkeit von Ivosidenib wurde bei Patienten mit schwerer Nierenfunktionsstörung (eGFR ˂ 30 ml/min/1,73 m2) nicht ermittelt. Tibsovo soll bei Patienten mit schwerer Nierenfunktionsstörung mit Vorsicht angewendet werden und diese Patientengruppe ist engmaschig zu überwachen (siehe Abschnitte 4.2 und 5.2).
Leberfunktionsstörung
Die Sicherheit und Wirksamkeit von Ivosidenib wurde bei Patienten mit mäßiger bzw. schwerer Leberfunktionsstörung (Child-Pugh-Klassen B und C) nicht ermittelt. Tibsovo soll bei Patienten mit mäßiger bzw. schwerer Leberfunktionsstörung mit Vorsicht angewendet werden und diese Patientengruppe ist engmaschig zu überwachen (siehe Abschnitte 4.2 und 5.2).
Tibsovo soll bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klasse A) mit Vorsicht angewendet werden (siehe Abschnitt 4.8).
CYP3A4-Substrate
Ivosidenib induziert CYP3A4 und kann daher die systemische Exposition gegenüber CYP3A4-Substraten verringern.
Wenn die Anwendung von Itraconazol oder Ketoconazol nicht vermieden werden kann, sollen die Patienten hinsichtlich des Verlusts der antimykotischen Wirksamkeit dieser Arzneimittel überwacht werden (siehe Abschnitt 4.5).
Frauen im gebärfähigen Alter/Verhütung
Frauen im gebärfähigen Alter sollen vor Beginn der Behandlung mit Tibsovo einen Schwangerschaftstest durchführen und eine Schwangerschaft während der Therapie vermeiden (siehe Abschnitt 4.6).
Frauen im gebärfähigen Alter und Männer mit Partnerinnen im gebärfähigen Alter sollen während der Behandlung mit Tibsovo und für mindestens 1 Monat nach der letzten Dosis eine zuverlässige Verhütungsmethode anwenden.
Ivosidenib kann die systemische Konzentration von hormonellen Verhütungsmitteln vermindern, weshalb die gleichzeitige Anwendung einer Barriere-Methode zur Empfängnisverhütung empfohlen wird (siehe Abschnitte 4.5 und 4.6).
Lactoseintoleranz
Tibsovo enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollen Tibsovo nicht einnehmen.
Natriumgehalt
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d. h. es ist nahezu "natriumfrei".
Auswirkungen anderer Arzneimittel auf Ivosidenib
Starke CYP3A4-Induktoren
Ivosidenib ist ein CYP3A4-Substrat. Die gleichzeitige Anwendung von starken CYP3A4-Induktoren (z. B. Carbamazepin, Phenobarbital, Phenytoin, Rifampicin, Johanniskraut (Hypericum perforatum)) wird voraussichtlich die Plasmakonzentration von Ivosidenib verringern und ist während der Behandlung mit Tibsovo kontraindiziert (siehe Abschnitt 4.3). Klinische Studien zur Bewertung der Pharmakokinetik von Ivosidenib in Gegenwart eines CYP3A4-Induktors wurden nicht durchgeführt.
Moderate oder starke CYP3A4-Inhibitoren
Bei gesunden Probanden erhöhte die Verabreichung einer Einzeldosis von 250 mg Ivosidenib und 200 mg Itraconazol einmal täglich über 18 Tage die AUC von Ivosidenib um 169 % (90 % CI: 145; 195), ohne dass sich die Cmax veränderte. Die gleichzeitige Anwendung mit moderaten oder starken CYP3A4-Inhibitoren erhöht die Plasmakonzentration von Ivosidenib. Dies kann das Risiko einer QTc-Intervall-Verlängerung erhöhen. Daher sollen während der Behandlung mit Tibsovo, wann immer möglich, geeignete Alternativen, die keine moderaten oder starken CYP3A4-Inhibitoren sind, in Betracht gezogen werden. Wenn die Anwendung einer geeigneten Alternative nicht möglich ist, sollen die Patienten mit Vorsicht behandelt und engmaschig hinsichtlich einer QTc-Intervall-Verlängerung überwacht werden. Wenn die Verwendung von moderaten oder starken CYP3A4-Inhibitoren nicht vermieden werden kann, soll die empfohlene Dosis von Ivosidenib auf 250 mg einmal täglich reduziert werden (siehe Abschnitte 4.2 und 4.4).
Moderate CYP3A4-Inhibitoren sind u.a.: Aprepitant, Ciclosporin, Diltiazem, Erythromycin, Fluconazol, Grapefruit und Grapefruitsaft, Isavuconazol, Verapamil.
Starke CYP3A4-Inhibitoren sind u.a.: Clarithromycin, Itraconazol, Ketoconazol, Posaconazol, Ritonavir, Voriconazol.
Arzneimittel, die bekanntermaßen das QTc-Intervall verlängern
Die gleichzeitige Gabe von Arzneimitteln, die bekanntermaßen das QTc-Intervall verlängern (z. B. Anti‑Arrhythmika, Fluorchinolone, 5-HT3-Rezeptor-Antagonisten, Triazol-Antimykotika), kann das Risiko einer QTc-Intervall-Verlängerung erhöhen und soll während der Behandlung mit Tibsovo nach Möglichkeit vermieden werden. Wenn die Anwendung einer geeigneten Alternative nicht möglich ist, sollen die Patienten mit Vorsicht behandelt und engmaschig hinsichtlich einer QTc-Intervall-Verlängerung überwacht werden (siehe Abschnitte 4.2 und 4.4).
Auswirkungen von Ivosidenib auf andere Arzneimittel
Wechselwirkungen mit Transportern
Ivosidenib hemmt P-gp und hat das Potenzial, P-gp zu induzieren. Daher kann es die systemische Exposition gegenüber Wirkstoffen, die überwiegend durch P-gp transportiert werden (z. B. Dabigatran), verändern. Die gleichzeitige Anwendung von Dabigatran ist kontraindiziert (siehe Abschnitt 4.3).
Ivosidenib hemmt OAT3, das organische Anionen-transportierende Polypeptid 1B1 (OATP1B1) und das organische Anionen-transportierende Polypeptid 1B3 (OATP1B3). Daher kann es die systemische Exposition gegenüber OAT3 oder OATP1B1/1B3-Substraten erhöhen. Die gleichzeitige Verabreichung von OAT3-Substraten (z. B. Benzylpenicillin, Furosemid) oder sensitiven OATP1B1/1B3-Substraten (z. B. Atorvastatin, Pravastatin, Rosuvastatin) soll während der Behandlung mit Tibsovo nach Möglichkeit vermieden werden (siehe Abschnitt 5.2). Patienten sollen mit Vorsicht behandelt werden, wenn die Verwendung einer geeigneten Alternative nicht möglich ist. Wenn die Gabe von Furosemid klinisch indiziert ist, um Anzeichen/Symptome eines Differenzierungssyndroms zu behandeln, sind die Patienten engmaschig auf Elektrolytstörungen und hinsichtlich einer QTc-Intervall-Verlängerung zu überwachen.
Enzyminduktion
Cytochrom P450 (CYP)-Enzyme
Ivosidenib induziert CYP3A4, CYP2B6, CYP2C8, CYP2C9 und kann CYP2C19 induzieren. Daher kann es die systemische Exposition gegenüber Substraten dieser Enzyme verringern. Geeignete Alternativen, die keine CYP3A4-, CYP2B6-, CYP2C8- oder CYP2C9-Substrate mit einer geringen therapeutischen Breite oder CYP2C19-Substrate sind, sollten während der Behandlung mit Tibsovo in Betracht gezogen werden. Die Patienten sind hinsichtlich eines Verlusts der Substrateffizienz zu überwachen, wenn die Anwendung solcher Arzneimittel nicht vermieden werden kann (siehe Abschnitt 5.2).
Zu den CYP3A4-Substraten mit einer geringen therapeutischen Breite gehören u.a.: Alfentanil, Ciclosporin, Everolimus, Fentanyl, Pimozid, Chinidin, Sirolimus, Tacrolimus.
Zu den CYP2B6-Substraten mit geringer therapeutischer Breite gehören u.a.: Cyclophosphamid, Ifosfamid, Methadon.
Zu den CYP2C8-Substraten mit geringer therapeutischer Breite gehören u.a.: Paclitaxel, Pioglitazon, Repaglinid.
Zu den CYP2C9-Substraten mit geringer therapeutischer Breite gehören u.a.: Phenytoin, Warfarin.
Zu den CYP2C19-Substraten gehört u.a.: Omeprazol.
Itraconazol oder Ketoconazol dürfen wegen des zu erwartenden Verlustes der antimykotischen Wirksamkeit nicht gleichzeitig mit Tibsovo angewendet werden.
Ivosidenib kann die systemische Konzentration von hormonellen Verhütungsmitteln vermindern, weshalb die gleichzeitige Anwendung einer Barriere-Methode zur Empfängnisverhütung für mindestens 1 Monat nach der letzten Dosis empfohlen wird (siehe Abschnitte 4.4 und 4.6).
Uridindiphosphat-Glucuronosyltransferasen (UGTs)
Ivosidenib hat das Potenzial UGTs zu induzieren und kann daher die systemische Exposition gegenüber Substraten dieser Enzyme (z. B. Lamotrigin, Raltegravir) verringern. Geeignete Alternativen, die keine UGT-Substrate sind, sollen während der Behandlung mit Tibsovo in Betracht gezogen werden. Die Patienten sind hinsichtlich des Verlusts der Wirksamkeit von UGT-Substraten zu überwachen, wenn die Anwendung solcher Arzneimittel nicht vermieden werden kann (siehe Abschnitt 5.2).
Frauen im gebärfähigen Alter/Empfängnisverhütung
Frauen im gebärfähigen Alter sollen vor Beginn der Behandlung mit Tibsovo einen Schwangerschaftstest durchführen und eine Schwangerschaft während der Therapie vermeiden (siehe Abschnitt 4.4).
Frauen im gebärfähigen Alter und Männer mit Partnerinnen im gebärfähigen Alter müssen während der Behandlung mit Tibsovo und für mindestens 1 Monat nach der letzten Dosis eine zuverlässige Verhütungsmethode anwenden.
Ivosidenib kann die systemische Konzentration von hormonellen Verhütungsmitteln vermindern. Daher wird die gleichzeitige Anwendung einer alternativen Verhütungsmethode, wie eine Barriere-Methode, empfohlen (siehe Abschnitte 4.4 und 4.5).
Schwangerschaft
Es liegen keine ausreichenden Daten über die Anwendung von Ivosidenib bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Die Anwendung von Tibsovo während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, wird nicht empfohlen. Patientinnen müssen über das potenzielle Risiko für den Fötus informiert werden, wenn Tibsovo während der Schwangerschaft angewendet wird oder wenn eine Patientin (oder die Partnerin eines behandelten männlichen Patienten) während der Behandlung oder im Zeitraum von einem Monat nach der letzten Dosis schwanger wird.
Stillzeit
Es ist nicht bekannt, ob Ivosidenib und seine Metaboliten in die Muttermilch übergehen. Es wurden keine Studien an Tieren durchgeführt, um die Ausscheidung von Ivosidenib und seiner Metaboliten in die Milch zu bewerten. Ein Risiko für das Neugeborene/den Säugling kann nicht ausgeschlossen werden.
Das Stillen soll während der Behandlung mit Tibsovo und für mindestens 1 Monat nach der letzten Dosis unterbrochen werden.
Fertilität
Es liegen keine Daten über die Auswirkungen von Ivosidenib auf die Fertilität vor. Es wurden keine Fertilitätsstudien an Tieren durchgeführt, um den Einfluss von Ivosidenib zu beurteilen. Unerwünschte Wirkungen auf die Fortpflanzungsorgane wurden in einer 28-tägigen Studie zur Toxizität bei wiederholter Gabe beobachtet (siehe Abschnitt 5.3). Die klinische Relevanz dieser Wirkungen ist nicht bekannt.
Ivosidenib hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Ermüdung und Schwindelgefühl wurden bei einigen Patienten unter Ivosidenib berichtet (siehe Abschnitt 4.8). Dies sollte bei der Beurteilung der Verkehrstüchtigkeit und der Fähigkeit zum Bedienen von Maschinen berücksichtigt werden.
Neu diagnostizierte akute myeloische Leukämie in Kombination mit Azacitidin
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen waren Erbrechen (40 %), Neutropenie (31 %), Thrombozytopenie (28 %), QT-Verlängerung im Elektrokardiogramm (21 %) und Schlaflosigkeit (19 %).
Die häufigsten schwerwiegenden Nebenwirkungen waren Differenzierungssyndrom (8 %) und Thrombozytopenie (3 %).
Bei Patienten, die mit Ivosidenib in Kombination mit Azacitidin behandelt wurden, lag die Häufigkeit des Abbruchs der Behandlung mit Ivosidenib aufgrund von Nebenwirkungen bei 6 %. Nebenwirkungen, die zum Abbruch führten, waren QT-Verlängerung im Elektrokardiogramm (1 %), Schlaflosigkeit (1 %), Neutropenie (1 %) und Thrombozytopenie (1 %).
Die Häufigkeit einer Dosisunterbrechung von Ivosidenib aufgrund von Nebenwirkungen betrug 35 %. Die häufigsten Nebenwirkungen, die zu einer Dosisunterbrechung führten, waren Neutropenie (24 %), QT-Verlängerung im Elektrokardiogramm (7 %), Thrombozytopenie (7 %), Leukopenie (4 %) und Differenzierungssyndrom (3 %).
Die Häufigkeit einer Dosisreduktion von Ivosidenib aufgrund von Nebenwirkungen betrug 19 %. Nebenwirkungen, die zu einer Dosisreduktion führten, waren QT-Verlängerung im Elektrokardiogramm (10 %), Neutropenie (8 %) und Thrombozytopenie (1 %).
Tabellarische Auflistung der Nebenwirkungen
Die Häufigkeiten der Nebenwirkungen basieren auf der Studie AG120-C-009, in die 72 Patienten mit neu diagnostizierter AML eingeschlossen waren, welche randomisiert mit Ivosidenib (500 mg täglich) in Kombination mit Azacitidin behandelt wurden. Die mediane Dauer der Behandlung mit Tibsovo betrug 8 Monate (Spanne 0,1 bis 40,0 Monate).
Die Häufigkeiten der Nebenwirkungen beruhen auf den Häufigkeiten von unerwünschten Ereignissen jeglicher Ursache, wobei ein Teil der Ereignisse andere Ursachen als Ivosidenib haben kann, wie z. B. die Krankheit, andere Arzneimittel oder nicht damit zusammenhängende Gründe.
Die Häufigkeiten sind definiert als: sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1 000, < 1/100); selten (≥ 1/10 000, < 1/1 000); sehr selten (< 1/10 000). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet.
Tabelle 2 - Nebenwirkungen bei Patienten mit neu diagnostizierter AML, die in der klinischen Studie AG120-C-009 mit Ivosidenib in Kombination mit Azacitidin behandelt wurden (N=72) | ||
Systemorganklasse | Häufigkeit | Nebenwirkungen |
Erkrankungen des Blutes und des Lymphsystems | Sehr häufig | Differenzierungssyndrom, Leukozytose, Thrombozytopenie, Neutropenie |
Häufig | Leukopenie | |
Psychiatrische Erkrankungen | Sehr häufig | Schlaflosigkeit |
Erkrankungen des Nervensystems | Sehr häufig | Kopfschmerzen, Schwindelgefühl |
Häufig | Periphere Neuropathie | |
Erkrankungen des Gastrointestinaltrakts | Sehr häufig | Erbrechen1 |
Häufig | Oropharyngeale Schmerzen | |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Sehr häufig | Schmerzen in den Extremitäten, Arthralgie, Rückenschmerzen |
Untersuchungen | Sehr häufig | QT-Verlängerung im Elektrokardiogramm |
1 Der Sammelbegriff umfasst Erbrechen und Würgen. | ||
Zuvor behandeltes, lokal fortgeschrittenes oder metastasiertes Cholangiokarzinom
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen waren Ermüdung (43 %), Übelkeit (42 %), Abdomialschmerz (35 %), Durchfall (35 %), verminderter Appetit (24 %), Aszites (23 %), Erbrechen (23 %), Anämie (19 %) und Hautausschlag (15 %).
Die häufigsten schwerwiegenden Nebenwirkungen waren Aszites (2 %), Hyperbilirubinämie (2 %) und cholestatische Gelbsucht (2 %).
Bei Patienten, die mit Ivosidenib behandelt wurden, lag die Häufigkeit eines Behandlungsabbruchs aufgrund von Nebenwirkungen bei 2 %. Nebenwirkungen, die zum Abbruch führten, waren Aszites (1 %) und Hyperbilirubinämie (1 %).
Die Häufigkeit einer Dosisunterbrechung von Ivosidenib aufgrund von Nebenwirkungen betrug 16 %. Die häufigsten Nebenwirkungen, die zu einer Dosisunterbrechung führten, waren Hyperbilirubinämie (3 %), erhöhte Alanin-Aminotransferase (3 %), erhöhte Aspartat-Aminotransferase (3 %), Aszites (2 %) und Ermüdung (2 %).
Die Häufigkeit einer Dosisreduktion von Ivosidenib aufgrund von Nebenwirkungen betrug 4 %. Nebenwirkungen, die zu einer Dosisreduktion führten, waren QT-Verlängerung im Elektrokardiogramm (3 %) und periphere Neuropathie (1 %).
Tabellarische Auflistung der Nebenwirkungen
Die Häufigkeiten der Nebenwirkungen basieren auf der Studie AG120-C-005, in die 123 Patienten mit einem vorbehandelten, lokal fortgeschrittenen oder metastasierten Cholangiokarzinom eingeschlossen waren, welche randomisiert mit 500 mg Ivosidenib einmal täglich behandelt wurden. Die mediane Dauer der Behandlung mit Tibsovo betrug 2,8 Monate (Spanne 0,1 bis 45,1 Monate; Mittelwert (Standardabweichung [SD]) 6,7 (8,2) Monate).
Die Häufigkeiten der Nebenwirkungen beruhen auf der Häufigkeit von unerwünschten Ereignissen jeglicher Ursache, wobei ein Teil der Ereignisse andere Ursachen als Ivosidenib haben kann, wie z. B. die Krankheit, andere Arzneimittel oder nicht damit zusammenhängende Gründe.
Die Häufigkeiten sind definiert als: sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1 000, < 1/100); selten (≥ 1/10 000, < 1/1 000); sehr selten (< 1/10 000). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet.
Tabelle 3 – Nebenwirkungen bei Patienten mit lokal fortgeschrittenem oder metastasiertem Cholangiokarzinom, die in der klinischen Studie AG120-C-005 mit Ivosidenib behandelt wurden (N=123) | |||
Systemorganklasse | Häufigkeit | Nebenwirkungen | |
Erkrankungen des Blutes und des Lymphsystems | Sehr häufig | Anämie | |
Stoffwechsel- und Ernährungsstörungen | Sehr häufig | Verminderter Appetit | |
Erkrankungen des Nervensystems | Sehr häufig | Periphere Neuropathie, Kopfschmerzen | |
Erkrankungen des Gastrointestinaltrakts | Sehr häufig | Aszites, Diarrhoe, Erbrechen, Übelkeit, Abdominalschmerz | |
Leber- und Gallenerkrankungen | Häufig | Cholestatische Gelbsucht, Hyperbilirubinämie | |
Erkrankungen der Haut und des Unterhautgewebes | Sehr häufig | Ausschlag1 | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Sehr häufig | Ermüdung | |
Häufig | Stürze | ||
Untersuchungen | Sehr häufig | Aspartat-Aminotransferase | |
Häufig | QT-Verlängerung im Elektrokardiogramm, | ||
1 | Der Sammelbegriff beinhaltet Hautausschlag, makulo-papulösen Ausschlag, Erythem, makulösen Ausschlag, exfoliative generalisierte Dermatitis, Medikamentenausschlag und Arzneimittelüberempfindlichkeit. | ||
Beschreibung ausgewählter Nebenwirkungen
Differenzierungssyndrom bei Patienten mit akuter myeloischer Leukämie (siehe Abschnitte 4.2 und 4.4)
In der Studie AG120-C-009 mit 72 Patienten mit neu diagnostizierter AML, die mit Tibsovo in Kombination mit Azacitidin behandelt wurden, trat bei 14 % ein Differenzierungssyndrom auf. Kein Patient brach die Behandlung mit Ivosidenib aufgrund des Differenzierungssyndroms ab. Bei einer Minderheit der Patienten war eine Dosisunterbrechung (3 %) zur Behandlung der Anzeichen/Symptome erforderlich. Von den 10 Patienten, bei denen ein Differenzierungssyndrom auftrat, erholten sich alle nach der Behandlung oder nach einer Dosisunterbrechung mit Tibsovo. Die mediane Zeit bis zum Auftreten des Differenzierungssyndroms betrug 20 Tage. Das Differenzierungssyndrom trat bereits 3 Tage und bis zu 46 Tage nach Behandlungsbeginn während der Kombinationstherapie auf.
QTc-Intervall-Verlängerung (siehe Abschnitte 4.2, 4.4 und 4.5)
In der Studie AG120-C-009, bei der 72 Patienten mit neu diagnostizierter AML mit Ivosidenib in Kombination mit Azacitidin behandelt wurden, wurde bei 21 % eine QT-Verlängerung im Elektrokardiogramm festgestellt, wobei diese bei 11 % vom Grad 3 oder höher war.
Basierend auf der Analyse der EKGs wurde bei 15 % der Patienten, die mit Ivosidenib in Kombination mit Azacitidin behandelt wurden und bei denen mindestens eine EKG-Bewertung nach Studienbeginn durchgeführt wurde, ein QTc-Intervall ˃ 500 ms festgestellt. 24 % hatten eine QTc-Verlängerung ˃ 60 ms gegenüber dem Ausgangswert. Ein Prozent (1 %) der Patienten brach die Behandlung mit Ivosidenib aufgrund einer QT-Verlängerung im Elektrokardiogramm ab. Bei 7 % bzw. 10 % der Patienten war eine Dosisunterbrechung bzw. -reduktion erforderlich. Die mediane Zeit bis zum Auftreten der QT-Verlängerung bei den mit Ivosidenib behandelten Patienten betrug 29 Tage. QT-Verlängerungen im Elektrokardiogramm traten bereits 1 Tag und bis zu 18 Monate nach Beginn der Behandlung auf.
In der Studie AG120-C-005, bei der 123 Patienten mit lokal fortgeschrittenem oder metastasiertem Cholangiokarzinom mit einer Ivosidenib-Monotherapie behandelt wurden, wurden bei 10 % der Patienten eine QT-Verlängerung im Elektrokardiogramm festgestellt, wobei diese bei 2 % vom Grad 3 oder höher war.
Basierend auf der Analyse der EKGs hatten 2 % der Patienten ein QTc-Intervall ˃ 500 ms und 5 % eine QTc-Intervallverlängerung ˃ 60 ms gegenüber dem Ausgangswert. Bei 3 % der Patienten war eine Dosisreduktion zur Behandlung von Anzeichen/Symptomen erforderlich. Die mediane Zeit bis zum Auftreten einer QT-Verlängerung bei Patienten, die mit Ivosidenib in Monotherapie behandelt wurden, betrug 28 Tage. QT-Verlängerungen im Elektrokardiogramm traten bereits 1 Tag und bis zu 23 Monate nach Beginn der Behandlung auf.
Besondere Patientengruppen
Leberfunktionsstörung
Die Sicherheit und Wirksamkeit von Ivosidenib bei Patienten mit mäßiger bzw. schwerer Leberfunktionsstörung (Child-Pugh-Klassen B und C) wurde nicht ermittelt. Bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klasse A) wurde eine Tendenz zu einer höheren Inzidenz von Nebenwirkungen beobachtet (siehe Abschnitte 4.2 und 5.2.).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Im Falle einer Überdosierung ist es wahrscheinlich, dass sich die Toxizität als Verschlimmerung der mit Ivosidenib assoziierten Nebenwirkungen manifestiert (siehe Abschnitt 4.8). Die Patienten sollten engmaschig überwacht werden und eine angemessene unterstützende Behandlung erhalten (siehe Abschnitte 4.2 und 4.4). Es gibt kein spezifisches Antidot im Fall einer Überdosierung von Ivosidenib.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel; andere antineoplastische Mittel
ATC-Code: L01XX62
Wirkmechanismus
Ivosidenib ist ein Inhibitor des mutierten IDH1-Enzyms. Das mutierte IDH1-Enzym wandelt Alpha-Ketoglutarat (α-KG) in 2-Hydroxyglutarat (2-HG) um, welches die zelluläre Differenzierung blockiert und die Tumorentstehung sowohl bei hämatologischen als auch bei nicht-hämatologischen Malignomen fördert. Der Wirkmechanismus von Ivosidenib, der über seine Fähigkeit zur Reduktion von 2-HG und zur Wiederherstellung der zellulären Differenzierung hinausgeht, ist nicht vollständig für alle Indikationen geklärt.
Pharmakodynamische Wirkungen
Mehrere Dosen von täglich 500 mg Ivosidenib verringerten die Plasmakonzentrationen von 2-HG bei Patienten mit hämatologischen Malignomen und Cholangiokarzinomen mit IDH1-Mutation auf Werte, die denen von gesunden Probanden nahekommen. Im Knochenmark von Patienten mit hämatologischen Malignomen und in der Tumorbiopsie von Patienten mit Cholangiokarzinom wurde eine Verringerung der mittleren 2-HG-Konzentrationen (% Variationskoeffizient [% CV]) auf 93,1 % (11,1 %) bzw. 82,2 % (32,4 %) festgestellt.
Basierend auf einer Analyse von 173 Patienten mit AML, die einmal täglich 500 mg Ivosidenib erhielten, wurde unter Verwendung eines Ivosidenib-Konzentrations-QTc-Modells eine konzentrationsabhängige QTc-Intervall-Verlängerung von etwa 17,2 ms (90 % CI: 14,7; 19,7) im Steady-State-Cmax vorhergesagt. Basierend auf einer Analyse von 101 Patienten mit Cholangiokarzinom, die täglich 500 mg Ivosidenib erhielten, wurde eine konzentrationsabhängige QTc-Intervall-Verlängerung von etwa 17,2 ms (90 % CI: 14,3; 20,2) im Steady-State-Cmax nach einer täglichen Dosis von 500 mg beobachtet (siehe Abschnitte 4.2 und 4.4).
Klinische Wirksamkeit und Sicherheit
Neu diagnostizierte akute myeloische Leukämie in Kombination mit Azacitidin
Die Wirksamkeit und Sicherheit von Tibsovo wurde in einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten klinischen Studie (AG120-C-009) an 146 erwachsenen Patienten mit zuvor unbehandelter AML mit einer IDH1-Mutation untersucht, die für eine intensive Induktionschemotherapie nicht in Frage kamen, da sie mindestens eines der folgenden Kriterien erfüllten: 75 Jahre oder älter, einen Eastern Cooperative Oncology Group (ECOG)-Performance-Status von Grad 2, schwere Herz- oder Lungenerkrankung, Leberfunktionsstörung mit Bilirubin > 1,5‑fache der oberen Norm, Kreatinin-Clearance < 45 ml/min oder andere Komorbiditäten. Bei allen Patienten wurde unter Verwendung des Abbott RealTimeTM IDH-1-Assay eine Genmutationsanalyse aus Knochenmark und/oder peripherem Blut zur zentralen Bestätigung der IDH1-Mutation durchgeführt. Die Patienten wurden randomisiert und erhielten entweder 500 mg Tibsovo oder ein entsprechendes Placebo oral einmal täglich in Kombination mit Azacitidin 75 mg/m2/Tag subkutan oder intravenös jede vierte Woche eine Woche lang bis zum Ende der Studie, bis zum Fortschreiten der Krankheit oder bis zu inakzeptabler Toxizität.
Das mediane Alter der mit Tibsovo behandelten Patienten betrug 76 Jahre (Spanne: 58 bis 84). 58 % der Patienten waren männlich. 21 % waren asiatische Patienten, 17 % waren Patienten weißer Hautfarbe (Kaukasier) und für 61 % liegen keine weiteren Angaben vor. 19 % der Patienten hatten einen ECOG-Perfomance-Status 0, 44 % einen ECOG 1 und 36 % einen ECOG 2.
75 % der Patienten hatten eine de novo AML. Bewertet von Prüfärzten, basierend auf den klinischen Praxisrichtlinien des National Comprehensive Cancer Networks (NCCN) für Onkologie (2017) hatten 4 % der Patienten ein geringes, 67 % ein intermediäres/mittleres und 26 % ein hohes/sonstiges zytogenetisches Risiko.
Die Wirksamkeit wurde auf Basis des primären Wirksamkeitsendpunktes, dem ereignisfreien Überleben (EFS), ab dem Zeitpunkt der Randomisierung bis zum Versagen der Behandlung, einem Rückfall nach Remission oder dem Tod durch jegliche Ursache, beurteilt. Als Therapieversagen wurde das Nichterreichen einer kompletten Remission (complete remission, CR) bis Woche 24 definiert. Das Gesamtüberleben (overall survival, OS), die CR-Rate, CR+CR mit partieller hämatologischer Regeneration (CR+CRh) und die Objektive Ansprechrate (objective response rate, ORR) waren wichtige sekundäre Wirksamkeitsendpunkte (Tabelle 4 und Abbildung 1).
Tabelle 4 - Ergebnisse zur Wirksamkeit bei Patienten mit neu diagnostizierter AML in Kombination mit Azacitidin | |||
Endpunkt | Ivosidenib | Placebo + Azacitidin | |
Ereignisfreies Überleben (EFS), Ereignisse (%) | 46 (63,9) | 62 (83,8) | |
Therapieversagen | 42 (58,3) | 59 (79,7) | |
Hazard Ratio1 (95 % CI) | 0,33 (0,16; 0,69) | ||
OS-Ereignisse (%) | 28 (38,9) | 46 (62,2) | |
Medianes OS (95 % CI) Monate | 24,0 (11,3; 34,1) | 7,9 (4,1; 11,3) | |
Hazard Ratio1 (95 % CI) | 0,44 (0,27; 0,73) | ||
CR, n (%) | 34 (47,2) | 11 (14,9) | |
95 % CI2 | (35,3; 59,3) | (7,7; 25,0) | |
Odds Ratio3 (95 % CI) | 4,76 (2,15; 10,50) | ||
CR + CRh-Rate, n (%) | 38 (52,8) | 13 (17,6) | |
95 % CI2 | (40,7; 64,7) | (9,7; 28,2) | |
Odds Ratio3 (95% CI) | 5,01 (2,32; 10,81) | ||
CR + CRi-Rate, n (%) | 39 (54,2) | 12 (16,2) | |
95 % CI2 | (42,0; 66,0) | (8,7; 26,6) | |
Odds Ratio3 (95 % CI) | 5,90 (2,69; 12,97) | ||
CI: Konfidenzintervall; CR = Komplette Remission; CRh = Komplette Remission mit teilweiser hämatologischer Regeneration; CRi = Komplette Remission mit unvollständiger hämatologischer Regeneration; OS = Gesamtüberleben; PR = Partielle Remission. | |||
1 | Die Hazard Ratio wird anhand eines Cox proportional Hazards Model ermittelt, das nach den Randomisierungsfaktoren (AML-Status und geografische Region) stratifiziert ist, wobei PBO+AZA als Nenner dient. | ||
2 | Das CI des Prozentsatzes wird mit der Methode nach Clopper und Pearson (exakte Binomialmethode) berechnet. | ||
3 | Die Cochran-Mantel-Haenszel-Schätzung (CMH) für die Odds Ratio wird mit PBO+AZA als Nenner berechnet. | ||
AG120=Ivosidenib |
Eine aktualisierte OS-Analyse, die bei 64,2 % (N = 95) der Ereignisse durchgeführt wurde, bestätigte den Gesamtüberlebensvorteil von Tibsovo in Kombination mit Azacitidin im Vergleich zu Placebo in Kombination mit Azacitidin mit einem medianen OS von 29,3 Monaten bzw. 7,9 Monaten (HR = 0,42; 95 % CI: 0,27 bis 0,65).
Zuvor behandeltes, lokal fortgeschrittenes oder metastasiertes Cholangiokarzinom
Die Wirksamkeit von Tibsovo wurde in einer randomisierten (2:1), multizentrischen, doppelblinden, placebokontrollierten klinischen Phase-3-Studie (Studie AG120-C-005) an 185 erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem Cholangiokarzinom mit einer IDH1-R132-Mutation untersucht, deren Krankheit nach mindestens einer, aber nicht mehr als zwei vorangegangenen Behandlungen, einschließlich mindestens einer Gemcitabin- oder 5-FU-haltigen Therapie, fortgeschritten war, und die eine voraussichtliche Überlebenszeit von ≥ 3 Monaten hatten.
Die Patienten erhielten randomisiert entweder einmal täglich 500 mg Tibsovo oral oder ein entsprechendes Placebo bis zum Fortschreiten der Krankheit oder bis zum Auftreten einer inakzeptablen Toxizität. Die Randomisierung erfolgte stratifiziert nach der Anzahl der vorangegangenen Therapien (1 oder 2). Geeignete Patienten, die auf Placebo randomisiert wurden, durften nach radiologisch gesichertem Fortschreiten der Erkrankung durch einen Prüfarzt auf Tibsovo umgestellt werden. Genmutationsanalysen zur zentralen Bestätigung der IDH1-Mutation aus Tumorgewebebiopsien wurden bei allen Patienten mit dem OncomineTM Dx-Target-Test durchgeführt.
Das mediane Alter betrug 62 Jahre (Spanne: 33 bis 83). Die Mehrheit der Patienten war weiblich (63 %), 57 % waren Kaukasier/weißer Hautfarbe. 37 % hatten einen ECOG-Performance Status von 0 und 62 % von 1. Alle Patienten hatten mindestens eine vorherige systemische Therapie erhalten, 47 % hatten zwei Vortherapien. Die meisten Patienten hatten zum Zeitpunkt der Diagnose ein intrahepatisches Cholangiokarzinom (91 %) und 92 % hatten Metastasen. In beiden Armen hatten 70 % der Patienten eine R132C-Mutation, 15 % eine R132L-Mutation, 12 % eine R132G-Mutation, 1,6 % eine R132S-Mutation und 1,1 % eine R132H-Mutation.
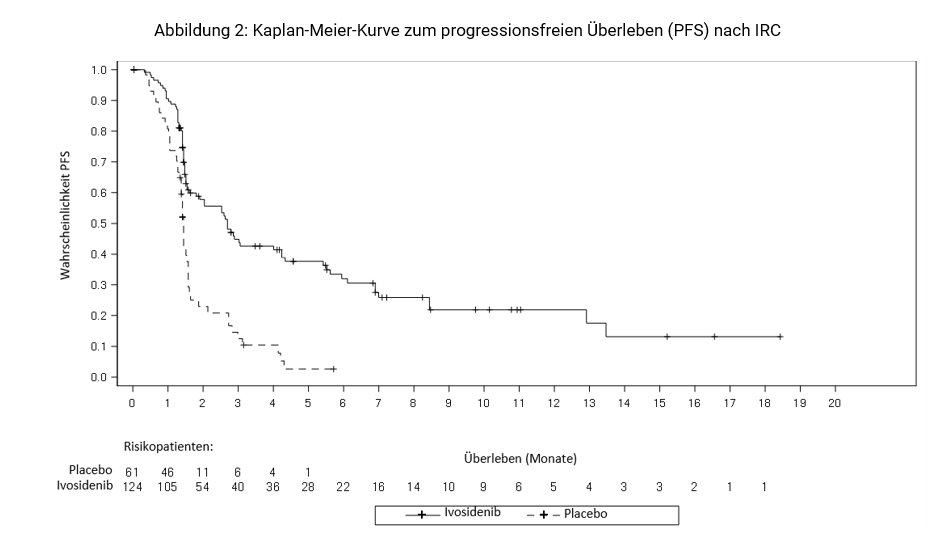
Der primäre Endpunkt bezüglich der Wirksamkeit war das progressionsfreie Überleben (PFS), das vom Independent Radiology Center (IRC) gemäß der Response Evaluation Criteria in Solid Tumors (RECIST) v1.1 bestimmt wurde und als die Zeit ab der Randomisierung bis zum Fortschreiten der Erkrankung oder bis zum Tod durch jegliche Ursache definiert war.
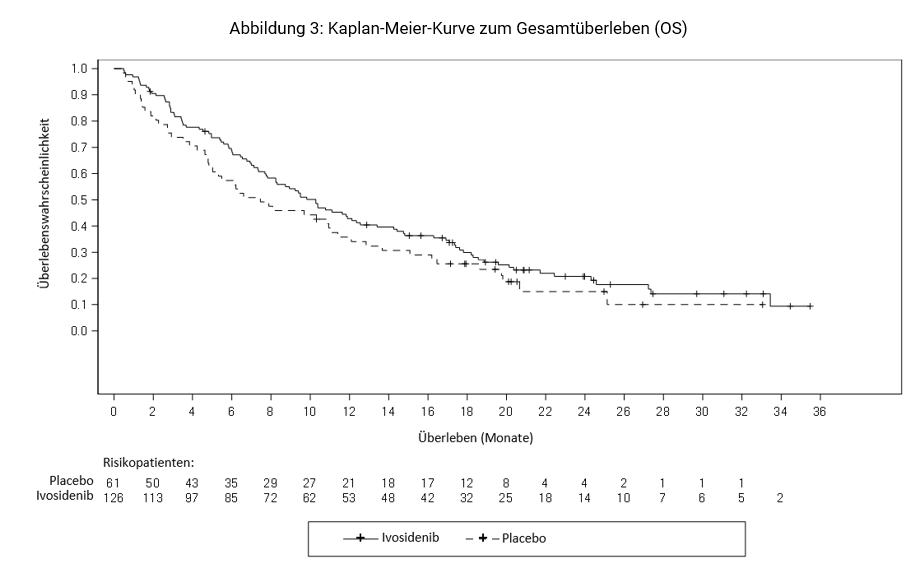
Das Gesamtüberleben (OS) war ein sekundärer Wirksamkeitsendpunkt. Wie nach Protokoll erlaubt, wechselte ein großer Teil (70,5 %) der Patienten im Placebo-Arm zu Tibsovo, nachdem die Krankheit nach Einschätzung des Prüfarztes radiologisch fortgeschritten war.
Die Ergebnisse der Wirksamkeit sind in Tabelle 5 zusammengefasst.
Tabelle 5 - Ergebnisse zur Wirksamkeit bei Patienten mit lokal fortgeschrittenem oder metastasiertem Cholangiokarzinom | |||
Endpunkt | Ivosidenib | Placebo | |
Progressionsfreies Überleben (PFS) nach IRC-Bewertung | N=124 | N=61 | |
Ereignisse, n (%) | 76 (61) | 50 (82) | |
Krankheitsprogression | 64 (52) | 44 (72) | |
Medianes PFS, Monate (95 % CI) | 2,7 (1,6; 4,2) | 1,4 (1,4; 1,6) | |
Hazard Ratio (95 % CI)1 | 0.37 (0.25, 0.54) | ||
PFS-Rate (%)3 | |||
6 Monate | 32,0 | NE | |
Ivosidenib | Placebo | ||
Gesamtüberleben4 | N=126 | N=61 | |
Todesfälle, n (%) | 100 (79) | 50 (82) | |
Medianes OS (Monate, 95 % CI) | 10,3 (7,8; 12,4) | 7,5 (4,8; 11,1) | |
Hazard Ratio (95 % CI)1 | 0,79 (0,56, 1,12) | ||
IRC: Unabhängiges Radiologiezentrum (Independent Radiology Center); CI: Konfidenzintervall; NE = nicht schätzbar. | |||
1 | Die Hazard Ratio wird anhand eines stratifizierten Cox-Regressionsmodells berechnet. Der Stratifikationsfaktor ist die Anzahl der vorherigen Therapielinien zum Zeitpunkt der Randomisierung. | ||
2 | Der p-Wert wird anhand des einseitigen stratifizierten Log-Rank-Tests berechnet, ohne Anpassung für das Crossover. Der Stratifizierungsfaktor ist die Anzahl der vorherigen Therapielinien zum Zeitpunkt der Randomisierung. | ||
3 | Basierend auf einer Kaplan-Meier-Schätzung. Keiner der Patienten, die auf Placebo randomisiert waren, erreichte ein PFS von 6 Monaten oder länger. | ||
4 | Die OS-Ergebnisse basieren auf der abschließenden OS-Analyse (basierend auf 150 Todesfällen; Datenschnitt: 30. Mai 2020), die 16 Monate nach der abschließenden PFS-Analyse (Datenschnitt: 31. Januar 2019) erfolgte. | ||
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Tibsovo in der Behandlung aller Erkrankungen, die in die Kategorie der malignen Neoplasien fallen (mit Ausnahme von Tumoren des Zentralnervensystems sowie von Neoplasien des hämatopoetischen und lymphatischen Gewebes) und zur Behandlung von malignen Neoplasien des Zentralnervensystems, eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen gewährt.
Die Europäische Arzneimittel-Agentur hat für Tibsovo in der Behandlung der akuten myeloischen Leukämie eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren Untergruppen der pädiatrischen Altersklassen gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Insgesamt 10 klinische Studien haben zur Charakterisierung der klinischen Pharmakologie von Ivosidenib beigetragen. Fünf Studien wurden an gesunden Probanden und drei Studien an Patienten mit fortgeschrittenen bösartigen Erkrankungen durchgeführt, darunter zwei Studien an Patienten mit Cholangiokarzinom. Zwei Studien wurden an Patienten mit neu diagnostizierter AML durchgeführt, die Ivosidenib in Kombination mit Azacitidin erhielten. Die pharmakokinetischen Endpunkte wurden in Plasma und Urin untersucht. Die pharmakodynamischen Endpunkte wurden in Plasma, Urin, Tumorbiopsie und Knochenmark (nur in Studien mit Patienten mit fortgeschrittenen bösartigen Erkrankungen) untersucht.
Die Steady-State-Pharmakokinetik von 500 mg Ivosidenib war bei Patienten mit neu diagnostizierter AML und Cholangiokarzinom vergleichbar.
Resorption
Nach oraler Gabe einer Einzeldosis von 500 mg betrug die mediane Zeit bis zur maximalen Plasmakonzentration Cmax (Tmax) bei neu diagnostizierten AML-Patienten, die mit einer Kombination aus Ivosidenib und Azacitidin behandelt wurden, und bei Patienten mit Cholangiokarzinom etwa 2 Stunden.
Bei Patienten mit neu diagnostizierter AML, die mit einer Kombination aus Ivosidenib (500 mg Tagesdosis) und Azacitidin behandelt wurden, lag die mittlere Steady-State-Cmax bei 6 145 ng/ml (CV %: 34) und die mittlere Steady-State-AUC bei 106 326 ng·h/ml (CV %: 41).
Bei Patienten mit Cholangiokarzinom betrug die mittlere Cmax 4 060 ng/ml (% CV: 45) nach einer Einzeldosis von 500 mg und 4 799 ng/ml (CV %: 33) im Steady-State bei 500 mg täglich. Die AUC betrug 86 382 ng·h/ml (CV %: 34).
Bei Patienten mit neu diagnostizierter AML, die mit einer Kombination aus Ivosidenib und Azacitidin behandelt wurden, betrug das Akkumulationsverhältnis etwa 1,6 für die AUC und 1,2 für Cmax und bei Patienten mit Cholangiokarzinom etwa 1,5 für die AUC und 1,2 für Cmax, über einen Monat, wenn Ivosidenib in einer Dosierung von 500 mg täglich gegeben wurde. Steady-State-Plasmaspiegel wurden innerhalb von 14 Tagen nach einmal täglicher Gabe erreicht.
Nach Gabe einer Einzeldosis mit einer fettreichen Mahlzeit (ca. 900 bis 1 000 Kalorien, 56 % bis 60 % Fett) wurden bei gesunden Probanden signifikante Anstiege der Ivosidenib Cmax (um ca. 98 %; 90 % CI: 79; 119) und AUCinf (um ca. 25 %) beobachtet (siehe Abschnitt 4.2).
Verteilung
Basierend auf einer populationspharmakokinetischen Analyse beträgt das mittlere scheinbare Verteilungsvolumen von Ivosidenib im Steady-State (Vc/F) 3,20 l/kg (CV %: 47,8) bei Patienten mit neu diagnostizierter AML, die mit einer Kombination aus Ivosidenib und Azacitidin behandelt wurden, und 2,97 l/kg (CV %: 25,9) bei Patienten mit Cholangiokarzinom, die mit einer Ivosidenib-Monotherapie behandelt wurden.
Biotransformation
Ivosidenib war die vorherrschende Komponente (> 92 %) der Gesamtradioaktivität im Plasma von gesunden Probanden. Ivosidenib wird in erster Linie über oxidative Wege, größtenteils durch CYP3A4 vermittelt, verstoffwechselt. In geringem Maße finden auch N-Dealkylierungen und hydrolytische Verstoffwechslungen statt.
Ivosidenib induziert CYP3A4 (einschließlich seines eigenen Metabolismus), CYP2B6, CYP2C8, CYP2C9 und kann CYP2C19 und UGTs induzieren. Daher kann es die systemische Exposition gegenüber Substraten dieser Enzyme verringern (siehe Abschnitte 4.4, 4.5 und 4.6).
Ivosidenib hemmt P-gp in-vitro und hat das Potenzial, P-gp zu induzieren. Daher kann es die systemische Exposition gegenüber Wirkstoffen, die überwiegend durch P-gp transportiert werden, verändern (siehe Abschnitte 4.3 und 4.5).
In-vitro-Daten deuten darauf hin, dass Ivosidenib in klinisch relevanten Konzentrationen das Potenzial hat, OAT3, OATP1B1 und OATP1B3 zu hemmen und dass es daher die systemische Exposition gegenüber OAT3-, OATP1B1- oder OATP1B3-Substraten erhöhen kann (siehe Abschnitt 4.5).
Elimination
Bei Patienten mit neu diagnostizierter AML, die mit einer Kombination aus Ivosidenib und Azacitidin behandelt wurden, betrug die mittlere scheinbare Clearance von Ivosidenib im Steady-State 4,6 l/Stunde (35 %) mit einer mittleren terminalen Halbwertszeit von 98 Stunden (42 %).
Bei Patienten mit Cholangiokarzinom betrug die mittlere scheinbare Clearance von Ivosidenib im Steady-State 6,1 l/Stunde (31 %) mit einer mittleren terminalen Halbwertszeit von 129 Stunden (102 %).
Bei gesunden Probanden wurden 77 % einer oralen Einzeldosis von Ivosidenib in den Faeces nachgewiesen, wobei 67 % in unveränderter Form vorlagen. Ungefähr 17 % einer oralen Einzeldosis wurden im Urin nachgewiesen, wobei 10 % unverändert vorlagen.
Linearität/Nichtlinearität
Die AUC und Cmax von Ivosidenib stiegen dosisunterproportional von 200 mg auf 1 200 mg einmal täglich an (0,4- bis 2,4‑fache der empfohlenen Dosis).
Spezielle Patientengruppen
Ältere Patienten
Bei älteren Patienten bis zu 84 Jahren wurden keine klinisch bedeutsamen Auswirkungen auf die Pharmakokinetik von Ivosidenib beobachtet. Die Pharmakokinetik von Ivosidenib bei Patienten im Alter von 85 Jahren oder älter ist nicht bekannt (siehe Abschnitt 4.2).
Nierenfunktionsstörung
Bei Patienten mit leichter oder mäßiger Nierenfunktionsstörung (eGFR ≥ 30 ml/min/1,73 m2) wurden keine klinisch bedeutsamen Auswirkungen auf die Pharmakokinetik von Ivosidenib beobachtet. Die Pharmakokinetik von Ivosidenib bei Patienten mit schwerer Nierenfunktionsstörung (eGFR < 30 ml/min/1,73 m2) oder dialysepflichtiger Nierenfunktionsstörung ist nicht bekannt (siehe Abschnitt 4.2).
Leberfunktionsstörung
Unter Verwendung der NCI-Klassifikation wurden bei Patienten mit leichter Leberfunktionsstörung keine klinisch bedeutsamen Auswirkungen auf die Pharmakokinetik von Ivosidenib beobachtet. Die Pharmakokinetik von Ivosidenib bei Patienten mit mäßiger bzw. schwerer Leberfunktionsstörung ist bei Patienten mit neu diagnostizierter AML und mit Cholangiokarzinom nicht bekannt (siehe Abschnitt 4.2). Es liegen keine PK-Daten bei Patienten mit Leberfunktionsstörungen vor, die nach der Child-Pugh-Klassifikation stratifiziert sind.
Andere
Es wurden keine klinisch bedeutsamen Auswirkungen auf die Pharmakokinetik von Ivosidenib in Abhängigkeit von Geschlecht, Rasse, Körpergewicht oder ECOG-Performance-Status beobachtet.
Sicherheitspharmakologie
Das Potenzial von Ivosidenib für eine QT-Verlängerung wurde in präklinischen in-vitro- und in-vivo-Studien bei klinisch relevanten Plasmaspiegeln nachgewiesen.
Toxizität bei wiederholter Verabreichung
In Tierstudien mit klinisch relevanten Expositionen führte Ivosidenib zu hämatologischen Anomalien (Hypozellularität des Knochenmarks, Lymphoiddepletion, verringerte Erythrozytenmasse zusammen mit extramedullärer Hämatopoese in der Milz), gastrointestinaler Toxizität, Auffälligkeiten an der Schilddrüse (Follikelzellhypertrophie/Hyperplasie bei Ratten), Lebertoxizität (erhöhte Transaminasen, Gewichtszunahmen, hepatozelluläre Hypertrophie und Nekrose bei Ratten und hepatozelluläre Hypertrophie in Verbindung mit erhöhtem Lebergewicht bei Affen) sowie Nierenbefunden (tubuläre Vakuolisierung und Nekrose bei Ratten).
Die beobachteten toxischen Wirkungen auf das hämatologische System, das gastrointestinale System und die Nieren waren reversibel, während die toxischen Wirkungen auf Leber, Milz und Schilddrüse auch am Ende der Erholungsphase noch zu beobachten waren.
Genotoxizität und Karzinogenität
Ivosidenib war in herkömmlichen in-vitro- und in-vivo-Genotoxizitätstests weder mutagen noch klastogen. Karzinogenitätsstudien wurden mit Ivosidenib nicht durchgeführt.
Reproduktions- und Entwicklungstoxizität
Mit Ivosidenib wurden keine Fertilitätsstudien durchgeführt. In der 28-tägigen Studie an Ratten zur Toxizität bei wiederholter Verabreichung wurde bei weiblichen Tieren bei nicht verträglichen Dosen, die etwa dem 1,7‑fachen der klinischen Exposition entsprachen (basierend auf der AUC), eine Uterusatrophie beobachtet, die nach einer 14-tägigen Erholungsphase reversibel war. Bei männlichen Tieren, die vorzeitig eingeschläfert wurden, wurde eine Hodendegeneration bei nicht verträglichen Dosen beobachtet, die etwa dem 1,2‑fachen der klinischen Exposition entsprachen (basierend auf der AUC).
In Studien zur embryo-fetalen Entwicklung bei Ratten traten bei fehlender maternaler Toxizität ein geringeres fetales Körpergewicht und eine verzögerte Skelettverknöcherung auf. Bei Kaninchen wurden maternale Toxizität, spontane Fehlgeburten, vermindertes fetales Körpergewicht, erhöhte Abortrate nach der Implantation, verzögerte Skelettverknöcherung und Abweichungen in der viszeralen Entwicklung (kleine Milz) beobachtet. Tierstudien deuten darauf hin, dass Ivosidenib die Plazenta passiert und im fötalen Plasma gefunden wird. Bei Ratten und Kaninchen betrugen die Werte ohne schädliche Wirkung für die embryo-fetale Entwicklung das 0,4‑fache bzw. 1,4‑fache der klinischen Exposition (basierend auf der AUC).
Tablettenkern
Mikrokristalline Cellulose
Croscarmellose-Natrium
Hypromelloseacetatsuccinat
Hochdisperses Siliciumdioxid
Magnesiumstearat
Natriumdodecylsulfat (E487)
Filmüberzug
Hypromellose
Titandioxid (E171)
Lactose-Monohydrat
Triacetin
Indigocarmin-Aluminiumsalz (E132)
Nicht zutreffend.
5 Jahre.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Die Flasche fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
Flasche aus High-Density-Polyethylen (HDPE) mit kindergesichertem Verschluss aus Polypropylen (PP) und einer mit Polyethylen (PE) beschichteten Induktions-Heißsiegelfolie. Jede Flasche enthält 60 Filmtabletten und ein Silikagel-Trockenmittel in einem HDPE-Behälter.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Frankreich
EU/1/23/1728/001
Datum der Erteilung der Zulassung: 04. Mai 2023
Dezember 2023
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
60 Filmtabletten
Servier Deutschland GmbH
Elsenheimerstr. 53
D-80687 München
Tel: +49 (0)89 57095-01
Fax: +49 (0)89 57095-126
E-mail: info-de@servier.com