▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
Abrysvo® Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Respiratorischer Synzytial-Virus (RSV)-Impfstoff (bivalent, rekombinant)
Nach der Rekonstitution enthält eine Dosis (0,5 ml):
Stabilisiertes Präfusions-F-Antigen der RSV-Untergruppe A1,2 60 Mikrogramm
Stabilisiertes Präfusions-F-Antigen der RSV-Untergruppe B1,2 60 Mikrogramm
(RSV-Antigene)
1 in der Präfusionskonformation stabilisiertes Glykoprotein F
2 hergestellt in Ovarialzellen des Chinesischen Hamsters mittels rekombinanter DNA-Technologie.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Das Pulver ist weiß.
Das Lösungsmittel ist eine klare, farblose Flüssigkeit.
Abrysvo wird angewendet:
Immunisierung Schwangerer zum passiven Schutz des Säuglings (ab Geburt bis zu einem Alter von 6 Monaten) vor Erkrankungen der unteren Atemwege, die durch das Respiratorische Synzytial-Virus (RSV) verursacht werden. Siehe Abschnitte 4.2 und 5.1.
Zur aktiven Immunisierung von Personen ab einem Alter von 18 Jahren zur Prävention von durch RSV verursachten Erkrankungen der unteren Atemwege.
Die Anwendung dieses Impfstoffs sollte gemäß offiziellen Empfehlungen erfolgen.
Dosierung
Schwangere Personen
Eine Einzeldosis von 0,5 ml wird zwischen den Schwangerschaftswochen 24 und 36 verabreicht (siehe Abschnitte 4.4 und 5.1).
Personen ab einem Alter von 18 Jahren
Es wird eine Einzeldosis zu 0,5 ml verabreicht.
Die Notwendigkeit einer erneuten Impfung wurde bislang nicht nachgewiesen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Abrysvo bei Kindern (von der Geburt bis zum Alter von unter 18 Jahren) sind bisher nicht erwiesen. Es liegen begrenzte Daten zu schwangeren Jugendlichen und deren Säuglingen vor (siehe Abschnitt 5.1).
Art der Anwendung
Abrysvo ist für die intramuskuläre Injektion in den Deltamuskel des Oberarms bestimmt.
Der Impfstoff darf nicht mit anderen Impfstoffen oder Arzneimitteln gemischt werden.
Hinweise zur Rekonstitution und Handhabung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Überempfindlichkeit und Anaphylaxie
Für den Fall einer anaphylaktischen Reaktion nach Verabreichung des Impfstoffs sollten immer eine entsprechende medizinische Versorgung und Überwachung bereitstehen.
Angstbedingte Reaktionen
Angstbedingte Reaktionen, einschließlich vasovagale Reaktionen (Synkope), Hyperventilation oder stressbedingte Reaktionen können im Zusammenhang mit der Impfung als psychogene Reaktion auf die Injektion mit einer Nadel auftreten. Es ist wichtig, dass Vorkehrungen getroffen werden, um Verletzungen durch eine Ohnmacht zu vermeiden.
Gleichzeitige Erkrankung
Die Impfung sollte bei Personen mit einer akuten fieberhaften Erkrankung verschoben werden. Das Vorliegen einer leichten Infektion, wie z. B. einer Erkältung, sollte jedoch nicht zum Aufschieben der Impfung führen.
Thrombozytopenie und Gerinnungsstörungen
Abrysvo ist bei Personen mit Thrombozytopenie oder einer Gerinnungsstörung mit Vorsicht zu verabreichen, da bei diesen Personen nach intramuskulärer Injektion Blutungen oder Blutergüsse auftreten können.
Immungeschwächte Personen
Die Wirksamkeit und Sicherheit des Impfstoffs wurden bei immungeschwächten Personen, einschließlich Personen unter Therapie mit Immunsuppressiva, nicht untersucht. Die Wirksamkeit von Abrysvo könnte bei immungeschwächten Personen geringer sein.
Personen unterhalb von 24 Schwangerschaftswochen
Abrysvo wurde bei schwangeren Personen unterhalb von 24 Schwangerschaftswochen nicht untersucht. Da der Schutz des Säuglings gegen RSV von der Übertragung mütterlicher Antikörper über die Plazenta abhängt, sollte Abrysvo zwischen den Schwangerschaftswochen 24 und 36 verabreicht werden (siehe Abschnitte 4.2 und 5.1).
Limitierungen der Impfstoffeffektivität
Wie bei jedem Impfstoff wird möglicherweise nicht bei allen Geimpften eine schützende Immunantwort erzielt.
Sonstige Bestandteile
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Dosis, d. h. es ist nahezu „natriumfrei“.
Abrysvo enthält Polysorbat 80. Polysorbat 80 kann Überempfindlichkeitsreaktionen hervorrufen.
Abrysvo kann gleichzeitig verabreicht werden mit:
saisonalen Grippeimpfstoffen, entweder standarddosierten Grippeimpfstoffen (adjuvantiert) oder Hochdosis-Grippeimpfstoffen (nicht adjuvantiert)
COVID-19-mRNA-Impfstoffen mit oder ohne einen gleichzeitig verabreichten Hochdosis-Grippeimpfstoff (nicht adjuvantiert).
Zwischen der Verabreichung von Abrysvo und einem Tetanus-Diphtherie-azellulärem Pertussis-Impfstoff (Tdap) wird ein Abstand von mindestens zwei Wochen empfohlen. Es gab keine Sicherheitsbedenken bei gesunden, nicht schwangeren Frauen, denen Abrysvo gleichzeitig mit Tdap verabreicht wurde. Bei gleichzeitiger Verabreichung waren die Immunantworten auf RSV-A, RSV-B, Diphtherie und Tetanus denen bei getrennter Verabreichung nicht unterlegen. Die Antworten auf die Pertussis-Komponenten waren bei gleichzeitiger Verabreichung allerdings niedriger als bei getrennter Verabreichung und erfüllten die Kriterien für die Nicht-Unterlegenheit nicht. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Schwangerschaft
Daten bei schwangeren Frauen (mehr als 4 000 Schwangerschaftsergebnisse nach Exposition) deuten nicht auf ein Fehlbildungsrisiko oder eine fetale/neonatale Toxizität hin.
Ergebnisse tierexperimenteller Studien mit Abrysvo ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3).
Die in einer Phase-3-Studie (Studie 1) bei Müttern innerhalb von 1 Monat nach der Impfung beobachteten unerwünschten Ereignisse waren in der Abrysvo-Gruppe (14 %) mit denen in der Placebo-Gruppe (13 %) vergleichbar.
Es wurden keine Sicherheitssignale bei bis zu 24 Monate alten Säuglingen festgestellt. Die bei Säuglingen innerhalb von 1 Monat nach der Geburt aufgetretenen unerwünschten Ereignisse waren in der Abrysvo-Gruppe (38 %) mit denen in der Placebo-Gruppe (35 %) vergleichbar. Die wichtigsten in der Abrysvo-Gruppe im Vergleich zu Placebo bewerteten Geburtsereignisse umfassten Frühgeburt (207 [6 %] bzw. 172 [5 %]), niedriges Geburtsgewicht (186 [5 %] bzw. 158 [4 %]) und kongenitale Anomalien (205 [6 %] bzw. 245 [7 %]).
Stillzeit
Es ist nicht bekannt, ob Abrysvo in die Muttermilch übergeht. Abrysvo zeigte keine schädlichen Auswirkungen auf gestillte Neugeborene von geimpften Müttern.
Fertilität
Es liegen keine Daten über die Auswirkung von Abrysvo auf die Fertilität beim Menschen vor.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die weibliche Fertilität (siehe Abschnitt 5.3).
Abrysvo hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Schwangere Personen
Die am häufigsten gemeldeten Nebenwirkungen bei schwangeren Frauen zwischen 24 und 36 Schwangerschaftswochen waren Schmerzen an der Injektionsstelle (41 %), Kopfschmerzen (31 %) und Myalgie (27 %). Die Mehrzahl der lokalen und systemischen Reaktionen bei den teilnehmenden Müttern waren leicht bis mittelschwer und klangen innerhalb von 2 bis 3 Tagen nach dem Auftreten ab.
Personen ab einem Alter von 18 Jahren
Bei Personen ab einem Alter von 18 Jahren waren die am häufigsten gemeldeten Nebenwirkungen Ermüdung (23 %), Kopfschmerzen (20 %), Schmerzen an der Injektionsstelle (19 %) und Myalgie (16 %). Die meisten Nebenwirkungen waren leicht bis mittelschwer und klangen innerhalb von 1 bis 2 Tagen nach dem Auftreten ab.
Tabellarische Auflistung der Nebenwirkungen
Die Sicherheit der Verabreichung einer Einzeldosis Abrysvo an schwangere Frauen zwischen 24 und 36 Schwangerschaftswochen (n = 3 698) und an Personen ab einem Alter von 18 Jahren (n = 20 275) wurde in klinischen Studien untersucht.
Die Nebenwirkungen sind nach den folgenden Häufigkeitskategorien aufgeführt:
Sehr häufig (≥ 1/10)
Häufig (≥ 1/100, < 1/10)
Gelegentlich (≥ 1/1 000, < 1/100)
Selten (≥ 1/10 000, < 1/1 000)
Sehr selten (< 1/10 000)
Nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die Nebenwirkungen sind nach Systemorganklasse in abnehmender Reihenfolge ihres Schweregrads angegeben.
Tabelle 1 Nebenwirkungen nach Verabreichung von Abrysvo
Systemorganklasse | Nebenwirkungen | Nebenwirkungen | |
Erkrankungen des Blutes und des Lymphsystems | |||
Lymphadenopathie | Selten | Selten | |
Erkrankungen des Immunsystems | |||
Anaphylaxie | Sehr selten | ||
Überempfindlichkeitsreaktionen | Selten | Selten | |
Erkrankungen des Nervensystems | |||
Kopfschmerzen | Sehr häufig | Sehr häufig | |
Guillain-Barré-Syndrom | Sehr selten | ||
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |||
Myalgie | Sehr häufig | Sehr häufig | |
Arthralgie | Häufig | ||
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |||
Ermüdung | Sehr häufig | ||
Schmerzen an der Injektionsstelle | Sehr häufig | Sehr häufig | |
Rötung an der Injektionsstelle | Häufig | Häufig | |
Schwellung an der Injektionsstelle | Häufig | Häufig | |
Fieber | Gelegentlich | ||
Pruritus an der Injektionsstelle | Selten | ||
Quetschung an der Injektionsstelle | Selten | ||
Hämatom an der Injektionsstelle | Selten | ||
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen.
Deutschland
Bundesinstitut für Impfstoffe und
biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Traisengasse 5
1200 WIEN
ÖSTERREICH
Fax: +43 (0) 50 555 36207
Website: https://www.basg.gv.at/
Aufgrund der Verabreichung als Einzeldosis ist eine Überdosierung mit Abrysvo unwahrscheinlich.
Eine bestimmte Behandlung für eine Überdosierung mit Abrysvo ist nicht verfügbar. Im Falle einer Überdosierung sollte die Person überwacht und gegebenenfalls eine symptomatische Behandlung eingeleitet werden.
Pharmakotherapeutische Gruppe: Impfstoffe, andere virale Impfstoffe, ATC-Code: J07BX05
Wirkmechanismus
Abrysvo enthält zwei rekombinante stabilisierte RSV-Präfusions-F-Antigene der RSV‑Untergruppen A und B. Das Präfusions-F-Antigen ist das primäre Ziel für neutralisierende Antikörper, die eine RSV-Infektion verhindern. Nach intramuskulärer Verabreichung lösen die Präfusions-F-Antigene eine Immunantwort aus, die vor RSV‑assoziierten Erkrankungen der unteren Atemwege (lower respiratory tract disease, LRTD) schützt.
Bei Säuglingen von Müttern, die zwischen 24 und 36 Schwangerschaftswochen mit Abrysvo geimpft wurden, ist der Schutz vor RSV-assoziierten LRTD auf die Übertragung von RSV-neutralisierenden Antikörpern über die Plazenta zurückzuführen. Erwachsene ab einem Alter von 18 Jahren werden durch aktive Immunisierung geschützt.
Klinische Wirksamkeit
Säuglinge ab der Geburt bis zu einem Alter von 6 Monaten durch aktive Immunisierung schwangerer Personen
Bei Studie 1 handelte es sich um eine multizentrische, randomisierte (1:1), doppelblinde, placebokontrollierte Phase‑3-Studie zur Beurteilung der Wirksamkeit einer Einzeldosis Abrysvo zur Prävention RSV‑assoziierter LRTD bei Säuglingen, deren Mütter zwischen 24 und 36 Schwangerschaftswochen geimpft worden waren. Die Notwendigkeit einer erneuten Impfung bei nachfolgenden Schwangerschaften wurde nicht nachgewiesen.
Eine RSV-assoziierte LRTD wurde definiert als Arztbesuch von Personen mit einer mittels Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) bestätigten RSV-Infektion, die eines oder mehrere der folgenden Atemwegssymptome aufweisen: schnelle Atmung, niedrige Sauerstoffsättigung (SpO2 < 95 %) und Einziehen des Brustkorbs beim Atmen. Eine schwere RSV-assoziierte LRTD wurde als eine RSV-assoziierte LRTD definiert, welche zusätzlich mindestens eines der folgenden Kriterien erfüllt: sehr schnelle Atmung, niedrige Sauerstoffsättigung (SpO2 < 93 %), High-flow-Sauerstoff-Supplementierung mittels Nasenbrille oder maschineller Beatmung, Behandlung auf der Intensivstation für > 4 Stunden und/oder fehlende Ansprechbarkeit/Bewusstlosigkeit.
In dieser Studie wurden 3 711 Schwangere mit unkomplizierten Einlingsschwangerschaften in die Abrysvo- und 3 709 in die Placebo-Gruppe randomisiert.
Die Impfstoffwirksamkeit (IW) wurde definiert als die relative Risikoreduktion für den Endpunkt in der Abrysvo-Gruppe im Vergleich zur Placebo-Gruppe bei Säuglingen, deren Mütter die zugewiesene Intervention erhalten hatten. Im Rahmen der primären Analyse wurden zwei primäre Wirksamkeitsendpunkte parallel bewertet: schwere ärztlich behandelte LRTD mit RSV‑Nachweis und ärztlich behandelte LRTD mit RSV‑Nachweis innerhalb von 90, 120, 150 oder 180 Tagen nach der Geburt.
Von den schwangeren Frauen, die Abrysvo erhielten, waren 65 % weiß, 20 % schwarz oder afroamerikanisch und 29 % hispanisch/lateinamerikanisch. Das mediane Alter lag bei 29 Jahren (Spanne: 16–45 Jahre), 0,2 % der Teilnehmenden waren unter 18 Jahre alt und 4,3 % unter 20 Jahre alt. Das mediane Schwangerschaftsalter bei der Impfung betrug 31 Wochen und 2 Tage (Spanne: 24 Wochen und 0 Tage bis 36 Wochen und 4 Tage). Das mediane Schwangerschaftsalter der Säuglinge bei der Geburt lag bei 39 Wochen und 1 Tag (Spanne: 27 Wochen und 3 Tage bis 43 Wochen und 6 Tage).
Die Impfstoffwirksamkeit ist in den Tabellen 2 und 3 dargestellt.
Tabelle 2 Impfstoffwirksamkeit von Abrysvo gegen schwere durch RSV verursachte, ärztlich behandelte LRTD bei Säuglingen ab der Geburt bis zu einem Alter von 6 Monaten durch aktive Immunisierung der Mutter während der Schwangerschaft – Studie 1
Zeitraum | Abrysvo | Placebo | % IW |
90 Tage | 6 | 33 | 81,8 (40,6; 96,3) |
120 Tage | 12 | 46 | 73,9 (45,6; 88,8) |
150 Tage | 16 | 55 | 70,9 (44,5; 85,9) |
180 Tage | 19 | 62 | 69,4 (44,3; 84,1) |
KI = Konfidenzintervall; IW = Impfstoffwirksamkeit
a 99,5 %-KI nach 90 Tagen; 97,58 %-KI zu späteren Zeitpunkten
Tabelle 3 Impfstoffwirksamkeit von Abrysvo gegen durch RSV verursachte, ärztlich behandelte LRTD bei Säuglingen ab der Geburt bis zu einem Alter von 6 Monaten durch aktive Immunisierung der Mutter während der Schwangerschaft – Studie 1
Zeitraum | Abrysvo | Placebo | % IW |
90 Tage | 24 | 56 | 57,1 (14,7; 79,8) |
120 Tage | 35 | 81 | 56,8 (31,2; 73,5) |
150 Tage | 47 | 99 | 52,5 (28,7; 68,9) |
180 Tage | 57 | 117 | 51,3 (29,4; 66,8) |
KI = Konfidenzintervall; IW = Impfstoffwirksamkeit
a 99,5 %-KI nach 90 Tagen; 97,58 %-KI zu späteren Zeitpunkten
Es wurde eine Post-hoc-Analyse der Impfstoffwirksamkeit nach mütterlichem Gestationsalter durchgeführt. Die Impfstoffwirksamkeit gegen schwere, ärztlich behandelte LRTD innerhalb von 180 Tagen betrug bei Frauen, die früh in der Schwangerschaft (24 bis < 30 Wochen) geimpft wurden, 57,2 % (95 %-KI: 10,4; 80,9) und 78,1 % (95 %-KI: 52,1; 91,2) bei Frauen, die zu einem späteren möglichen Zeitpunkt während der Schwangerschaft (30 bis 36 Wochen) geimpft wurden. Die Impfstoffwirksamkeit gegen ärztlich behandelte LRTD innerhalb von 180 Tagen betrug bei Frauen, die früh in der Schwangerschaft (24 bis < 30 Wochen) geimpft wurden, 30,9 % (95 %-KI: -14,4; 58,9) und 62,4 % (95 %-KI: 41,6; 76,4) bei Frauen, die zu einem späteren möglichen Zeitpunkt während der Schwangerschaft (30 bis 36 Wochen) geimpft wurden.
Aktive Immunisierung von Personen ab einem Alter von 60 Jahren
Bei Studie 2 handelte es sich um eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-3-Studie zur Beurteilung der Wirksamkeit von Abrysvo zur Prävention RSV‑assoziierter LRTD bei Personen ab einem Alter von 60 Jahren.
Eine RSV-assoziierte LRTD wurde definiert als mittels RT‑PCR bestätigte RSV-Erkrankung mit mindestens 2 oder mindestens 3 der folgenden Atemwegssymptome innerhalb von 7 Tagen ab Symptombeginn und einer Dauer von mehr als 1 Tag während derselben Erkrankung: neu auftretender oder sich verschlimmernder Husten, Giemen, Sputumproduktion, Kurzatmigkeit oder Tachypnoe (≥ 25 Atemzüge/Minute oder 15 % schnellere Atmung im Vergleich zum Ausgangswert in Ruhe).
Die Teilnehmenden wurden auf Abrysvo (n = 18 487) oder Placebo (n = 18 479) randomisiert (1:1). Die Aufnahme in die Studie erfolgte stratifiziert nach Alter: 60–69 Jahre (63 %), 70–79 Jahre (32 %) und ≥ 80 Jahre (5 %). Personen mit stabilen chronischen Grunderkrankungen durften in die Studie aufgenommen werden, und 52 % der Teilnehmenden hatten mindestens 1 zuvor definierte Erkrankung; 16 % der Teilnehmenden wurden mit stabilen chronischen kardiopulmonalen Erkrankungen wie Asthma (9 %), chronisch obstruktiver Lungenerkrankung (7 %) oder kongestiver Herzinsuffizienz (2 %) in die Studie aufgenommen. Personen mit einer Immunschwäche waren von der Teilnahme ausgeschlossen.
Das primäre Ziel war die Beurteilung der Impfstoffwirksamkeit (IW), definiert als die relative Risikoreduktion für eine erste Episode einer RSV-assoziierten LRTD in der Abrysvo-Gruppe im Vergleich zur Placebo-Gruppe in der ersten RSV-Saison.
Von den Teilnehmenden, die Abrysvo erhielten, waren 51 % männlich und 80 % waren weiß, 12 % schwarz oder afroamerikanisch und 42 % hispanisch/lateinamerikanisch. Das mediane Alter der Teilnehmenden betrug 67 Jahre (Spanne: 59–95 Jahre).
Am Ende der ersten RSV-Saison zeigte die Auswertung der Ergebnisse eine statistisch signifikante Wirksamkeit von Abrysvo bei der Verringerung von RSV-assoziierten LRTD mit ≥ 2 Symptomen und ≥ 3 Symptomen.
Angaben zur Impfstoffwirksamkeit am Ende der ersten RSV-Saison (mediane Nachbeobachtungszeit 7,4 Monate) finden sich in Tabelle 4.
Tabelle 4 Impfstoffwirksamkeit von Abrysvo gegen RSV-Erkrankungen – aktive Immunisierung von Personen ab einem Alter von 60 Jahren – Studie 2
Wirksamkeitsendpunkt | Abrysvo | Placebo | % IW | |||
N | n | N | n | |||
Erste Episode einer RSV-assoziierten LRTD mit ≥ 2 Symptomena | Insgesamt | 18 058 | 15 | 18 076 | 43 | 65,1 (35,9; 82,0) |
Alter 60-69 Jahre | 11 305 | 10 | 11 351 | 25 | 60,0 (13,8; 82,9) | |
Alter 70-79 Jahre | 5 750 | 4 | 5 742 | 12 | 66,7 (-10,0; 92,2) | |
Mit ≥ 1 relevanten Grunderkrankung | 9 377 | 8 | 9 432 | 22 | 63,6 (15,2; 86,0) | |
Erste Episode einer RSV-assoziierten LRTD mit ≥ 3 Symptomenb | Insgesamt | 18 058 | 2 | 18 076 | 18 | 88,9 (53,6; 98,7) |
Alter 60-69 Jahre | 11 305 | 2 | 11 351 | 11 | 81,8 (16,7; 98,0) | |
Alter 70-79 Jahre | 5 750 | 0 | 5 742 | 4 | 100 (-51,5; 100,0) | |
Mit ≥ 1 relevanten Grunderkrankung | 9 377 | 2 | 9 432 | 11 | 81,8 (16,7; 98,0) | |
KI = Konfidenzintervall, RSV = Respiratorisches Synzytial-Virus, IW = Impfstoffwirksamkeit
N = Anzahl der Teilnehmer, n = Anzahl der Fälle
a In einer explorativen Analyse für die RSV-Untergruppe A (Abrysvo n = 3, Placebo n = 16) betrug die IW 81,3 % (KI 34,5; 96,5) und für die RSV-Untergruppe B (Abrysvo n = 12, Placebo n = 26) betrug die IW 53,8 % (KI 5,2; 78,8).
b In einer explorativen Analyse für die RSV-Untergruppe A (Abrysvo n = 1, Placebo n = 5) betrug die IW 80,0 % (KI -78,7; 99,6) und für die RSV-Untergruppe B (Abrysvo n = 1, Placebo n = 12) betrug die IW 91,7 % (KI 43,7; 99,8).
Die Impfstoffwirksamkeit in der Untergruppe der Teilnehmer im Alter von 80 Jahren und älter (995 bzw. 981 Teilnehmer in den Abrysvo- und Placebogruppen) kann aufgrund der niedrigen Gesamtzahl der aufgetretenen Fälle nicht abschließend bestimmt werden (7 Fälle von RSV-assoziierter LRTD mit ≥ 2 Symptomen und 3 Fälle von RSV-assoziierter LRTD mit ≥ 3 Symptomen).
Wirksamkeit gegen RSV-assoziierte Erkrankungen der unteren Atemwege über 2 RSV-Saisons hinweg bei Personen im Alter von 60 Jahren und älter
Über zwei RSV-Saisons mit einer medianen Nachbeobachtungszeit von 16,4 Monaten hinweg betrug die IW gegen RSV-assoziierte LRTD mit ≥ 2 Symptomen 58,8 % (95 %-KI 43,0; 70,6; 54 Fälle in der Abrysvo-Gruppe und 131 Fälle in der Placebogruppe) und mit ≥ 3 Symptomen 81,5 % (95%-KI 63,3; 91,6; 10 Fälle in der Abrysvo-Gruppe und 54 Fälle in der Placebogruppe). Die IW gegen RSV-assoziierte LRTD, verursacht durch RSV-A und RSV-B, betrug 66,3 % (95 %-KI 47,2; 79,0) bzw. 50,0 % (95 %-KI 18,5; 70,0) für Fälle mit ≥ 2 LRTD-Symptomen und 80,6 % (95 %-KI 52,9; 93,4) bzw. 86,4 % (95 %-KI 54,6; 97,4) für Fälle mit ≥ 3 LRTD-Symptomen.
Die Untergruppenanalysen zur IW nach Alter und relevanten Grunderkrankungen über zwei RSV-Saisons hinweg stimmen mit der IW am Ende der ersten RSV-Saison überein und unterstützen eine konsistente IW für verschiedene Alters- und Risikogruppen.
Immunogenität bei Personen im Alter von 18 bis 59 Jahren
Bei Studie 3 handelte es sich um eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-3-Studie zur Beurteilung der Sicherheit und Immunogenität von Abrysvo bei Personen im Alter von 18 bis 59 Jahren, bei denen das Risiko für die Entwicklung einer durch RSV verursachten schweren LRTD als hoch eingeschätzt wurde. In Studie 3 wurden Personen mit chronischen Lungenerkrankungen (einschließlich Asthma), kardiovaskulären Erkrankungen (mit Ausnahme von isoliertem Bluthochdruck), Nieren-, Leber-, neurologischen, hämatologischen oder Stoffwechselerkrankungen (einschließlich Diabetes mellitus und Hyper-/Hypothyreose) aufgenommen. Die Teilnehmenden wurden im Verhältnis 2:1 randomisiert und erhielten eine Einzeldosis Abrysvo (n = 437) oder Placebo (n = 217).
Die demografischen Merkmale in Studie 3 waren in Bezug auf Alter, ethnische Herkunft und Zugehörigkeit bei den Teilnehmenden, die Abrysvo erhielten, und denen, die Placebo bekamen, im Allgemeinen ähnlich. Dreiundfünfzig Prozent (53 %) waren 18 bis 49 Jahre alt, und 47 % waren 50 bis 59 Jahre alt. Die Impfstoff- und die Placebogruppe waren in Bezug auf das Vorliegen mindestens einer vordefinierten Erkrankung ähnlich, darunter 53 % mit ≥ 1 chronischen Lungenerkrankung, 8 % mit ≥ 1 kardiovaskulären Erkrankung, 42 % mit Diabetes mellitus und 31 % mit ≥ 1 anderen Erkrankung (Leber-, Nieren-, neurologische, hämatologische oder andere Stoffwechselerkrankung).
Die Impfstoffwirksamkeit bei Personen im Alter von 18 bis 59 Jahren wird mittels Immunobridging zur Studie 2 abgeleitet, in der die Impfstoffwirksamkeit bei Personen im Alter von 60 Jahren und älter nachgewiesen wurde. Die Kriterien für eine Nichtunterlegenheit wurden bei Hochrisikopersonen im Alter von 18 bis 59 Jahren im Vergleich zu einer zufällig ausgewählten Immunogenitätsuntergruppe (externe Kontrollgruppe) mit Personen ab einem Alter von 60 Jahren aus Studie 2 für das Verhältnis der geometrischen mittleren RSV-Neutralisationstiter (GMTs) durch die unteren Grenzen der zweiseitigen 95 %-KI > 0,667 (1,5‑fache Nichtunterlegenheitsgrenze) und für die Differenz der Seroresponse-Raten durch die unteren Grenzen der zweiseitigen 95 %-KI > -10 % sowohl für RSV-A als auch für RSV-B erreicht.
Tabelle 5 Vergleich der modellbereinigten GMTs für RSV-Neutralisationstiter 1 Monat nach der Impfung mit Abrysvo bei Patienten im Alter von 18 bis 59 Jahren mit hohem Risiko (Studie 3) gegenüber Patienten ab einem Alter von 60 Jahren (Studie 2)
Studie 3, 18–59 Jahre mit hohem Risiko | Studie 2, ≥ 60 Jahre | ANCOVA-Vergleich | |||
RSV-Untergruppen | n | Angepasster GMT (95 %-KI) | n | Angepasster GMT (95 %-KI) | Angepasstes GMR (95 %-KI) |
A | 435 | 41 097 | 408 | 26 225 | 1,57 (1,396; 1,759) |
B | 437 | 37 416 | 408 | 24 680 | 1,52 (1,333; 1,725) |
KI = Konfidenzintervall; GMR = Verhältnis der geometrischen Mittelwerte, GMT = geometrischer Mittelwert der Titer
Tabelle 6 Vergleich der Seroresponse-Raten für RSV-Neutralisationstiter 1 Monat nach der Impfung mit Abrysvo bei Patienten im Alter von 18 bis 59 Jahren mit hohem Risiko (Studie 3) gegenüber Patienten ab einem Alter von 60 Jahren (Studie 2)
Studie 3, 18–59 Jahre mit hohem Risiko | Studie 2, ≥60 Jahre | Vergleich | |||
RSV-Untergruppen | n/N (%) | 95 %-KI | n/N (%) | 95 %-KI | Differenz |
A | 405/435 (93) | 90,3; 95,3 | 359/408 (88) | 84,4; 91,0 | 5,1 (1,2; 9,2) |
B | 408/437 (93) | 90,6; 95,5 | 347/408 (85) | 81,2; 88,4 | 8,3 (4,2; 12,6) |
KI = Konfidenzintervall
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Abrysvo eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien bei Kindern und Jugendlichen ab einem Alter von 2 Jahren bis unter 18 Jahren für die Prävention von durch RSV verursachten Erkrankungen der unteren Atemwege gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Nicht zutreffend.
Basierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe und zur Reproduktions- und Entwicklungstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Pulver
Trometamol
Trometamolhydrochlorid
Saccharose
Mannitol (E 421)
Polysorbat 80 (E 433)
Natriumchlorid
Salzsäure (zur pH-Einstellung)
Lösungsmittel
Wasser für Injektionszwecke
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
3 Jahre
Die ungeöffnete Durchstechflasche bleibt bei Lagerung bei Temperaturen zwischen 8 °C und 30 °C 5 Tage lang stabil. Nach Ablauf dieses Zeitraums sollte Abrysvo verwendet oder entsorgt werden. Diese Angabe dient lediglich als Orientierungshilfe für medizinisches Fachpersonal im Falle vorübergehender Temperaturabweichungen.
Nach der Rekonstitution:
Abrysvo sollte nach der Rekonstitution umgehend oder bei Lagerung zwischen 15 °C und 30 °C innerhalb von 4 Stunden verabreicht werden. Nicht einfrieren.
Die chemische und physikalische Stabilität während des Gebrauchs wurde 4 Stunden lang bei 15 °C bis 30 °C nachgewiesen. Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Bei nicht sofortiger Verwendung liegen die Dauer und die Bedingungen der Aufbewahrung vor der Anwendung in der Verantwortung des Anwenders.
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren. Entsorgen, wenn die Packung eingefroren war.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
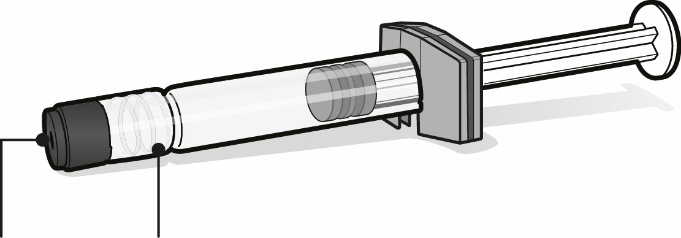
Durchstechflasche mit Antigenen für Abrysvo (Pulver) und Fertigspritze mit Lösungsmittel
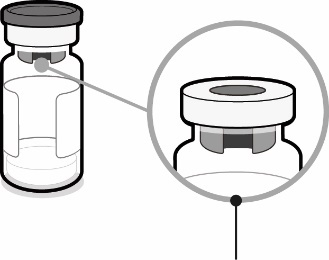
Pulver für 1 Dosis in einer Durchstechflasche (Typ-1- oder entsprechendes Glas) mit einem Stopfen (synthetischer Brombutyl-Kautschuk oder synthetischer Chlorbutyl-Kautschuk) und einer Flip-Off-Kappe
Lösungsmittel für 1 Dosis in einer Fertigspritze (Typ-1-Glas) mit einem Stopfen (synthetischer Chlorbutyl-Kautschuk) und einer Spritzenkappe (synthetischer Isopren-/Brombutyl-Mischkautschuk)
Durchstechflaschenadapter
Durchstechflasche mit Antigenen für Abrysvo (Pulver) und Durchstechflasche mit Lösungsmittel
Pulver für 1 Dosis in einer Durchstechflasche (Typ-1- oder entsprechendes Glas) mit einem Stopfen (synthetischer Brombutyl-Kautschuk oder synthetischer Chlorbutyl-Kautschuk) und einer Flip-Off-Kappe
Lösungsmittel für 1 Dosis in einer Durchstechflasche (Typ-1- oder entsprechendes Glas) mit einem Stopfen (Brombutyl-Kautschuk) und einer Flip-Off-Kappe
Packungsgrößen
Packung mit 1 Durchstechflasche mit Pulver (Antigene), 1 Fertigspritze mit Lösungsmittel, 1 Durchstechflaschenadapter mit 1 Injektionsnadel oder ohne Injektionsnadeln (Packung mit 1 Dosis).
Packung mit 5 Durchstechflaschen mit Pulver (Antigene), 5 Fertigspritzen mit Lösungsmittel, 5 Durchstechflaschenadaptern mit 5 Injektionsnadeln oder ohne Injektionsnadeln (Packung mit 5 Dosen).
Packung mit 10 Durchstechflaschen mit Pulver (Antigene), 10 Fertigspritzen mit Lösungsmittel, 10 Durchstechflaschenadaptern mit 10 Injektionsnadeln oder ohne Injektionsnadeln (Packung mit 10 Dosen).
Packung mit 5 Durchstechflaschen mit Pulver (Antigene) und 5 Durchstechflaschen mit Lösungsmittel (Packung mit 5 Dosen).
Packung mit 10 Durchstechflaschen mit Pulver (Antigene) und 10 Durchstechflaschen mit Lösungsmittel (Packung mit 10 Dosen).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Zur Verwendung der Durchstechflasche mit Antigenen für Abrysvo (Pulver), der Fertigspritze mit Lösungsmittel und des Durchstechflaschenadapters
Abrysvo muss vor Verabreichung durch Zugabe des gesamten Inhalts der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit Pulver unter Verwendung des Durchstechflaschenadapters rekonstituiert werden.
Der Impfstoff darf nur mit dem mitgelieferten Lösungsmittel rekonstituiert werden.
Vorbereitung der Verabreichung
Fertigspritze mit Lösungsmittel für Abrysvo | Durchstechflasche mit Antigenen für Abrysvo (Pulver) | Durchstechflaschenadapter | |||||||||||
 |  |  | |||||||||||
Spritzenkappe | Luer-Lock-Adapter | Stopfen der Durchstechflasche (Flip-off-Kappe entfernt) | |||||||||||
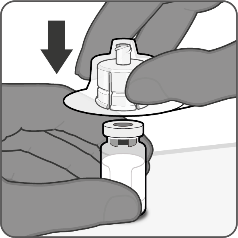 | Schritt 1. Durchstechflaschenadapter aufsetzen
|
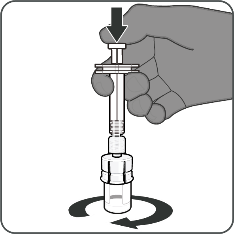 | Schritt 2. Pulverkomponente (Antigene) rekonstituieren, um Abrysvo zu erhalten
|
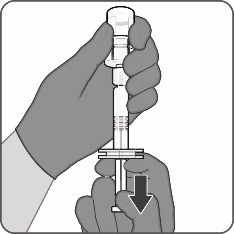 | Schritt 3. Rekonstituierten Impfstoff aufziehen
|
Der zubereitete Impfstoff ist eine klare und farblose Lösung. Den Impfstoff vor der Verabreichung einer Sichtprüfung auf große Partikel und Verfärbungen unterziehen. Nicht verwenden, wenn große Partikel oder Verfärbungen festgestellt werden.
Zur Verwendung der Durchstechflasche mit Antigenen für Abrysvo (Pulver) und der Durchstechflasche mit Lösungsmittel
Die Durchstechflasche mit Antigenen für Abrysvo (Pulver) darf nur mit der mitgelieferten Durchstechflasche mit Lösungsmittel rekonstituiert werden, um Abrysvo zu erhalten.
Vorbereitung der Verabreichung
Mit einer sterilen Nadel und einer sterilen Spritze den gesamten Inhalt der Durchstechflasche mit dem Lösungsmittel aufziehen und den gesamten Inhalt der Spritze in die Durchstechflasche mit dem Pulver injizieren.
Die Durchstechflasche vorsichtig mit kreisförmigen Bewegungen schwenken, bis sich das Pulver vollständig aufgelöst hat. Nicht schütteln.
0,5 ml aus der Durchstechflasche mit dem rekonstituierten Impfstoff aufziehen.
Der zubereitete Impfstoff ist eine klare und farblose Lösung. Den Impfstoff vor der Verabreichung einer Sichtprüfung auf große Partikel und Verfärbungen unterziehen. Nicht verwenden, wenn große Partikel oder Verfärbungen festgestellt werden.
Entsorgung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Brüssel
Belgien
EU/1/23/1752/001 – 1 Durchstechflasche (Antigene), 1 Durchstechflaschenadapter, 1 Fertigspritze (Lösungsmittel), 1 Injektionsnadel
EU/1/23/1752/002 – 1 Durchstechflasche (Antigene), 1 Durchstechflaschenadapter, 1 Fertigspritze (Lösungsmittel)
EU/1/23/1752/003 – 5 Durchstechflaschen (Antigene), 5 Durchstechflaschenadapter, 5 Fertigspritzen (Lösungsmittel), 5 Injektionsnadeln
EU/1/23/1752/004 – 5 Durchstechflaschen (Antigene), 5 Durchstechflaschenadapter, 5 Fertigspritzen (Lösungsmittel)
EU/1/23/1752/005 – 10 Durchstechflaschen (Antigene), 10 Durchstechflaschenadapter, 10 Fertigspritzen (Lösungsmittel), 10 Injektionsnadeln
EU/1/23/1752/006 – 10 Durchstechflaschen (Antigene), 10 Durchstechflaschenadapter, 10 Fertigspritzen (Lösungsmittel)
EU/1/23/1752/007 – 5 Durchstechflaschen (Antigene), 5 Durchstechflaschen (Lösungsmittel)
EU/1/23/1752/008 – 10 Durchstechflaschen (Antigene), 10 Durchstechflaschen (Lösungsmittel)
Datum der Erteilung der Zulassung: 23. August 2023
April 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.

VERKAUFSABGRENZUNG IN DEUTSCHLAND
Verschreibungspflichtig
REZEPTPFLICHT/APOTHEKENPFLICHT IN ÖSTERREICH
Rezept- und apothekenpflichtig, wiederholte Abgabe verboten
PACKUNGSGRÖSSEN IN DEUTSCHLAND
1 Durchstechflasche mit Pulver, 1 Durchstechflaschenadapter und 1 Fertigspritze mit Lösungsmittel (mit 1 Injektionsnadel) N1
10 Durchstechflaschen mit Pulver und 10 Durchstechflaschen mit Lösungsmittel N2
PACKUNGSGRÖSSEN IN ÖSTERREICH
1 Durchstechflasche mit Pulver, 1 Durchstechflaschenadapter und 1 Fertigspritze mit Lösungsmittel (mit 1 Injektionsnadel)
REPRÄSENTANT IN DEUTSCHLAND
PFIZER PHARMA GmbH
Friedrichstr. 110
10117 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
REPRÄSENTANT IN ÖSTERREICH
Pfizer Corporation Austria Ges.m.b.H.
Floridsdorfer Hauptstraße 1
A-1210 Wien
Tel.: +43 (0)1 521 15-0